不同环数多环芳烃对土壤白符跳(Folsomia candida)的毒性差异
2022-01-24张家乐赵龙郭军康侯红林祥龙王巍然刘玲玲
张家乐,赵龙,郭军康,侯红,林祥龙,王巍然,3,刘玲玲
(1.中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012;2.陕西科技大学环境科学与工程学院,西安 710000;3.山西农业大学资源与环境学院,山西 太谷 030801)
多环芳烃(PAHs)是一种疏水性芳香族化合物,由于其公认的致癌性、致畸变性以及致突变性被广泛关注[1]。因此,美国环境保护署将16 种含有2 至6 个碳环的PAHs 列为优先污染物[2]。PAHs 的主要来源是化石燃料的燃烧、石油泄漏以及森林火灾和火山喷发等。据统计,在世界范围内每年约有4.3 万t PAHs被排放到大气中,同时约有2.3 万t 进入海洋环境中[3]。我国的PAHs 排放总量为25 300 t,已经成为世界上PAHs 排放量最多的国家之一[4]。环境中的PAHs 分布十分广泛,大气、水体、土壤是其主要蓄积的三大场地。而土壤作为重要的环境介质,承担着90%以上的PAHs 环境负荷[5]。随着人们对PAHs 毒性及其环境风险越来越关注,国内外已开展了较多有关PAHs 对植物、微生物毒性的研究,而针对PAHs 对跳虫的生态毒性效应的研究较少[6−7]。
跳虫是一种分布广泛、数量丰富的土壤无脊椎动物,对土壤物质循环和土壤生物群落的维持起着至关重要的作用,也是国际标准化组织(ISO)用作评价污染物毒性的模式生物[8]。由于跳虫对污染物更加敏感,因此其一系列生命参数和行为效应都可作为土壤生态风险评价的终点[9]。国内开展土壤跳虫生态毒性的研究与发达国家相比较晚,且主要集中在重金属和农药等方面,在PAHs 方面的研究较少[10−11]。滤纸接触实验、土壤和食物暴露实验都是评价污染物毒性的常用方法。其中滤纸接触实验、短期土壤接触实验是用于评价污染物毒性大致范围的急性实验,滤纸接触实验虽然反映的是简化土壤溶液中化学品对跳虫的急性毒性,不能反映真实土壤环境下化学品对跳虫的毒性,但是该方法方便快捷,可用于有机污染物毒性的早期评估[12]。食物暴露实验可以消除土壤理化性质对跳虫的干扰,并可评价经口摄入污染物的毒性,该方法可以消除土壤理化性质对跳虫毒性的影响,也更针对污染物本身的毒性。慢性土壤实验是评估污染物风险时使用最多,结果也最为准确的手段,然而土壤理化性质会影响污染物的毒性,所以使用不同理化性质的土壤实验显得十分必要。
和其他有机污染物相似,PAHs 及其类似物的毒性和它们的结构及理化性质有关。有研究表明,不同类型PAHs 间的生态毒性差异很大,且PAHs 的生态毒性与其环数间并非呈简单正相关关系[13]。因此在评价PAHs 毒性效应时要考虑不同环数PAHs 的毒性。此外,现有的关于PAHs 毒性研究中仅使用了人工土壤或单一土壤,忽略了土壤性质对PAHs 毒性的影响,导致PAHs 的生态毒性无法进行量化。已有研究表明土壤理化性质(有机质、pH、CEC 等)对PAHs毒性有很大影响[14−15]。
本实验以跳虫为研究对象,参照ISO 标准方法指南以及其他参考文献[16−17],开展滤纸接触实验、土壤和食物暴露实验,研究3 种具有较强的健康毒性而受到重点关注的典型优先管控的PAHs——三环菲(Phe)、四环芘(Pyr)和五环苯并芘(BaP)对跳虫的急性、慢性毒性效应及其差异,并选取我国2 种理化性质差异明显的土壤(江西鹰潭红壤、黑龙江海伦黑土),研究外源添加PAHs 对跳虫生态毒性的影响,并比较PAHs 在不同土壤类型间的毒性差异,以积累和完善PAHs 毒性数据,为PAHs 土壤生态环境阈值的构建及生态风险评估提供重要的依据和支撑。
1 材料与方法
1.1 供试材料
主要试剂:菲(Phe)、芘(Pyr)、苯并芘(BaP),购自麦克林试剂网,固体颗粒,纯度均大于97%。
供试土壤:选取并采集江西鹰潭红壤(以下简称红壤)和黑龙江海伦黑土(以下简称黑土)2 种理化性质各异的农田土壤,采样的深度均为0~20 cm。供试土壤在室内条件下风干,剔除植物根系、残体以及石块后,过2 mm筛,测定土壤理化性质。具体测定方法为:土壤pH 值采用电极法使用0.01 mol·L−1CaCl2按照土水比1∶5 的方法测定;土壤有机质采用重铬酸钾容量法[18]滴定;阳离子交换量(CEC)采用三氯化六氨合钴浸提−分光光度法测定[19];碳酸钙含量采用中和滴定法测定;土壤中铁、锰、铝采用湿式消解法[18](HF−HClO4−HNO3)前处理后使用ICP−MS 测定;土壤黏土含量使用吸管法[20]测定。测定结果见表1。
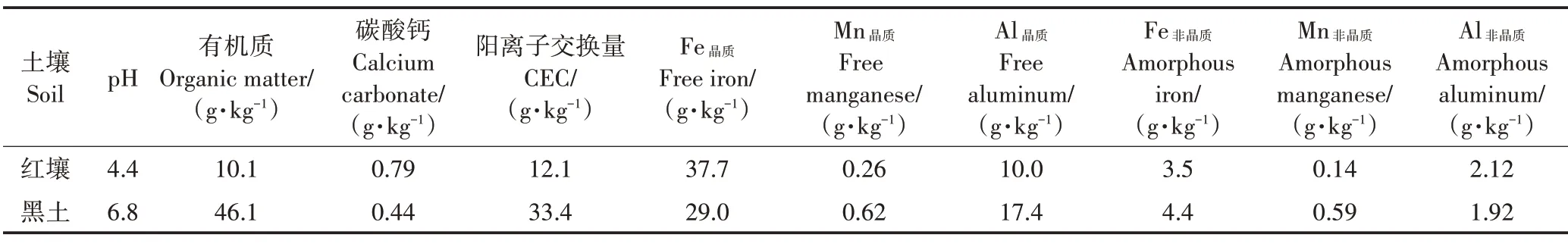
表1 供试土壤的理化性质Table 1 Physicochemical properties of the tested soil
1.2 供试白符跳
白符跳(Folsomia candida)由中国科学院南京土壤研究所提供,在本实验室培养超过3 a。培养方法参照ISO11267 标准,将白符跳虫饲养在特制的透明培养皿(80 mm×13 mm)中培养,底部填充厚度大约0.3~0.5 cm 厚的培养基(比例为1∶9 的活性炭与石膏)。添加适量干酵母(购于安琪公司)作为白符跳的食物。使用人工气候箱(宁波赛福实验仪器−智能生化培养箱SPX−450)控制饲养条件,温度控制到(20±1)℃,光照与黑暗时间比为16 h∶8 h(光照强度设置为400~800 lx),空气湿度设置为75%左右。每隔3 d为培养基表面添加适量去离子水以保持培养基表面湿润。每隔1~2 d 向培养基中补充适量酵母,同时清除培养基中的跳虫排泄物以及发霉的食物,保持培养基表面的清洁且处于湿润状态,每两个月更换一次培养基。
1.3 白符跳同龄化培养
只有年龄和大小相同的跳虫才可用于毒性实验,因此在正式毒性实验开始前需要对跳虫进行同龄化培养[10]。将个体大小相近且较为活跃的白符跳成虫转移至新的表面湿润且干净的培养皿上,加入少量干酵母,培养条件同上。隔2~3 d 观察到新制培养基表面上有大量褐色虫卵,待其孵化后添加少量干酵母,待孵化出的幼虫较多时移走成虫,继续培养7~9 d,即可得到用于毒性实验的10~12日龄的白符跳虫。
1.4 滤纸接触实验
滤纸接触实验参照OECD[21]的方法。将每个培养皿内衬滤纸,并用移液枪加入用丙酮溶解的PAHs 溶液,使其刚好浸透滤纸,待丙酮挥发后,用移液枪吸取1 mL 去离子水浸湿滤纸,并每隔12 h 补充适量去离子水。根据预实验结果明确PAHs 有效浓度范围后,设置6 个浓度组,分别对应为0、28.4、56.8、85.3、113.7 µg·cm−2和231.7 µg·cm−2。在各培养皿中放入10 只同步化的跳虫,每个浓度4 个重复,实验过程中不添加食物,然后放入(20±1)℃、相对湿度75%、黑暗的人工气候箱中培养,分别于3 d和7 d后记录跳虫死亡数。预实验中测试了不同浓度的丙酮对跳虫形态学的影响,丙酮最高浓度为13.5 mol·L−1,没有观察到明显的不良影响。
1.5 食物暴露实验
食物暴露实验参照林祥龙[22]的方法并有所改进。用酵母和PAHs−丙酮混合溶液混合制备食物暴露实验中跳虫的饲料,将PAHs和酵母混合物放在30 ℃黑暗中干燥24 h,然后放入25 mL 的塑料注射器中。根据预实验结果明确PAHs 有效浓度的范围后,将酵母中Phe 和Pyr 的添加总浓度设置为0、50、100、150、200 mg·kg−1,BaP 添加的总浓度设置为0、100、200、300、400、500 mg·kg−1。将约为5 mg 的染毒食物放在25 mm2小盖玻片上,接着放入培养皿中,添加10 只10~12日龄的跳虫,每个浓度重复4次,盖上盖子放入人工气候箱中培养28 d,培养条件同跳虫饲养条件。每周打开盖子通气3 次,并补充适量去离子水,待培养结束后,用水浮法对存活的成虫和幼虫进行计数。
1.6 土壤外源PAHs的添加
将适量的PAHs 标样(纯度≥97%)溶于10 mL 丙酮溶液,待其充分溶解后倒入30 g 土壤中,对2 种土壤进行人工外源添加。对照组只加入丙酮。根据预实验结果,将Phe 和Pyr 浓度设置为0、50、100、150、200 mg·kg−1,急性实验中将BaP 的浓度设置为0、50、100、200、400、500 mg·kg−1。慢性实验中将BaP 的 浓度设置为0、50、100、200、400、500、1 000 mg·kg−1。将外源添加PAHs 后的土壤放入通风橱中挥发24 h,加入适量蒸馏水,将土壤湿度调整到最大持水量的55%~60%。
1.7 土壤暴露实验
急性存活实验:称取30 g含水量为最大可持水量50%~55%的PAHs 污染土样于有机玻璃杯(直径6 cm、高11 cm)中,加入10只10~12 d大小的跳虫,每个浓度设4 个重复,加盖后放在人工气候箱中培养7 d,培养过程中不添加活性酵母,其他培养条件同跳虫饲养条件。由于活的跳虫体表存在油脂类物质,会漂浮到水面上,待培养结束后将玻璃瓶土壤轻轻倒入1 000 mL 大烧杯中,加适量纯净水,用玻璃棒由下至上轻轻搅动土壤悬浊液,静置1~2 min 后拍照保存。最后用Imange J[23]软件统计存活跳虫的个数。
慢性繁殖实验:称取30 g含水量为最大可持水量50%~55%的PAHs污染土样于有机玻璃杯(直径6 cm、高11 cm)中,加入10只10~12 d大小的跳虫,实验组处理设4个重复,对照组设6个重复,加入5 mg干酵母,旋紧盖子然后放入恒温培养箱中培养28 d,培养条件同跳虫饲养条件。一周开盖3次换气,并补充适量去离子水和干酵母,清除土壤表面发霉的食物。28 d培养结束后,用水浮法对存活的成虫和繁殖的幼虫进行计数。
1.8 土壤中PAHs含量的测定
从土壤中提取多环芳烃采用美国EPA 3550C法,然后用美国EPA 3630C 法在硅胶柱上纯化提取物。每个土壤样品与无水硫酸钠混合,加入回收率指标为:2−氟苯酚、苯酚−d6、2,4,6−三溴苯酚、硝基苯−d5、2−氟联苯、对二苯基−d14。用丙酮−正己烷(V/V=1∶1)超声浴萃取3 次,然后用旋转真空过滤浓缩,萃取溶剂交换成环己烷。用玻璃柱配以无水硫酸钠和硅胶对浓缩提取物进行净化。用戊烷预洗脱柱,另用环己烷将环己烷样品萃取物转移到柱上,完成转移后再加入戊烷,继续洗脱柱。接着用二氯甲烷−戊烷(V/V=2∶3)洗脱柱。最后洗脱液在氮气流中浓缩,在GC−MS 仪器上测定PAHs。使用标准的美国EPA 8270E 方法[24]测量16 种PAHs。采用HP−5 ms 毛细管柱(30 m×0.25 mm 内径,0.25 mm 膜厚)分离洗脱液中的PAHs,用氦气作为载气。烘箱初始温度设定为40 ℃、4 min,以10 ℃·min−1的速度增加到320 ℃,维持2 min,直到BaP洗脱。为保证数据质量,每10个样本进行重复样本分析。分析空白样品、平行样品和认证标准物质PAHs 的质量控制。PAHs 的标记回收率为88%~127%。
1.9 数据处理与分析
本研究计算了50%抑制繁殖浓度(EC50)和50%死亡率浓度(LC50)值,繁殖的EC50和生存的LC50及其95%置信区间使用SigmaPlot 12.5 软件的logistic 非线性模型进行计算:
式中:Y为各个不同处理浓度所对应的幼虫数或成虫存活数,只;X为土壤中PAHs 的实测浓度,mg·kg−1;k为不同浓度处理的对照组中幼虫数或成虫存活数;s为方程拟合过程中产生的斜率参数。X0为EC50值,mg·kg−1。计算LC50方法同上,只需将EC50代换为LC50即可。
采用单因素方差分析(ANOVA)评价显著性差异,P<0.05 为差异有统计学意义。不同土壤理化性质与PAHs阈值间的相关性分析使用皮尔逊相关系数,采用SPSS Statistics 21完成,图表绘制均使用Excel 2019以及Origin 8.5完成。
2 结果与分析
2.1 滤纸暴露条件下不同环数PAHs对跳虫的毒性差异
Phe、Pyr和BaP 溶液暴露3 d 和7 d 后跳虫成虫存活数如图1所示,随着PAHs浓度的增加,跳虫数量呈下降趋势。但在最高浓度暴露7 d 后,Phe 和Pyr 溶液中的跳虫数量显著下降(P<0.05),跳虫几乎全部死亡。暴露时间和暴露浓度与跳虫死亡率显著相关(P<0.05)。在BaP溶液中,跳虫的数量随着BaP浓度的升高而减少,在最高浓度时,与对照相比,跳虫数仅减少40%。计算出的丙酮溶液中Phe、Pyr、BaP影响跳虫存活的3 d和7 d的LC50如表2所示。

表2 PAHs在滤纸接触实验中的阈值Table 2 The threshold value of PAHs in filter paper contact test
2.2 土壤中3 种不同环数PAHs对跳虫急性毒性差异
3种PAHs在两种土壤中的实测浓度如表3所示,从表中可以看出,3 种PAHs 的实测浓度和名义浓度较为接近,但是红壤在各个浓度下可提取PAHs 的量均稍高于黑土。对比Phe、Pyr和BaP可提取的量可以看出,BaP的可提取量均高于Phe和Pyr。
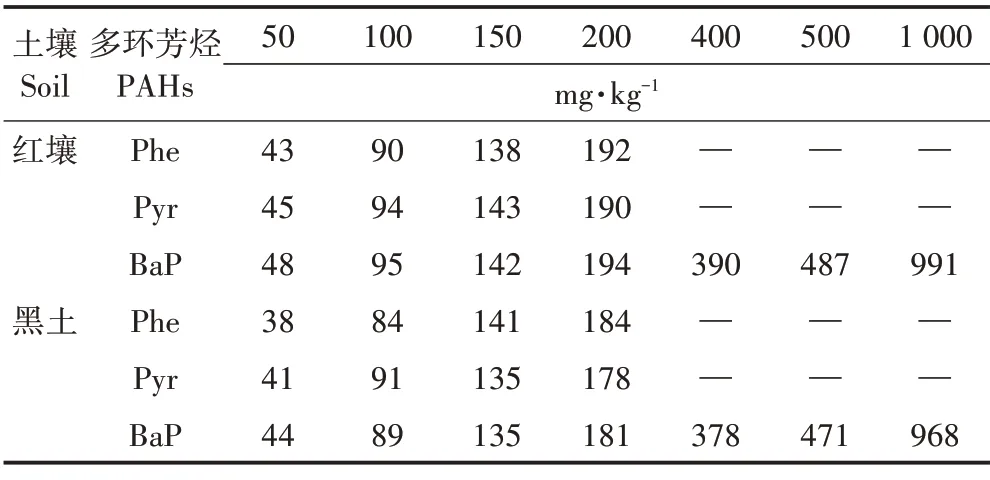
表3 不同外源添加浓度下PAHs在土壤中的实测浓度(mg·kg−1)Table 3 Measured concentration of PAHs in soil under different addition concentrations(mg·kg−1)
跳虫暴露在菲(Phe)、芘(Pyr)和苯并芘(BaP)污染的红壤和黑土中7 d 后的生存情况如图2 所示。经过7 d 的暴露,对照组土壤中的跳虫死亡率均小于20%,从而保证了实验的有效性。先前预实验表明,丙酮对跳虫没有影响,因此可以认为跳虫的毒性反应是由PAHs−丙酮溶液中的PAHs 引起的。Phe、Pyr、BaP 的添加对存活率的影响很大。在红壤中,BaP 显著增加了跳虫的死亡率,在最高浓度(500 mg·kg−1)时死亡率达到100%。但在黑土中没有明显的剂量−效应关系,所有测试浓度的死亡率都很低(图2a)。在Phe 和Pyr 污染的土壤中,跳虫存活数量随着Phe 和Pyr 浓度提高而减少,表现出明显的剂量−效应关系(图2b、图2c)。跳虫的存活率在红壤和黑土中有明显差异(P<0.05)。Phe 和Pyr 在最高浓度200 mg·kg−1时在红壤中对跳虫的致死率分别是100.0%和49.3%,在黑土中对跳虫的致死率分别是92.2%和62.5%。由表4 可知,急性实验中Phe 在红壤和黑土中对跳虫的LC50分别是57 mg·kg−1(18~81 mg·kg−1)和180 mg·kg−1(122~2 450 mg·kg−1),Pyr 在红壤和黑土中对跳虫的LC50分别是69 mg·kg−1(7~106 mg·kg−1)和161 mg·kg−1(109~650 mg·kg−1)。
2.3 土壤中3 种不同环数PAHs对跳虫慢性毒性差异
28 d 的暴露结束后两种土壤对照组中幼虫数量均高于100 只,符合ISO 关于慢性实验有效性的标准[25]。如图3 所示,随着土壤中PAHs 浓度的升高,跳虫的繁殖数均明显下降(P<0.05)。在最高浓度下,3种PAHs 的致死率在60%~100%。在两种土壤中,跳虫的繁殖数差异比较明显,BaP 浓度为500 mg·kg−1时,在红壤和黑土中对跳虫繁殖的抑制率分别是87.1%和17.6%。Phe 浓度为100 mg·kg−1时,在红壤和黑土中对跳虫繁殖的抑制率分别是62.5% 和53.6%。Pyr 在100 mg·kg−1时,在红壤和黑土中对跳虫繁殖的抑制率分别是82.3%和47.9%。
由表4 可知,慢性实验中Phe 在红壤和黑土中对跳虫的EC50分别是67 mg·kg−1(37~96 mg·kg−1)和92 mg·kg−1(87~97 mg·kg−1),Pyr 在红壤和黑土中对跳虫的EC50分别是35 mg·kg−1(25~44 mg·kg−1)和94 mg·kg−1(75~113 mg·kg−1),BaP 在红壤和黑土中对跳虫的EC50分别是372 mg·kg−1(342~402 mg·kg−1)和931mg·kg−1(751~1 113 mg·kg−1)。
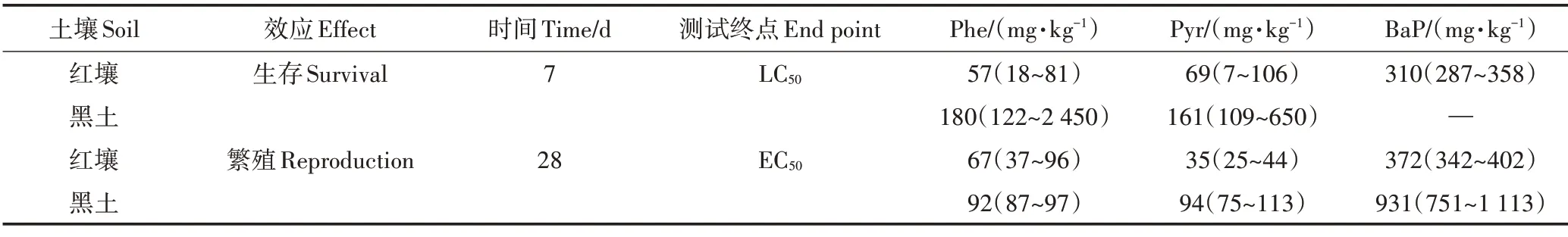
表4 基于实测值推导的PAHs对白符跳生存的LC50和白符跳繁殖的EC50值Table 4 The LC50 values for the survival and EC50 values for the reproduction of Folsomia candida based on measured PAHs
2.4 食物中3种不同环数PAHs对跳虫的慢性毒性
如图4 所示,不同浓度Phe、Pyr、BaP 处理下跳虫成虫均无明显死亡,成虫存活率均在80%以上。幼虫的繁殖量随食物中Phe 和Pyr 浓度的升高而减少,具有明显的剂量−效应关系。在150 mg·kg−1浓度下,Phe 和Pyr 对繁殖的抑制率分别为41%、69%;在200 mg·kg−1浓度下,Phe 和Pyr 对繁殖的抑制率分别为48%和73%。然而,不同质量分数的BaP 对存活率和繁殖率没有影响(图4a)。在实验中发现被PAHs 污染的食物会使成虫的体长变短,幼虫停止发育,并且随着食物中PAHs 浓度的升高而更加明显。经计算,食物中Phe 和Pyr 对跳虫繁殖的EC50分别为278 mg·kg−1(186~336 mg·kg−1)和363 mg·kg−1(298~427 mg·kg−1),由于BaP 在食物暴露实验中不存在剂量效应关系,因此无法计算其EC50或LC50值。
3 讨论
PAHs由于其在环境中引起的健康问题而被广泛关注。人们普遍认为随着PAHs 环数的增高其毒性增大[26−27],但是现有研究表明PAHs 的生态毒性与其环数并非正相关关系。本研究从不同暴露方式、暴露时间表征了3 种不同环数PAHs 的毒性效应以及差异。结果表明,Phe、Pyr、BaP 在不同暴露实验中均表现出Phe 和Pyr 的毒性远大于BaP 的毒性。与Phe 和Pyr 的毒性阈值不同,BaP 的生存或繁殖的毒性阈值在大多数情况下无法计算,这与之前PAHs 对跳虫毒性的研 究一致[28]。SVERDRUP 等[6]研究了PAHs 对跳虫的生态毒性,计算出Phe、Pyr 和BaP 3 种PAHs 的EC10分别是23、10 mg·kg−1和840 mg·kg−1,Phe 和Pyr的急性毒性远大于BaP,与本研究的结果一致。有关PAHs对跳虫的研究十分有限,但从有限的PAHs对生态受体毒性的研究中发现,PAHs的毒性和其水溶性、土壤有机质含量有关[6]。跳虫类昆虫主要与土壤的孔隙水接触而产生毒性效应,土壤中的PAHs 类疏水性有机污染物很容易与土壤有机质结合从而降低其在孔隙水中的浓度,从而减少对跳虫类无脊椎动物的伤害[24]。HENNER 等[29]在外源添加31~155 mg·kg−1的PAHs的土壤中培养卢珊豆,结果表明苯并[a]蒽、苯并[a,h]蒽、苯并芘对卢珊豆种子的萌发没有抑制作用。大量研究表明,辛醇−水的分配系数是影响PAHs 生物有效性的关键因素之一[30]。由于低环数萘(Nap)的亲水性远高于BaP,所以Nap 更容易进入土壤孔隙水中,从而也更易被蚯蚓和卢珊豆以被动扩散的方式吸收。相反脂溶性较高的苯并芘则更容易被土壤颗粒吸附并且结合在土壤的黏粒组分中[31],从而表现出对蚯蚓和卢珊豆较低的生物有效性。
跳虫的死亡和繁殖仅对浓度相当高的PAHs 产生响应。在本研究中发现在低浓度时,跳虫的成虫和幼虫的体长相对变短,并且随着PAHs 浓度的升高而越发明显。有文献报道[28]在BaP 高浓度胁迫下,跳虫的生长和繁殖均无明显变化,但是成虫和幼虫的体长变化明显,并且幼虫体长敏感性高于成虫,受到抑制程度更高,500 mg·kg−1BaP处理的幼虫体长较对照组显著降低4%。这可能是因为幼体的比表面积比成体大,更容易暴露在污染物中。长时间暴露在环境中的幼虫,从孵化到成长的过程中体内积累了PAHs,因此比成虫更容易受到污染[32]。
不同理化性质土壤中PAHs的环境行为不同,因此在不同土壤中毒性差异明显。在本研究中,当土壤中PAHs 含量相同时,红壤总是表现出对跳虫最强的毒性。从可提取PAHs 的量可以看出,红壤中可提取PAHs 的量高于黑土,这是由于黑土中有较高的有机质,使其更容易吸附土壤中的PAHs,然而土壤中吸附的PAHs中只有一小部分是生物有效的,大部分由于与土壤有机质的强烈相互作用或扩散到纳米级孔隙中而被封闭,从而无法被利用和降解[33],并且疏水性越强的PAHs 越容易被隔离[31]。在本研究的3 种PAHs(Phe、Pyr和BaP)中,BaP的疏水性最强,这可能是其在土壤中的毒性低于其他两种PAHs的原因之一。土壤pH值通常被认为是影响土壤有机污染物在土壤中的微生物活性的另一个重要因素,可能影响PAHs的毒性[34]。由于红壤中pH偏低,不适合大部分真菌生存,因此PAHs的分解速率较慢,表现出较高的毒性。另外,pH还会影响PAHs在土壤中的化学行为,PAHs主要与土壤中有机质组分(腐殖质)结合,腐殖质胶体一般带负电,低pH有助于疏水性有机污染物吸附在腐植酸等复合体上,降低PAHs在水溶液中的分配比,从而减少对跳虫类无脊椎动物的影响[35];但另一方面,低pH对跳虫的生长具有较强的抑制作用[36]。由于本研究中红壤的pH 较低(4.4),已经处于白符跳适宜生长范围的边缘,因此土壤有机质和pH共同主导了PAHs在土壤中的毒性。
4 结论
(1)3 种PAHs 对土壤跳虫的生态毒性大小为Pyr(四环)>Phe(三环)>BaP(五环)。
(2)土壤理化性质对PAHs 的毒性具有显著影响,因此在进行PAHs 毒性阈值确定时需考虑土壤理化性质的影响。
(3)由于BaP 的生态毒性较小,在后续研究对跳虫的影响时,需选取更加敏感的指标(如成虫及幼虫体长)来评价其在土壤中的生态毒性。