茉莉酸对马铃薯苗期低温胁迫耐性的影响
2022-01-24刘计涛王梦诗索海翠罗焕明李成晨单建伟廖永珊李小波
刘计涛,王梦诗,索海翠,罗焕明,王 丽,李成晨,单建伟,廖永珊,李小波
(广东省农业科学院作物研究所/广东省农作物遗传改良重点实验室,广东 广州 510640)
【研究意义】马铃薯(Solanum tuberosum)是我国重要的粮菜兼用作物,总产量和种植面积均居世界首位,在保证国家粮食安全和蔬菜周年供应中发挥重要作用,是高效农业的重要组成部分。马铃薯为喜冷凉不耐低温作物,容易遭受冬春季自然寒害,严重影响产量。茉莉酸是重要的植物激素之一,在调节非生物胁迫和生物胁迫中发挥了重要的功能,但关于茉莉酸影响马铃薯抗寒性的研究还较少,因此,探索茉莉酸对马铃薯低温胁迫耐性的影响,有助于解析马铃薯抗寒生理机制,并为其在生产中推广应用提供参考。【前人研究进展】低温胁迫是威胁温带和热带植物的主要环境因素之一[1],会导致植物中活性氧(ROS)过度积累造成核酸、蛋白质和脂质等大分子物质的氧化损伤,最终破坏细胞功能,造成植物死亡[2][3]。茉莉酸(JA)是一种重要的植物激素,其参与调节许多生理进程,如根抑制[4]、花青素积累[5]、毛状体形成[6]、雄性发育[7-8]、叶片衰老[9-11]、生物和非生物胁迫响应等[12-16]。前人的研究表明,外源处理MeJA 能够显著提升模式植物拟南芥在非冷驯化条件下的抗寒性[17],以及冷胁迫下水稻幼苗的存活率[18],在番茄中JA 能够促进腐胺的合成降低氧化胁迫提高低温胁迫耐性[19]。外源JA 处理能够通过缓解氧化胁迫,维持细胞稳态和提高抗氧化能力增强紫苏、颠茄、小麦的抗寒性[20-22]。ICE(Inducer of CBF expression)—CBF 转录调节模块在植物低温胁迫响应中起着重要的作用[23],在拟南芥中低温胁迫能够激活ICE-CBF 蛋白诱导大量的COR(Coldregulated)基因的表达,最终提升拟南芥的低温胁迫耐性[24]。有研究报道,JA 能够正调节ICE-CBF 通路,增强拟南芥的低温胁迫耐性[17]。这些研究表明,JA 在调节植物低温胁迫耐性中发挥重要的功能。在马铃薯中,前人的研究发现JA能够提升马铃薯对晚疫病的抗性[25],影响块茎发育等[26],而关于JA 调节马铃薯抗寒性的研究还较少。因此,探索JA 调节马铃薯抗寒的机制对于马铃薯抗寒育种和栽培具有重要意义。【本研究切入点】以马铃薯冬作区主栽品种费乌瑞它为研究对象,针对冬作区寒害频发严重影响产量这一现状,以及农民对马铃薯抗寒栽培技术和品种的需求,利用外源JA 处理并通过酶活性分析和抗寒相关基因CBF的表达模式确定马铃薯最适JA 使用浓度。【拟解决的关键问题】探讨JA 调节马铃薯低温胁迫耐性的最适浓度,以及其对马铃薯活性氧及其清除酶的影响,揭示JA 影响马铃薯抗寒性的生理特性。
1 材料与方法
1.1 试验材料
供试马铃薯品种为费乌瑞它,种薯购自天津市天兴佳业科技有限公司,保存于冷库中,试验前放置于室内待种薯发芽后切块,在实验室光照培养室进行盆栽;供试盆规格为盆底直径22 cm,高25 cm,盆口直径30 cm;基质为草炭土混合珍珠岩比例为2∶1。
茉莉酸购自上海麦克林生化科技有限公司,用适量无水乙醇彻底溶解后,再缓慢加入水定容至0.1 mol/L作为母液,然后根据试验所需浓度(50、100、200、400 μmol/L)进行稀释定容,以去离子水作对照。
1.2 试验方法
1.2.1 样品处理与采集 试验于2021 年9 月11日在广东省农作物遗传改良重点实验室进行,马铃薯出苗2 周的盆栽苗,每盆保留1~2 棵长势一致的幼苗,继续在长日照(光照16 h)条件下培养2 周后备用。选取25 盆长势一致的马铃薯盆栽苗平均分为5 组,每组5 个生物学重复,分别用50、100、200、400 μmol/L 茉莉酸和去离子水喷施叶片,24 h 后放入低温光照培养箱(达斯卡特DGZC-P1000B),以-2 ℃低温胁迫处理5 h,分别选取处理0、5 h 顶部生长第3~4 片功能叶置于液氮中,用于下一步分析。
1.2.2 测定项目及方法 过氧化氢含量:采用过氧化氢含量检测试剂盒(BC3590,北京索宝莱科技有限公司),将马铃薯叶片于液氮中研磨成粉末,称取0.1 g 加入1 mL 丙酮提取液并迅速涡旋震荡混匀,并置于冰上10 min 充分反应,4 ℃、8 000 g 离心10 min,取全部上清液,置冰上待测,然后参照试剂盒测定方法,用分光光度计进行测定,调整波长至415 nm,记录吸光值,蒸馏水调零。计算公式为:
H2O2(μmol/g )=ΔA测定÷ΔA标准÷W
式中,ΔA测定=A测定管-A空白管,ΔA标准=A标准管-A空白管,A 为波长415 nm 处吸光度OD415,W 为样品质量(g)。
马铃薯过氧化氢酶(CAT)活性:采用过氧化氢酶活性检测试剂盒(BC0200,北京索宝莱科技有限公司),将马铃薯叶片于液氮中研磨成粉末,称取0.1 g 样本加入1 mL 提取液并迅速涡旋震荡混匀,并置于冰上10 min,4 ℃、8 000 g 离心10 min,取全部上清液,置冰上待测,然后参照试剂盒测定方法,用分光光度计进行测定,调整波长至240 nm,记录吸光值,蒸馏水调零。取1 mL CAT 检测工作液于1 mL 石英比色皿中,再加入35 μL 酶提取液,混匀5 s,室温下立即测定240 nm 下的初始吸光值A1 和1 min 后的吸光值A2。
CAT 活性(U/g )=678×ΔA÷W
式中,ΔA=A1-A2,A 为波长240 nm 处吸光度OD240,W 为样品质量(g)。
马铃薯过氧化物酶(POD)活性:采用过氧化物酶活性检测试剂盒(BC0090,北京索宝莱科技有限公司),将马铃薯叶片于液氮中研磨成粉末,称取0.1 g 样本加入1 mL 提取液并迅速涡旋震荡混匀,并置于冰上10 min,4 ℃、8 000 g 离心10 min,取全部上清液,置冰上待测,然后参照试剂盒测定方法,用分光光度计进行测定,调整波长至470 nm,记录吸光值,蒸馏水调零。在1 mL 玻璃比色皿中按顺序加入试剂盒试剂,立即混匀并计时,记录470 nm 下30 s 的吸光值A1 和90 s 后的吸光值A2。
POD 活性(U/g )=7133×ΔA÷W,ΔA=A2-A1
超氧化物歧化酶(SOD)活性:采用超氧化物歧化酶活性检测试剂盒(BC0170,北京索宝莱科技有限公司),将马铃薯叶片于液氮中研磨成粉末,称取0.1 g 样本加入1 mL 提取液并迅速涡旋震荡混匀,并置于冰上10 min,4 ℃、8 000 g离心10 min,取全部上清液,置冰上待测,然后参照试剂盒测定方法,加入测定试剂后充分混匀,37 ℃水浴30 min 后,置于1 mL 玻璃比色皿测定560 nm 下的吸光度,蒸馏水调零。

式中,ΔA测定=A测定-A对照,ΔA空白=A1空白-A2空白,A 为波长560 nm 处吸光度OD560,W 为样品质量(g)。
1.2.3 基因表达分析 分别在Solanaceae Genomics Resource网站(www.spuddb.uga.edu/index.shtml)数据库获得MYC2和CBF1-3的序列,利用NCBI Primer Blast进行引物设计(表1)和特异性比对分析。以JA处理马铃薯叶片提取的RNA,利用反转录试剂盒(擎科,Code No.TSK302M)得到cDNA模板,采用2×TSINGKE®Master qPCR Mix(SYBR Green I with UDG)(擎科,Code No.TSE203)进行实时荧光定量(QRT-PCR)分析,ef1a作为内参基因,获得不同基因的相对表达量,数据分析采用2-ΔΔCt法。每个样品3次生物学重复,3次技术重复。

表1 引物序列信息Table 1 Information of primer sequences
2 结果与分析
2.1 JA 对马铃薯活性氧含量的影响
由图1 可知,JA 处理24 h 后马铃薯叶片过氧化氢的含量随着JA 浓度的增加显著降低,对照过氧化氢含量最高为0.856 μmol/g,其中50 μmol/L JA 处理过氧化氢含量略有降低但不显著,100 μmol/L JA 处理后开始显著降低,以200 μmol/L JA处理后达到最低点0.275 μmol/g,400 μmol/L JA处理比200 μmol/L JA 处理略有升高但均比对照显著降低;经低温胁迫4 h 后,与低温胁迫前相比过氧化氢含量均显著升高,且趋势与低温胁迫前一致,其中对照的过氧化氢含量仍是最高、为2.176 μmol/g,200 μmol/L JA 处理最低、为1.139μmol/g。这表明JA 浓度为200 μmol/L 的处理效果最好,其次为400 μmol/L。
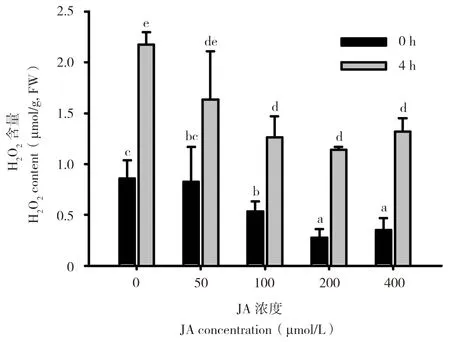
图1 不同JA 浓度处理对低温胁迫条件下过氧化氢含量的影响Fig.1 Effects of different JA concentrations on hydrogen peroxide content under cold stress
2.2 JA 对活性氧清除酶活性的影响
2.2.1 过氧化氢酶(CAT)活性 由图2 可知,JA 处理24 h 后,马铃薯叶片CAT 活性总体随着JA 浓度增加而增强,与蒸馏水对照相比,50 μmol/L JA 处理4 h 后CAT 活性由163.01 μmol/g 增加至325.07 μmol/g,显著增强1.99 倍,100、200、400 μmol/L JA 处理的CAT 活性比50 μmol/L JA 处理略有升高但不显著,分别为对照的2.16、2.31、2.33 倍;低温胁迫4 h 后,与胁迫前(0h)相比,蒸馏水对照的CAT 活性由163.01 μmol/g 增加至328.13 μmol/g,显著增强2.01 倍,而50 μmol/L JA 处理的CAT 活性变化不明显,但100、200、400 μmol/L JA 处理的CAT 活性显著增强,分别为367.83、426.56、455.76 μmol/g,为对照的1.12、1.30、1.39 倍。表明200 μmol/L JA 处理效果最好,其次为100、400 μmol/L JA 处理。

图2 不同JA 浓度处理对低温胁迫条件下CAT 活性的影响Fig.2 Effects of different JA concentrations on CAT activity under cold stress
2.2.2 过氧化物酶(POD)活性 如图3 所示,与蒸馏水对照相比,50 μmol/L JA 处理24 h 后,马铃薯叶片POD 活性变化不显著;当JA 浓度增加至100 μmol/L 时,POD 活性由89.59 U/g 显著增加至171.73 U/g,为对照的1.3 倍;JA 浓度继续增加至200、400 μmol/L 时,POD 活性分别为对照的2 倍(181.24 U/g)和2.1 倍(195.05 U/g)。低温胁迫4 h 后POD 活性比0 h 显著增强,与蒸馏水对照相比,50 μmol/L JA 处理的POD 活性略有增强但不显著;JA 浓度增加至100 μmol/L 时,POD 活性比对照增强1.81 倍;200 μmol/L JA 处理的POD 活性显著提升,为对照的2.53 倍;400 μmol/L JA 处理与200 μmol/L JA 处理效果相似,为对照的2.63 倍。表明低温胁迫400 μmol/L JA处理的POD 活性最强,其次为200、100 μmol/L JA 处理。

图3 不同JA 浓度处理对低温胁迫条件下POD 活性的影响Fig.3 Effects of different JA concentrations on POD activity under cold stress
2.2.3 超氧化物歧化酶(SOD)活性 如图4 所示,将马铃薯植株进行JA 处理24 h 后,与蒸馏水对照(SOD 活性为166.32 U/g)相比,50 μmol/L JA 处理的SOD 活性(151.52 U/g)没有发生显著变化,而100 μmol/L JA 处理后SOD 活性(108.61 U/g)降低35%,200、400 μmol/L JA 处理后SOD活性分别降低70.7%(SOD 活性为48.67 U/g)和61.4%(SOD 活性为64.12 U/g);低温胁迫处理4 h 后,与对照相比,50 μmol/L JA 处理的SOD 活性没有发生显著变化,但100 μmol/L JA 处理后SOD 酶活性增强32.8%,200、400 μmol/L JA 处理后SOD 活性分别增强64.4%和112.6%。表明在正常条件下JA 处理抑制了SOD 活性,且以200 μmol/L 效果最显著,而在低温胁迫处理后,SOD活性随着JA 浓度的增加而增强。

图4 不同JA 浓度处理对低温胁迫条件下SOD 活性的影响Fig.4 Effects of different JA concentrations on SOD activity under cold stress
2.3 JA 对马铃薯CBF 基因表达的影响
如图5 所示,马铃薯植株经JA 和低温胁迫处理后,检测JA 响应Marker 基因MYC2的表达,结果发现,在正常条件下JA 处理促进了MYC2 基因的表达,并且在100 μmol/L JA 处理后达到峰值,为对照的4.3 倍;进一步进行低温胁迫处理4 h,MYC2 的表达与0 h 相比均有显著地增强,其中100、200、400 μmol/L JA 处理分别比对照增强2.17、2.28、2.31 倍,表明JA 处理结果是可靠的。随后分别对马铃薯CBF1、CBF2和CBF3的表达进行分析,结果(图5)显示,JA 处理24 h 后诱导3个CBF基因的表达,其中CBF1基因的表达在100 μmol/L JA 处理后达到最强,CBF2基因的表达在200 μmol/L JA 处理后最高,CBF3基因则在400 μmol/L JA 处理后效果最好;进一步的低温胁迫处理4 h 后,发现3 个CBF基因的表达与0 h 对比均有显著诱导,与对照相比,CBF1、CBF2、CBF3基因的表达在分别在50、100 μmol/L JA 处理后效果最好。表明JA 处理能够增强抗寒关键基因CBF的表达,进一步提升马铃薯的抗寒性。
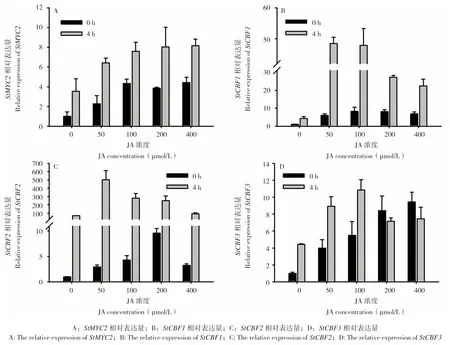
图5 不同JA 浓度处理及低温胁迫对StCBFs 基因表达的影响Fig.5 Effects of different JA concentrations on the expression of StCBFs under cold stress
3 讨论
低温是限制植物生长、种群地理分布和农艺性状的重要环境因子[27]。许多植物已经进化出适应低温气候的能力,并表现出局部的适应性状[28]。低温胁迫会诱导植物产生大量的活性氧(ROS),进而造成植物膜脂过氧化,细胞膜系统损伤,甚至细胞死亡,最终会影响植物的正常生长[29]。在许多植物中已经有研究表明,JA 参与调节ROS 的平衡机制,并且是通过影响ROS清除酶的活性实现的。本研究以马铃薯植株为研究对象,通过监测不同浓度JA 对低温胁迫条件下马铃薯植株ROS 清除酶活性的影响,筛选提升马铃薯植株抗寒性最适的JA 浓度,旨在为实践生产中应用JA 提供一定参考。本研究发现,随着JA 处理浓度的提升,马铃薯叶片中过氧化氢的含量显著降低,并且以200 μmol/L JA 处理效果最明显,而低温胁迫处理后各处理的过氧化氢含量均显著增加,但100、200、400 μmol/L JA处理的过氧化氢含量显著低于对照,表明JA 能够显著抑制过氧化氢的积累。同样地,进一步分析ROS 清除机制中的3 种酶的活性,发现100、200 μmol/L JA 处理后CAT、POD 活性显著升高,表明JA 通过调节CAT 和P OD 活性[30]来调节马铃薯叶片细胞内ROS 的平衡,进而影响抗寒性;然而,SOD 活性在常温和低温胁迫条件下呈现出相反的趋势,这可能是由于常温条件下JA 促进CAT 和POD 活性降低了过氧化氢的含量,进而导致SOD 活性维持在较低水平,而在低温胁迫下过氧化氢含量显著升高,促进了SOD 活性提升,且此时JA 起着正调节的作用[30-31]。
CBF家族基因是植物响应低温胁迫的关键转录因子[23,32-33]。研究发现,在许多植物中,低温胁迫能够激活CBF1-3的积累,并激活其下游COR(Cold-related)基因的表达,以提升植物的抗寒性[24,34]。JA 能够正调节ICE-CBF 信号途径,增强植物的抗寒性[35]。本研究发现,在马铃薯中,JA 处理能够诱导JA 信号Marker 基因MYC2的表达,表明JA 处理结果可靠;进一步对CBF1-3的表达进行分析表明,JA 处理能够促进CBF1-3的表达,以100、200 μmol/L JA 处理效果最为显著。经低温胁迫处理后,与正常条件相比,3 个CBF基因的表达均被诱导上调,以50、100 μmol/L JA处理表达最高,且CBF2变化倍数最高达500多倍,可能作为主效基因,其次为CBF1和CBF3。其原因可能是低温胁迫促进了内源JA 的积累[29],从而促进了CBF1-3基因的表达。
4 结论
本研究结果表明,低温胁迫条件下外源JA处理能够提升马铃薯叶片活性氧清除酶CAT、SOD 和POD 活性,抑制活性氧的积累,提升马铃薯的低温胁迫耐性,并且在一定范围内(0~400 μmol/L)随着JA 浓度的增加ROS 清除酶的活性呈现出增强的趋势;马铃薯适宜的茉莉酸处理浓度范围为100~400 μmol/L,其中以200 μmol/L 效果最佳,此时能够将活性氧清除酶CAT、POD 和SOD 活性分别提升30%、153%和64%,活性氧含量降低47.6%。此外,外源施加JA 能够显著促进抗寒关键基因StCBFs的表达,提升马铃薯的抗寒性,在实际生产中遭遇低温寒潮时,可适当施用JA,减少损失。
