基于广泛靶向脂质组学与近红外技术的高低油酸花生鉴评
2022-01-24邓权清洪彦彬李海芬梁炫强王润风李少雄陈小平
邓权清,鲁 清,刘 浩,洪彦彬,李海芬,梁炫强,王润风,李少雄,陈小平
(广东省农业科学院作物研究所/广东省农作物遗传改良重点实验室,广东 广州 510640)
【研究意义】花生(Arachis hypogaeaL.)是一种世界性的油料和蛋白质作物,也是我国四大油料作物之一,其单产和总产长期居油料作物之首[1]。近年来,我国花生食品加工发展迅速,除了传统食用植物油和副食品外,还开发出极具竞争优势的花生营养健康产品[2]。油酸是单不饱和脂肪酸,有较高的氧化稳定性,能有效预防心血管疾病[2-3]。高油酸花生(油酸含量>50%)突出的保健作用与经济效益,使得选育高油酸花生品种成为国内花生品质改良育种的目标之一[3]。与其他植物油相比,高油酸花生油具有货架期长、不饱和脂肪酸含量高(如油酸与亚油酸含量占油脂80%)、无豆腥和不含植物芥酸等特点,越发受到花生榨油企业与消费者青睐[4]。脂质作为花生油脂的主要成分,其代谢物的转化、合成与降解过程能够动态地影响着花生油脂的品质[5]。然而,由于脂质种类多(其中主要成分为甘油三酯混合物),分子结构复杂,现阶段鲜有对花生脂质准确定性定量的研究[6-7]。因此,探索一种能甄别品种与鉴评品质的检测方法,不仅能提高花生育种效率,还能为食品安全提供有效分析手段。
【前人研究进展】花生栽培种属于异源四倍体豆科作物,与其他模式作物相比,花生的基础研究相对薄弱[8]。花生品种鉴定主要通过形态特征和表型观察,该法可靠性差、难以批量化操作[9]。随着分子标记辅助选择育种技术在作物育种中普遍应用,花生种质也开发出大量的分子标记,如SSR、AFLP、RAPD 和RFLP 等[10-13],但由于这些分子标记特异性与重复性欠佳,导致分析结果可能有所差异。此外,植物油脂的质量鉴定主要通过检测脂肪酸的含量与成分,即脂肪酸分析水平[7]。近年来,油脂研究人员对脂质分子结构与组成的研究愈发深入,直接推动植物油脂检测提升至脂质分子层面[6-7]。
【本研究切入点】脂质组学是通过采用超高效液相色谱-串联质谱(Ultra performance liquid chromatography tandem mass spectrometry,UPLCMS/MS)技术对所有内源性高丰度的脂质分子进行定性定量分析,从而更直观地了解生物体内各种脂质代谢与合成的机理[6]。而应用近红外光谱分析技术(Near infrared spectroscopy,NIRS)能够准确快速、批量化与标准化地测定这些花生品质指标[4]。本研究所利用得广泛靶向脂质代谢组技术综合传统靶向与非靶向代谢组检测方法,通过检测平台的自建数据库MWDB(Metware database)及代谢物信息公共数据库,与多元统计分析相结合的手段研究样品间的脂质组差异[14-16]。同时,将脂质与蛋白质含量作为考察花生品质的主要指标[2]。
【拟解决的关键问题】本研究通过利用广泛靶向脂质代谢组分析技术获得高油酸花生与普通花生的核心差异脂质代谢物,结合近红外标准化测定的品质指标,运用多元统计分析,进而聚类生成可视化的特征图谱,最终实现从表型与脂质分子层面鉴评花生品种。
1 材料与方法
1.1 试验材料
供试材料选取两个高、低油酸花生品种,高油酸品种开农1715(KN1715)、低油酸品种冀花7 号JH7H。试验材料于2020 年秋季(7—11 月)种植在广东省农业科学院白云试验基地(113′ 44″E,23′ 39″N)。田间试验采用随机区组设计,每小区种植36 株(6 行×6 列),行株间距20 cm,3 次重复。收获时,每个花生品种随机选取15 株进行表型数据收集与广泛靶向脂质代谢组学检测。
1.2 试验方法
1.2.1 农艺性状调查 参照鲁清等[17]的方法,农艺性状检测指标包括主茎长、第一侧枝长、单株果数、单株饱果数、百果重、百仁重,并计算单株饱果率、单株秕果率与出仁率。
1.2.2 品质性状分析 花生收获后,清洗成熟的花生荚果,去除表面泥土,40 ℃烘干脱水后,使用近红外谷物分析仪DA7250(Perten,瑞典)对种子进行品质检测,其中脂质指标包括脂肪(Fat)、油酸(Oleic acid,CHO)、亚油酸(Linoleic acid,CLA)、油酸/ 亚油酸含量比值(CHO/CLA)、棕榈酸(Palmitic acid)、硬脂酸(Stearic acid)、花生酸(Arachidic acid)、山嵛酸(Docosanoic acid)、二十四烷酸(Lignoceric acid),蛋白指标包括蛋白质(Protein,Pr)、氨基酸(Amino acid,AA)、苏氨酸(Threonine,Thr)、缬氨酸(Valine,Val)、蛋氨酸(Methionine,Met)、异亮氨酸(Isoleucine,Ile)、亮氨酸(Leucine,Leu)、苯丙氨酸(Phenylalanine,Phe)、赖氨酸(Lysine,Lys)、组氨酸(Histidine,His)、精氨酸(Arginine,Arg)、脯氨酸(Proline,Pro)[4]。
1.2.3 广泛靶向脂质代谢组学分析 将烘干脱水后的花生种子(各品种3 个重复)用研磨仪研磨(30 Hz、1.5 min)至粉末状;准确称取50 mg 粉末,用1 mL 脂质提取液提取;涡旋2 min,超声5 min,加入500 μL 水;40 ℃,12 000 r/min 离心,吸取上清液500 μL 于1.5 mL 离心管中,真空冷冻干燥(VIRTIS,美国)浓缩,复溶后0.22 μm微孔滤膜过滤,保存于进样瓶中。后续的UPLCMS/MS 检测与分析委托迈维(武汉)生物技术有限公司进行。
1.3 数据处理与分析
花生农艺与品质性状数据采用Excel 软件进行统计,并利用GraphPad Prism 软件绘图。品种间采用成对T 检验,使用SPSS 21 版软件进行。广泛靶向脂质代谢组学原始数据的多元分析,如热图、火山图、排序图(Patterns hunter),主成分分析(Principal component analysis,PCA),偏最小二乘-判别分析PLS-DA(Partial least squaresdiscriminant analysis,PLS-DA)和得分图通过MetaboAnalyst 软件(http://www.metaboanalyst.ca)与图图云平台(https://www.cloudtutu.com/)进行[18]。
2 结果与分析
2.1 高、低油酸花生品种农艺性状比较
比较分析结果(图1)表明,高、低油酸花生品种的农艺性状差异显著,其中高油酸品种KN1715 的主茎、第一侧枝长度比低油酸品种JH7H 分别高11.72%和33.74%(图1A、B),差异显著;除单株秕果率外,KN1715 的单株果数、单株饱果率、百果重、百仁重与出仁率比JH7H 分别低46.23%、5.02%、5.35%、11.68% 和17.17%(图1C~H),差异显著。

图1 高、低油酸花生的农艺性状Fig.1 Agronomic traits of high and low oleic acid peanuts
2.2 高、低油酸花生品质性状比较
由表1 可知,脂质指标中,KN1715 的油酸/亚油酸含量比值为JH7H 的8.79 倍,油酸、硬脂酸、花生酸含量比JH7H 分别高102.71%、25.00%、15.33%,但亚油酸、棕榈酸、山嵛酸、二十四烷酸含量分别低76.83%、18.83%、17.67%、23.64%,差异均达显著水平;蛋白指标中,与JH7H 相比,KN1715 的蛋白质、氨基酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、苯丙氨酸、组氨酸、精氨酸与脯氨酸含量分别高16.35%、16.89%、16.47%、23.81%、17.54%、17.19%、18.63%、19.03%、19.81%、13.85%,差异显著(表2)。

表1 高、低油酸花生种子脂质相关指标含量Table 1 Contents of lipid-related indexes of high and low oleic peanut seeds(%)

表2 高、低油酸花生种子蛋白相关指标含量Table 2 Contents of protein-related indexes of high and low oleic peanut seeds(%)
2.3 高、低油酸花生脂质组学特征
基于KN1715 与JH7H 的广泛靶向脂质代谢组学数据进行可视化数据分析,从而显示出两品种的总样本特征(图2)。热图结果表明,在两个品种的种子中均鉴定出16 类295 种脂质代谢物,且两品种间脂质代谢物含量差异明显(图2A)。此外,各品种的3 个生物重复均能分别聚类,说明得到的数据重复性好、可靠性强。火山图根据差异倍数(Fold change,FC≥2,P≤0.05)进一步筛选差异代谢物,结果表明,KN1715 中含量比JH7H 高的脂质代谢物有90 种,比JH7H低的有114 种,无差异的有91 种(图2 B)。
初步可视化结果(图2)表明,高、低油酸花生品种中存在核心差异脂质代谢物。为了进一步分析KN1715 与JH7H 的脂质代谢物变化规律,以显著差异的测试数据为自变量进行PCA 分析和偏最小PLS-DA 分析,以进一步展现脂质代谢测试数据的一致性,同时确定两个品种分离的关键代谢物。同时,以PLS-DA 变量投影重要度(Variable importance in projection,VIP)衡量各测定指标对各组样本分类判别的影响强度和解释能力,从而辅助关键指标的筛选(通常以VIP 值>1.0 作为筛选标准)。PCA 分析结果(图3 A)表明,所有测定指标降维为2 个主成分,分别为PC1 和PC2 方差百分比为99.4%和0.6%,其中PC1 可以很好地表征所有测定指标99.4%的信息;PLS-DA 分析(图3 B)则降维出2 个变量,即变量1(99.4%)和变量2(0.6%),其中变量1 也可以很好地表征所有测定指标99.40%的信息。从图3 C、D 可以看出,PCA 与PLS-DA分析结果均可以将KN1715、JH7H 的脂质代谢物完全分离为两组,根据PLS-DA 分析的变量1生成VIP 得分图进一步分析,以量化测定参数对两个品种分离的贡献。从图3 E 可以看出,两个品种中存在3 类(即甘油二酯DG 3.10%、甘油三酯TG 93.80%、磷脂酰胆碱PC 3.10%)31 种脂质代谢物的VIP 值>1.0,说明这31 种脂质代谢物是形成两品种分离的核心差异脂质代谢物。
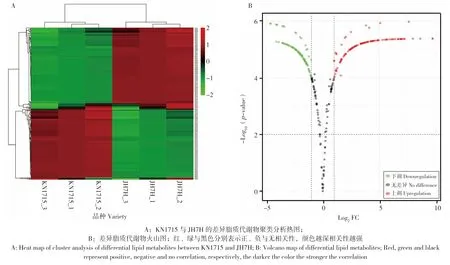
图2 高、低油酸花生的脂质组学总样本特征Fig.2 Total sample characteristics of lipidomics of high and low oleic acid peanuts

图3 脂质代谢物的PCA 与PLS-DA 分析及PLS-DA 分析变量1 的VIP 得分Fig.3 PCA and PLS-DA analysis of lipid metabolites and variable importance in projection(VIP)to the component 1 of PLS-DA
2.4 脂质组核心差异代谢物与品质指标的特征谱及其相关性
通过31 种脂质组核心差异代谢物与标准化测定的品质指标进行聚类分析,可以得到鉴定花生品种的可视化脂质组特征图谱(图4)。图4结果显示,脂质代谢物与品质指标在KN1715 与JH7H 两个高、低油酸品种间具有明显的差异,在KN1715 中,有19 种脂质分子含量显著上调,其余12 种则相反,这也可作为区分高油酸花生与普通花生的特异性脂质生物标志物。
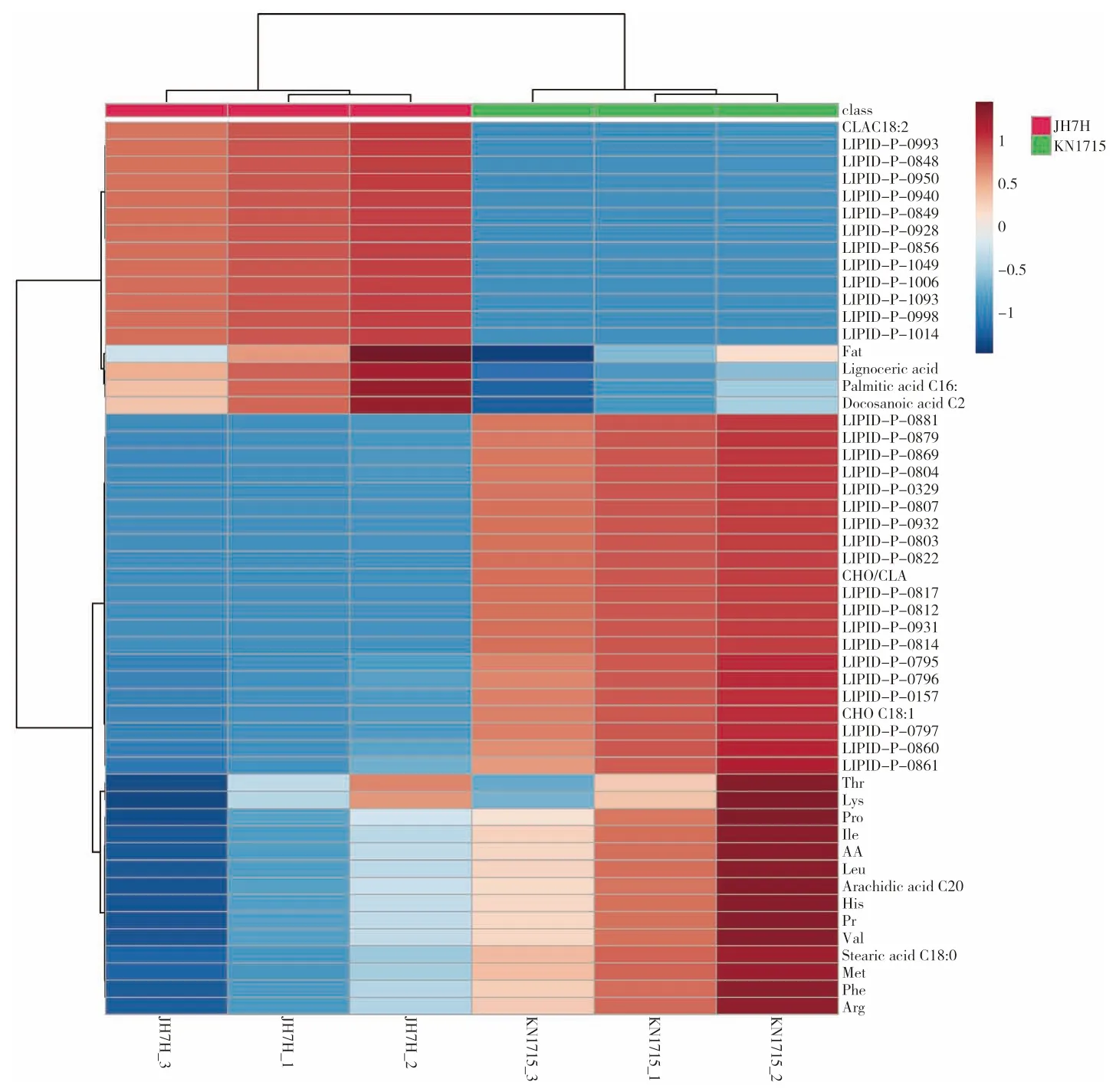
图4 脂质组核心差异代谢物与品质指标的特征谱Fig.4 Characteristics mapping for core differential lipidomics metabolites and the quality indexes
对脂质组核心差异代谢物与品质指标的相关性进行分析,既可进一步探索代谢物与表型的关系,也佐证脂质组核心差异代谢物。图5A 结果表明,高油酸花生品种代谢物与品质指标的相关性热图,红、蓝与白分别表示正、负、无相关性,其颜色越深相关性越强。由于KN1715 与JH7H 分别为高、低油酸品种,故重点关注与油酸相关的指标。由图5 可知,油酸与部分指标(LIPID-P-0860、LIPID-P-0861、LIPID-P-0795、LIPID-P-0796、LIPID-P-0157、LIPID-P-0797、LIPID-P-0881、LIPID-P-0879、LIPID-P-0869、LIPID-P-0804、LIPID-P-0822、CHO/CLA、LIPID-P-0817、LIPID-P-0931、LIPID-P-0814、LIPID-P-0812、LIPID-P-0329、LIPID-P-0807、LIPID-P-0932、LIPID-P-0803、硬脂酸C18:0、花生酸、Met、Phe、Arg、Pro、Ile、AA、Leu、His、Pr、Val)之间存在显著正相关,与Fat、Thr、Lys 及两各品种均无显著相关性外,与其他指标之间则存在显著负相关。进而对所有与油酸密切相关的指标进行分类排序,根据相关系数>0.5 进行选择,与油酸相关性由强到弱排序的结果见图5 B。
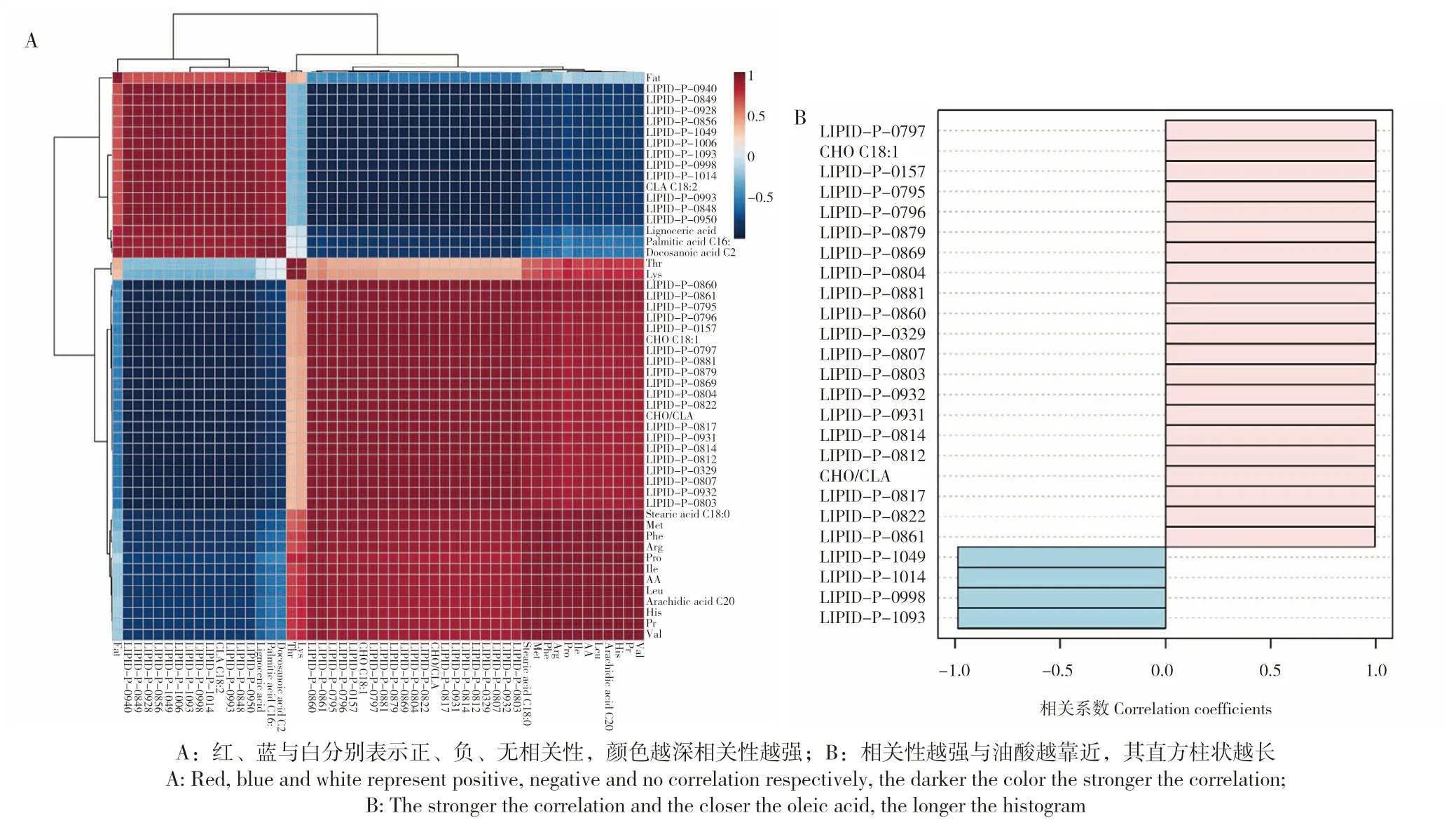
图5 脂质组核心差异代谢物与品质指标的相关性热图(A)及与油酸相关的指标排序图(B)Fig.5 Heat map(A)for core differential lipidomics metabolites and the quality indicators,and the top indexes correlated with oleic acid(B)
3 讨论
本研究首次利用近红外光谱技术与广泛靶向脂质组学,基于高、低油酸花生的品质指标与种类繁多的脂质分子的原始数据,通过多元统计分析,最终获得品种鉴定与品质评价兼备的表型与脂质分子特征图谱,以及筛选高油酸花生特异性脂质生物标志物。目前,近红外光谱技术作为一种无损、快速、低成本的检测技术,已被广泛应用于植物品种鉴定与选育[19]、作物品质评价[20]和食用植物油脂与油料品质检测[21]。本研究结果显示,油酸与亚油酸含量成反比,这与禹山林等[22]最先利用近红外技术测定花生的油脂与蛋白质含量的结果类似。本研究中,基于近红外光谱检测到的物质均是脂肪酸水平的脂质代谢物。而花生油作为广东省主要的食用油之一,其不断增加的市场需求,导致不良商家使用不健康或较便宜的油进行掺假,而掺假物与纯花生油脂的光谱非常相似,因此,研制能识别和量化相应掺假物的通用、可靠的分析方法是今后研究的重要方向[23]。
脂质组学主要的研究对象是较高丰度的内源性脂质代谢物,而且其普遍采用的研究手段是UPLC-MS/MS 技术,使得该技术天然具备高稳定与高精度属性。因此,广泛靶向脂质组学成功应用于不同领域,如长链脂肪酸的生物合成与棉纤维发育[24]、植物细胞表面脂质盐受体[25]。本研究使用UPLC-MS/MS 广泛靶向脂质组学对2 个油酸差异显著的花生品种进行分析,经过多元统计分析最终得到3 类31 种核心差异脂质分子,即甘油三酯(93.80%)、甘油二酯(3.10%)和磷脂酰胆碱(3.10%)。甘油三酯作为植物油脂的主要成分,在植物脂质代谢途径中起到关键作用[26],而甘油三酯的功能决定于其骨架结构上的脂肪酸种类[7],这也是本研究中31 种核心差异脂质代谢物的来源。此外,近年来多组学关联分析已被广泛应用于作物遗传育种与生理生化等机理研究[27-28],本研究利用多元统计分析方法对花生表型组与脂质组数据进行集成分析,并初步获得与油酸含量相关的表型与脂质组指标,这些结果将为揭示花生脂质合成与代谢机制提供研究思路与理论依据。
4 结论
本研究分析了成熟期高、低油酸花生KN1715 与JH7H 的表型性状(农艺与品质性状)与脂质组的差异。就表型性状而言,KN1715 的主茎、第一侧枝长度、油酸、硬脂酸、花生酸、蛋白质、氨基酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、苯丙氨酸、组氨酸、精氨酸与脯氨酸含量显著高于JH7H;就脂质组而言,两品种间存在较大的差异,共筛选到16 类295 种脂质分子,进一步通过对差异代谢物多元统计分析,最终筛选到3 类31 种核心差异脂质分子,其在花生品种鉴定起到关键作用。另外,本研究集成近红外与广泛靶向脂质组学数据,获得KN1715 与JH7H的可视化脂质组特征图谱,建立从品质表型与脂质分子层面进行花生品种鉴定与品质评价的新型分析方法。
