异甘草酸镁对酒精性肝病大鼠肝组织Nrf2/HO-1信号通路和肝纤维化指标的影响*
2022-01-24张晓伟徐圣秋郭洪梅
张 曼,张晓伟,徐圣秋,郭洪梅
(徐州市第一人民医院药学部,徐州 221000)
酒精性肝病(ALD)是长期大量饮酒引发的慢性肝病,随着我国生活水平的提高,ALD 的发病率也逐年升高[1]。ALD 是一种进行性疾病,病变过程为脂肪变性、脂肪型肝炎、纤维化,最后不可逆进展为肝硬化,严重威胁国民的健康与安全[2]。异甘草酸镁(MgIG)是一种肝细胞胞保护剂,具有抗炎、抗纤维化、改善肝功能等作用,临床应用MgIG 治疗ALD疗效显著,且不良反应较少[3-4]。但MgIG在ALD中的具体作用机制尚不清楚。现阶段,ALD的具体发病机制尚未完全阐明,但普遍认为氧化应激在ALD 发生发展中占据重要地位[5]。核因子2 相关因子/血红素氧合酶(Nrf2/HO-1)信号通路是维持氧化还原平衡的重要途径,其在ALD发生发展中有关键作用[6]。本研究将从Nrf2/HO-1 通路的角度,分析MgIG 在ALD 大鼠中的保护作用,旨在为MgIG 治疗ALD提供理论依据。
1 材料与方法
1.1 实验动物
SD 大鼠,雄性,SPF 级别,6~8 周,体质量180~220 g,购于北京维通利华实验动物技术有限公司,实验动物使用许可证号SCXK(京)2020-0035。大鼠饲养于SPF级动物房中,室内温度为20~24 ℃,相对湿度为50%~60%,适应性喂养3 d 后进行后续实验。
1.2 药品与主要试剂
MgIG 注射液(正大天晴药业集团股份有限公司,国药准字H20051942,规格:10 mL:50 mg×2支),丙氨酸转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBil)、甘油三酯(TG)、超氧化物歧化酶(SOD)、丙二醛(MDA)及谷胱甘肽(GSH)生化试剂盒(南京建成生物科技有限公司),层黏蛋白(LN)、透明质酸(HA)和Ⅲ型前胶原肽(PC-Ⅲ)ELISA 试剂盒(美国Biosource),Nrf2、HO-1引物序列由北京阅微基因技术有限公司提供,Nrf2、HO-1 蛋白一抗(美国Abcam)。
1.3 分组、建模及干预
将50 只SD 大鼠随机分为对照组、模型组及MgIG低、中、高剂量组,每组10 只。除对照组外,其他组大鼠给予Liber-DeCarli 酒精液体饲料喂养,喂养6 周后观察肝脂肪变性程度及肝细胞形态变化情况,检验ALD大鼠模型制备情况[6],对照组以普通饲料喂养。模型大鼠制备成功后,MgIG 低、中、高剂量组分别腹腔注射15 mg/kg、30 mg/kg、45 mg/kg MgIG,1 次/d,连续注射8 周,对照组和模型组注射等体积生理盐水。
1.4 动物处理
给药结束后,眼眶取血分离血清,置于-20 ℃冰箱冻存,快速取出肝组织,部分固定于多聚甲醛进行病理观察,剩余组织置于液氮罐保存。
1.5 指标测定
1.5.1 肝功能、氧化应激指标及肝组织TG 含量的检测 采用生化试剂盒检测血清ALT、AST、TBil、SOD、MDA、GSH 和肝组织TG 含量,检测过程严格按照试剂盒说明书进行操作,于酶标仪下检测各孔吸光度值,绘制标准曲线,计算浓度。
1.5.2 病理切片观察 取新鲜肝组织固定于中性多聚甲醛溶液中过夜,制备肝组织石蜡切片(厚度为4 μm),行常规苏木精-伊红(HE)、Masson染色,显微镜下观察大鼠肝组织病理变化和纤维化程度。
1.5.3 纤维化指标检测 采用酶联免疫吸附法检测肝组织LN、HA和PC-Ⅲ水平,检测过程严格按照试剂盒说明书进行操作,于酶标仪下检测各孔吸光度值,绘制标准曲线,计算浓度。
1.5.4 实时荧光定量PCR(RT-qPCR)法检测肝组织中Nrf2、HO-1 mRNA 水平 取肝组织样品添加Trizol 试剂提取总RNA,逆转录合成cDNA,再混合SYBR Green MasterMix进行荧光定量PCR扩增,程序设置为95 ℃5 min,95 ℃30 s,60 ℃15 s,72 ℃35 s,总40个循环。Nrf2上游引物为5’-CTCGCTGGAAAAAGAAGTG-3’,下游为5’-CCGTCCAGGAGTTCAGAGG-3’;HO-1 上游引物为5’-CGTCACTTCGTCAGAGGCCTGC-3’,下游为5’-TCTGGGGTTTCCCTCGGGGTG-3’。采用2-△△CT公式,以GAPDH为内参,计算Nrf2、HO-1 mRNA 的相对表达水平。
1.5.5 蛋白印迹法(Western blotting)检测肝组织中Nrf2、HO-1蛋白的表达 取肝组织样品添加裂解液提取蛋白,测定蛋白浓度后进行SDS-PAGE电泳,再电转至PVDF膜,加入5%脱脂牛奶室温下孵育1 h,封闭PVDF膜上的非特异性位点,再分别加入Nrf2、HO-1、β-actin 蛋白一抗(1∶1 000)4 ℃冰箱孵育过夜,次日加入辣根过氧化物酶标记羊抗兔/鼠蛋白二抗(1∶5 000)室温下孵育1 h,抗体结合免疫结束后添加化学发光试剂,进行显影成像,以β-actin 为内参,目的条带与β-actin 条带灰度值比值反映Nrf2、HO-1的相对表达量。
1.6 统计学方法
采用SPSS 18.0 软件处理数据,计量资料以均数±标准差()表示,多组均数比较采用单因素方差分析,进一步组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肝功能和TG含量的比较
模型组血清ALT、AST、TBil 及肝组织TG 含量均明显高于对照组(均P<0.05);与模型组比较,MgIG 中、高剂量组ALT、AST、TBil 及TG 水平明显降低(均P<0.05),且MgIG 中、高剂量组ALT、AST、TBil 水平低于MgIG 低剂量组,MgIG 高剂量组TG水平低于MgIG低剂量组(均P<0.05),见表1。
表1 各组大鼠肝功能和TG含量的比较 ,n=10
与对照组比较,*P<0.05;与模型组比较,#P<0.05;与MgIG低剂量组比较,△P<0.05。
2.2 各组大鼠肝组织病理学观察的结果
HE 染色显示,相较于对照组,模型组肝组织细胞脂肪变性严重,汇管区伴有大量的炎性细胞浸润,小叶内出现不同程度的坏死;MgIG 处理后,肝组织病理损伤减轻,其中MgIG 高剂量组效果最佳。Masson 染色显示,相较于对照组,模型组终末静脉增厚,胶原纤维向窦周隙延伸,汇管区及周围纤维化明显;MgIG处理后纤维化程度明显减轻,以MgIG高剂量组改善明显。见图1。
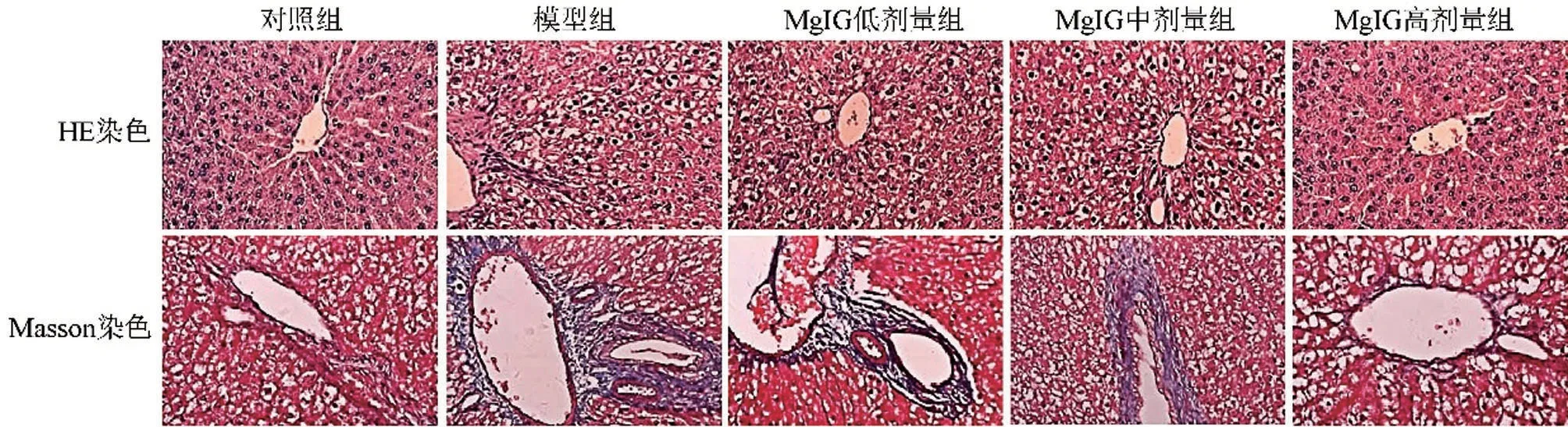
图1 各组大鼠肝组织病理学观察图
2.3 各组大鼠肝组织纤维化指标的比较
模型组肝组织LN、HA 和PC-Ⅲ含量明显高于对照组(P<0.05);与模型组比较,MgIG 中、高剂量组LN、HA 和PC-Ⅲ含量明显降低(均P<0.05),且MgIG 高剂量组LN、HA 水平低于MgIG 中、低剂量组,MgIG 中剂量组LN、HA 水平低于MgIG 低剂量组,MgIG中、高剂量组PC-Ⅲ水平低于MgIG低剂量组(均P<0.05),见表2。
表2 各组大鼠肝组织纤维化指标的比较 ,n=10
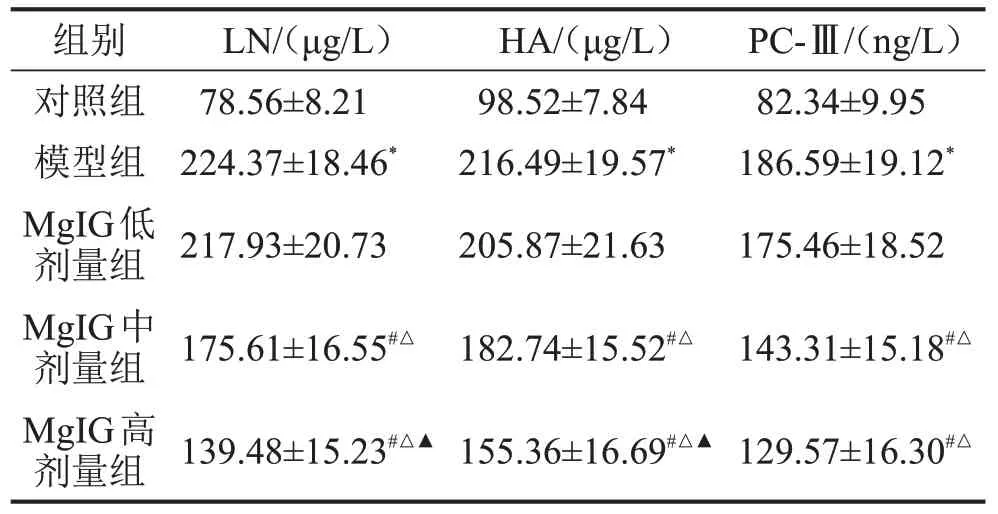
表2 各组大鼠肝组织纤维化指标的比较 ,n=10
与对照组比较,*P<0.05;与模型组比较,#P<0.05;与MgIG 低剂量组比较,△P<0.05;与MgIG 中剂量组比较,▲P<0.05。
2.4 各组大鼠血清氧化应激指标的比较
模型组血清SOD、GSH 水平明显低于对照组,MDA 水平明显高于对照组(P<0.05);与模型组比较,MgIG 中、高剂量组SOD、GSH 水平明显升高,MDA水平明显降低(P<0.05),并呈剂量依赖性,见表3。
表3 各组大鼠血清氧化应激指标的比较 ,n=10

表3 各组大鼠血清氧化应激指标的比较 ,n=10
与对照组比较,*P<0.05;与模型组比较,#P<0.05;与MgIG 低剂量组比较,△P<0.05;与MgIG 中剂量组比较,▲P<0.05。
2.5 各组大鼠肝组织Nrf2、HO-1表达的比较
模型组肝组织Nrf2、HO-1 mRNA 及蛋白表达高于对照组(P<0.05);与模型组比较,MgIG 中、高剂量组Nrf2、HO-1 mRNA 及蛋白表达明显升高(P<0.05),且MgIG高剂量组Nrf2 mRNA水平高于MgIG剂量组,MgIG中、高剂量组HO-1 mRNA水平高于MgIG 剂量组(P<0.05),并呈剂量依赖性,见表4、图2。
表4 各组大鼠肝组织Nrf2、HO-1表达的比较 ,n=10
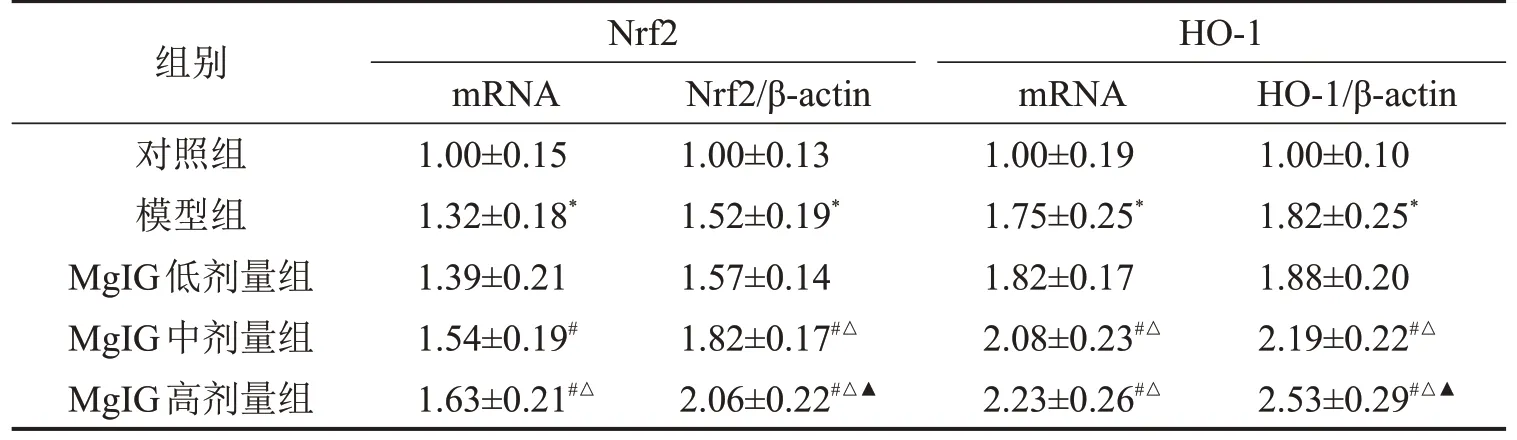
表4 各组大鼠肝组织Nrf2、HO-1表达的比较 ,n=10
与对照组比较,*P<0.05;与模型组比较,#P<0.05;与MgIG 低剂量组比较,△P<0.05;与MgIG中剂量组比较,▲P<0.05。

图2 大鼠肝组织中Nrf2、HO-1蛋白的表达
3 讨论
本研究通过喂食酒精液体饲料构建ALD模型,结果显示,与对照组比较,模型组大鼠ALT、AST、TBil 及肝组织TG 含量明显升高,且肝组织病理切片也呈现出典型的肝病特征,表明ALD大鼠模型构建成功。ALT、AST、TBil 是肝脏内重要的功能酶系,是肝功能评价的敏感指标[7]。正常情况下,ALT、AST、TBil 在血清中含量较低,当肝细胞受损时,肝细胞膜通透性增加,ALT、AST、TBil 将由细胞质释放进入血液循环,导致血清水平升高[8]。通过观察大鼠肝功能变化情况:MgIG 处理后,大鼠ALT、AST、TBil水平较模型组降低(P<0.05),表明MgIG可改善ALD大鼠肝功能,这与MgIG的临床应用效果相符[9]。长期酒精代谢造成肝细胞损伤,会引起肝脏血脂代谢异常,表现出脂肪样变性,导致TG水平升高[10]。本实验中MgIG 各剂量结果表明,MgIG可通过降低肝组织中TG 含量,且肝组织病理学观察结果显示,MgIG组和模型组相比,肝细胞形态及结构均得到明显改善,进一步说明MgIG 具有保肝作用。
人体摄入的酒精大部分均在肝脏中代谢,这个过程中会产生大量的活性氧,引发脂质过氧化链反应,生成具有细胞毒性的终产物MDA,导致氧化应激[11]。正常生理状态下,Nrf2处于非活化状态,并作为目标被蛋白体酶降解,当体内出现氧化应激时,Nrf2将被激活进入细胞核中,与抗氧化反应原件结合,激活下游靶基因HO-1、SOD 等代谢酶,发挥抗氧化作用[12]。GSH 也是体内重要的抗氧化剂,可清除氧自由基[13]。Yang等[14]研究显示,MgIG可通过抑制烟酰胺腺嘌呤二核苷酸磷酸氧化酶(NOX1)、NOX2和NOX4的表达,减少活性氧的产生,从而预防果糖诱导的肝脏氧化应激损伤。本实验中,模型组抗氧化酶SOD 和GSH 活力下降,脂质过氧化终产物MDA水平升高(P<0.05),表明ALD大鼠肝损伤与氧化/抗氧化水平失衡有关。干预MgIG 后,SOD 和GSH 水平上升,体内抗氧化能力明显增强,MDA 水平减少,有效阻滞过度的脂质过氧化。同时,RT-qPCR和Western blotting结果显示,与模型组比较,MgIG 组肝组织Nrf2、HO-1 mRNA 及蛋白表达明显升高(P<0.05),提示MgIG 可能通过调控Nrf2/HO-1 信号通路,从而减轻ALD 大鼠的氧化应激。
ALD的治疗中延缓肝纤维化的进程、最大程度预防肝硬化,有重要的临床意义。肝星状细胞转化为肌成纤维细胞,导致细胞外基质的沉积,是肝纤维化发生的主要机制[15]。肝脏中细胞外基质的成分以Ⅰ型和Ⅲ型胶原为主,LN 是肝细胞外基质中特有的非胶原性结构蛋白,HA主要有星状细胞合成,可与胶原结构蛋白、蛋白多糖等构成结缔组织,PC-Ⅲ是肝内胶原蛋白增加的主要成分[16]。Sui 等[17]通过四氯化碳诱导肝纤维化大鼠模型,发现MgIG 可抑制肝星状细胞的活化,从而发挥抗纤维化作用。纤维化参数检测发现,MgIG 组大鼠肝组织LN、HA和PC-Ⅲ含量明显低于模型组(P<0.05),表明MgIG 在ALD 中可能通过改善肝组织纤维化,以保护肝损伤。
综上所述,MgIG 能够改善ALD 大鼠肝组织的病理学改变,改善肝功能,降低TG 含量,可能通过Nrf2/HO-1 途径减轻氧化应激及改善肝纤维化,从而缓解酒精性肝损伤。
