桂千金子提取物对金黄色葡萄球菌体外抗菌作用及机制的初步研究*
2022-01-24王鹤龄谭珍媛冯钟文庞丽君黄瑀莘陈思韵韦锦斌
王鹤龄,谭珍媛,冯钟文,庞丽君,黄瑀莘,陈思韵,韦锦斌△
(1.广西医科大学第一附属医院药学部,南宁 530021;2.广西医科大学药学院,南宁 530021)
桂千金子(Polygonum runcinatumBuch.Ham.)为草本植物药蓼科植物赤胫散的根茎。瑶医以其入药,有清热解毒,活血止痛,解毒消肿之功效,用于治疗急性胃肠炎,月经不调,乳腺炎,痈疖肿毒等[1-3]。疖、痈为急性化脓性感染,病原菌几乎为金黄色葡萄球菌[4],金黄色葡萄球菌感染往往会局部扩散,引起脓肿和痈肿,若不及时治疗,可能导致严重并发症[5],而多重耐药菌的出现又会降低用于治疗皮肤感染的抗生素的有效性[6]。
前期研究发现,在10 种常见致病菌中,桂千金子对金黄色葡萄球菌有较好的抑菌作用。本实验根据桂千金子的民间用法及文献参考[7-11],以水提取物、乙醇提取物及其乙酸乙酯、正丁醇萃取物作为供试药物对金黄色葡萄球菌标准菌株(SA)及临床分离的金黄色葡萄球菌菌株(MSSA)和耐甲氧西林金黄色葡萄球菌(MRSA)进行体外抗菌实验[12-13],初步探究临床分离MRSA菌株抗菌作用机制,进一步明确桂千金子的有效抗菌活性。
1 材料与方法
1.1 药材
瑶药桂千金子于2019 年3 月收采于广西壮族自治区北流市六麻镇,经广西医科大学药学院中药学教研室李琼老师鉴定,确定为蓼科植物赤胫散(Polygonum runcinatum)的干燥根茎。药材自然晾干后粉碎为粗粉,备用。
1.2 待测菌株
SA(CMCC26003)由广西医科大学基础医学院微生物教研室提供。MSSA4431 和MRSA4290 由广西医科大学第一附属医院检验科分离鉴定(全自动微生物鉴定分析系统VIREK 2Compact 60)并提供。
1.3 药品和主要试剂
青霉素药敏纸片(含量:10 μg,批号:20190823)、万古霉素药敏纸片(含量:30 μg,批号:20190823)购自常德比克曼生物科技有限公司;营养琼脂培养基(批号:20190920)购自常德比克曼生物科技有限公司、MH(B)培养基(批号:705G031)购自北京索莱宝科技有限公司。
1.4 菌悬液的制备
按无菌操作法[14-15],将待测菌接种在营养琼脂培养基上,于35 ℃条件下培养,转种活化;取活化后少量待测菌株培养至对数期,挑取适量以0.9%氯化钠注射液调整菌悬液浓度至0.5 麦氏浊度单位,此时浓度约为1.5×108CFU/mL,备用;另取适量稀释至1.5×106CFU/mL,备用。
1.5 桂千金子提取物的制备
1.5.1 水提物的制备 取桂千金子粗粉20 g,加入10 倍量纯水充分浸泡2 h 后,煎煮2 次,每次1 h,合并2 次滤液,水浴蒸干,得水提物7.44 g。取适量水提物以0.9%氯化钠注射液溶解,制成质量浓度为100 mg/mL 的药液,备用。试验前所有药液均用0.22 μm滤膜过滤除菌。
1.5.2 有机提取物的制备 取桂千金子粗粉20 g,以10 倍量乙醇浸泡过夜,回流提取至无色,抽滤后合并滤液,旋蒸减压,蒸干得乙醇提取物3.78 g,备用;取适量乙醇提取物用纯水溶解后,用乙酸乙酯萃取,旋蒸减压,干燥后得到萃取物0.09 g,剩余水溶液用正丁醇萃取得到萃取物0.19 g,分别用含10%DMSO的0.9%氯化钠注射液溶解,制成质量浓度为100 mg/mL 的药液,备用。试验前所有药液均用0.22 μm滤膜过滤除菌。
1.6 体外抗菌作用考察
1.6.1 管碟法测定抑菌圈 按无菌操作法,用无菌棉签蘸取待测菌悬液至营养琼脂培养基表面,涂布均匀,将牛津杯等距分散放置,静置10 min 使其固定,精确移取各提取物药液100 μL 至牛津杯中,室温下放置0.5 h 使药液扩散。每个培养基均设置阳性对照组(青霉素药敏纸片、万古霉素药敏纸片)和空白对照组(含10%DMSO 的0.9%氯化钠注射液)。各培养基置于35 ℃生化培养箱培养24 h 后,取出观察并测量抑菌圈直径。抑菌指标判定:抑菌圈直径(IZD)≥15 mm为高度敏感,10≤IZD<15 mm为中度敏感,5≤IZD<10 mm 为轻度敏感,IZD<5 mm为不敏感。IZD越大,表明待测提取物抗菌作用越强[16]。
1.6.2 二倍稀释法测定最低抑菌浓度(MIC)和最低杀菌浓度(MBC)按无菌操作法,取一次性96 孔板,精确吸取各提取液分别加入200 mL 第1 孔,混匀后吸取100 mL至第2孔,如此连续倍比稀释至第9孔,作为实验组;第10孔作为药液对照组加入菌液和药液;第11 孔作为阳性对照组加入培养基和菌液;第12 孔作为阴性对照组加入培养基;含10%DMSO 的0.9%氯化钠注射液作为空白对照组。将各组置于35 ℃生化培养箱中,培养24 h 后,取出观察菌株生长情况。在黑色背景光源下观察,显示清亮则判定无菌生长,显示浑浊则判定有菌生长,以无菌生长孔所对应的质量浓度为该组的MIC。
分别从上述各组无菌生长孔中吸取培养液100 μL,接种至营养琼脂培养皿中,均匀涂布,培养24 h 后计算平板上的菌落,以活菌计数法表示平均菌落数<5个对应的最小稀释度的提取物质量浓度为MBC[16]。
1.7 抗菌作用机制考察
1.7.1 碱性磷酸酶(AKP)活性的测定 加入MRSA4290 菌悬液使桂千金子乙醇提取液最终浓度达到4 MIC、1 MIC 和0.5 MIC,以不加桂千金子乙醇提取液的作为空白对照组。将以上培养基置于35 ℃的摇床中培养,每2 h取样,5 000 r/min离心10 min,取上清,酶标仪测定AKP 活性。OD 值越大,表示AKP活性越大,则细胞壁通透性增大。
1.7.2 DNA/RNA 大分子含量测定 方法同“1.7.1项”,以空白对照组作为调零组,用紫外分光光度计在260 nm 处测定吸光度。OD 值越大,表示外流DNA/RNA大分子含量越高,则细胞膜通透性增大。
1.7.3 胞内蛋白质含量测定 方法同“1.7.1项”,将以上培养基置于35 ℃的摇床中培养,每2 h取样,以肉汤培养基调节待测组样品的OD600值一致。取4 mL 菌悬液,离心,以灭菌生理盐水洗涤菌体沉淀3 次后,加入300 μL PBS 缓冲液,100 W 超声1 h,离心,取上清液,酶标仪测定蛋白含量。OD 值越大,表示胞内蛋白质含量越高,则胞内蛋白合成未受抑制。
1.7.4 杀菌曲线的测定 以MRSA4290 菌悬液调节桂千金子乙醇提取液的浓度达到4 MIC、1 MIC和0.5 MIC,以不加乙醇提取液的作为阳性对照组。各培养基置于35 ℃的摇床中培养,在0 h、2 h、4 h、6 h、8 h、10 h、12 h、16 h、20 h、24 h、30 h取样,使用酶标仪测定菌液OD600值,绘制杀菌曲线。OD 值越大,表示菌悬液浓度越高,则MRSA 正常生长未受限制。
1.7.5 细胞形态学观察 以MRSA4290 菌悬液调节桂千金子乙醇提取液的浓度达到4 MIC、1 MIC和0.5 MIC,以不加乙醇提取液的作为空白对照组。各培养基置于35 ℃的摇床中培养,在2 h和6 h取样,5 000 r/min 离心5 min,弃上清液。沉淀经固定、洗脱、喷镀后,在FEI Quattro钨丝灯扫描电镜下扫描观察MRSA4290细胞形态。
1.8 统计学方法
采用SPSS 21.0 统计分析软件对实验数据进行分析处理,计量资料以均数±标准差()表示。组间比较采用方差分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 桂千金子提取物的抑菌活性大小
桂千金子水提物无抑菌圈;乙醇提取物及其乙酸乙酯、正丁醇萃取物的抑菌圈均≥15 mm,为高度敏感,见表1、图1。
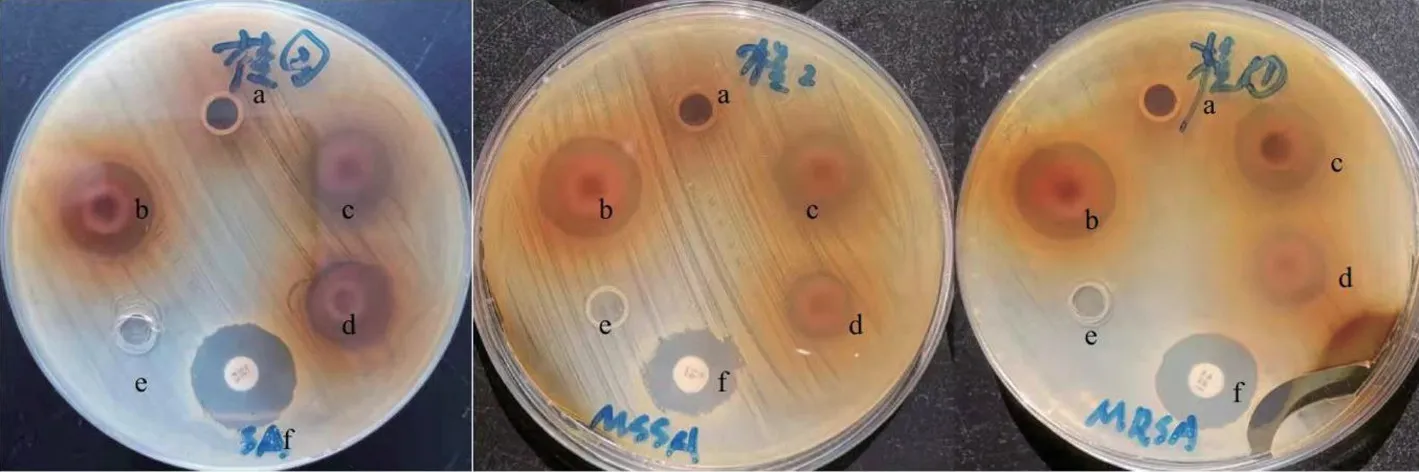
图1 桂千金子提取物抑菌圈直径的测定结果
表1 桂千金子提取物抑菌圈直径的测定结果 mm,,n=3
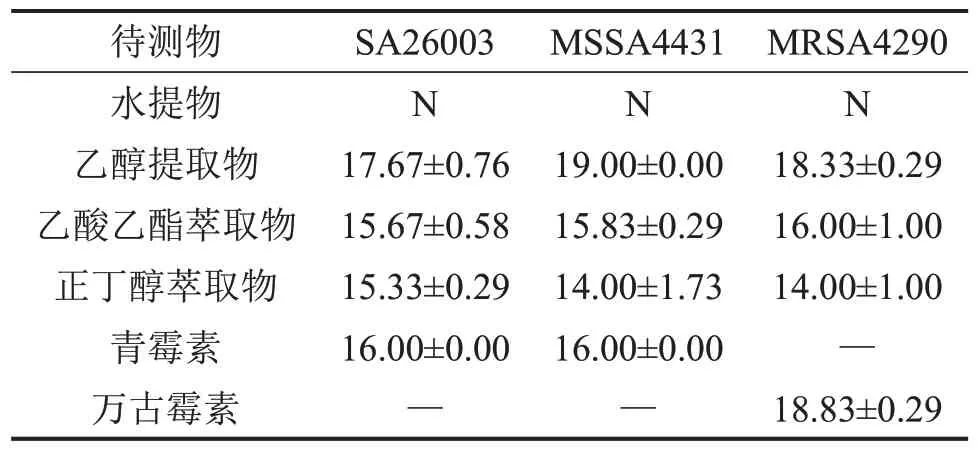
表1 桂千金子提取物抑菌圈直径的测定结果 mm,,n=3
“—”为未进行试验;“N”为无抑菌圈。
2.2 桂千金子提取物对SA26003、MSSA4431、MRSA4290的MIC和MBC
桂千金子乙醇提取物及其乙酸乙酯萃取物对SA26003、MSSA4431、MRSA4290 的MIC 和MBC分别为1.56 mg/mL和3.13 mg/mL,其正丁醇萃取物的MIC 和MBC 分别为6.25~12.50 mg/mL 和12.50~25.00 mg/mL。MIC 测定结果见表2~表4,MBC 测定结果见表5。

表2 桂千金子提取物对SA26003的MIC测定结果 n=3
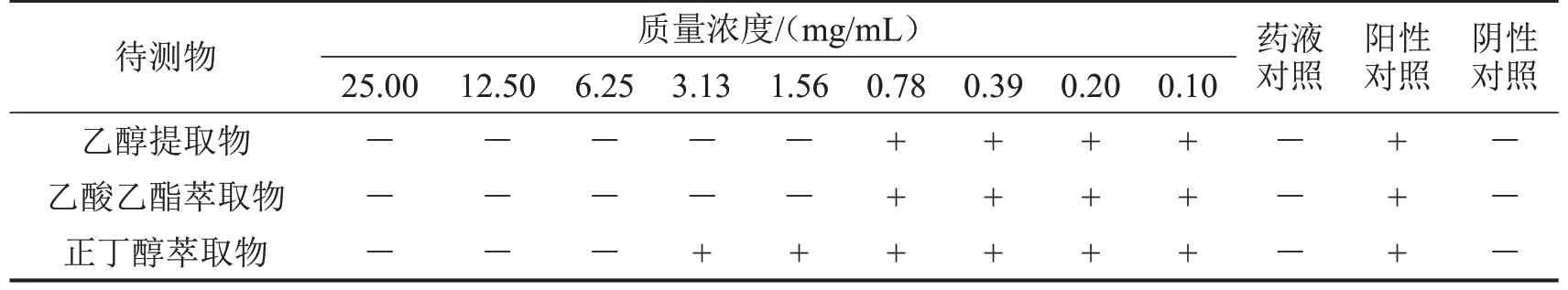
表3 桂千金子提取物对MSSA4431的MIC测定结果 n=3

表4 桂千金子提取物对MRSA4290的MIC测定结果 n=3
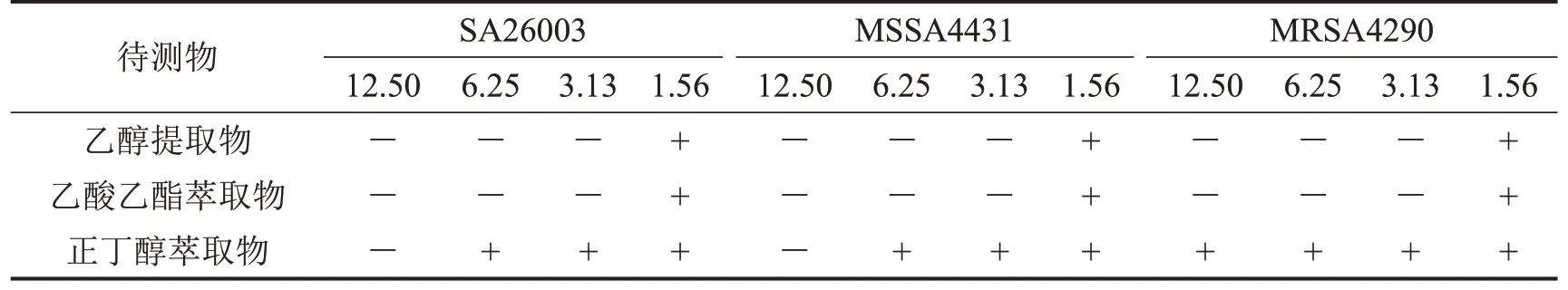
表5 桂千金子提取物的MBC测定结果 n=3
2.3 桂千金子乙醇提取物对MRSA4290 的抗菌作用机制
与空白对照组和0.5 MIC实验组比较,4 MIC和1 MIC 实验组的AKP 活性随时间延长而增加,MIC实验组胞外的AKP 活性低于4 MIC 实验组(P<0.05);培养基中未检测出DNA/RNA 大分子物质,各实验组OD值与空白对照组比较无明显差异(P>0.05);实验中未检测到胞内蛋白含量减少,各实验组OD 值与空白对照组比较无明显差异(P>0.05)。由阳性对照组绘制的生长曲线可知,MRSA菌在4 h内处于生长适应期,4~14 h 处于生长对数期,14~30 h处于稳定期,与阳性对照组比较,各实验组OD值增加缓慢,4 MIC实验组没有明显的对数生长期,其抑制作用较1 MIC和0.5 MIC实验组更明显(P<0.05),见图2。

图2 桂千金子乙醇提取物对MRSA4290的作用机制
2.4 细胞形态学观察结果
空白对照组MRSA 菌体在2 h 和6 h 均保有完好的外部形态,光滑呈葡萄串状;0.5 MIC 和1 MIC实验组在6 h 菌体形态发生改变;4 MIC 实验组在2 h菌体形态改变,表面粗糙有少量白点,在6 h菌体粗糙情况更明显,表面出现大量颗粒物附着,细胞体积增大,见图3。
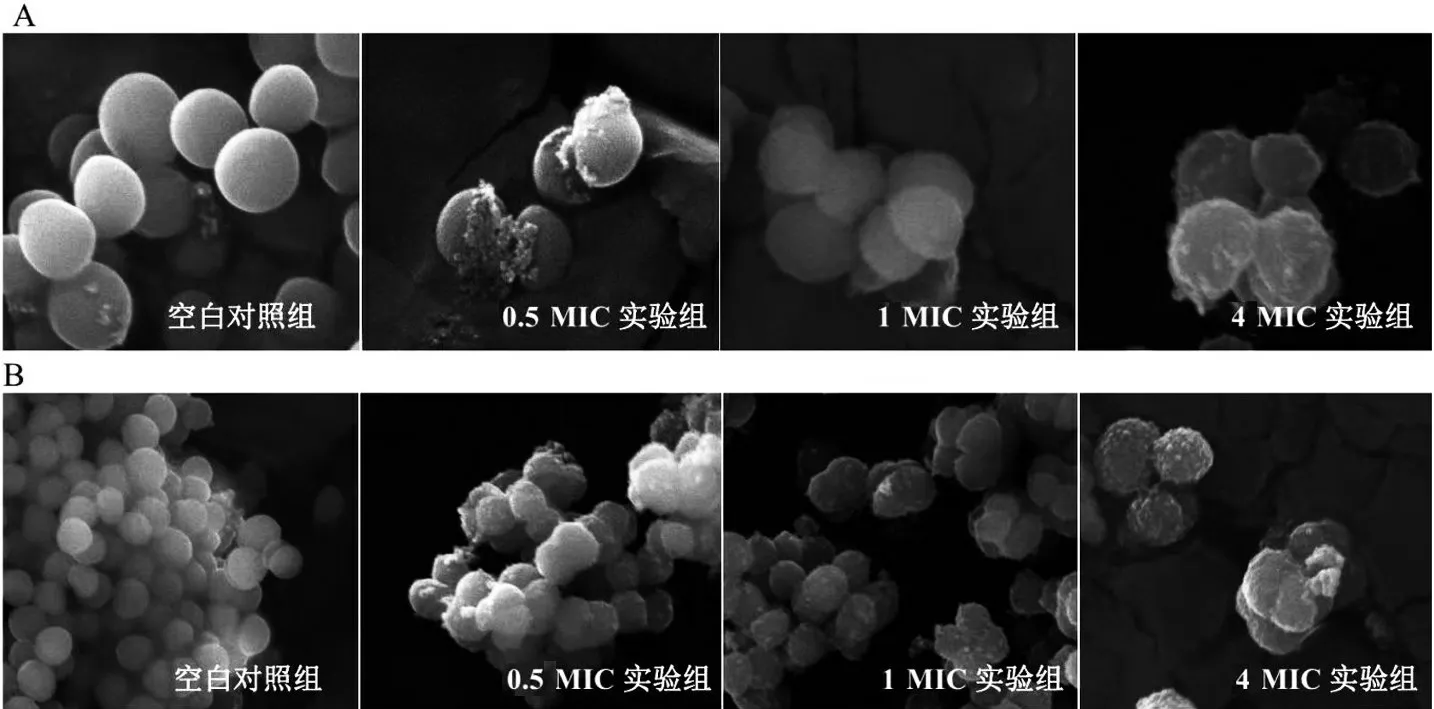
图3 桂千金子乙醇提取物对MRSA4290细胞形态的影响
3 讨论
本实验以桂千金子提取物进行体外抗菌实验,除水提物外,各提取物均具有不同程度的抗菌活性,抗菌强度排序为乙醇提取物≈乙酸乙酯萃取物>正丁醇萃取物。在前期药材提取过程中发现,相较于乙酸乙酯萃取物和正丁醇萃取物,乙醇提取物得率较高,出于经济性和时间成本考虑,以桂千金子桂乙醇提取物作为最优实验研究对象,从中进一步分离提纯,寻找桂千金子的有效抗菌活性成分。
桂千金子乙醇提取物及其乙酸乙酯萃取物的抗菌效果相一致,可能与桂千金子的主要成分黄酮类化合物相关[17],黄酮类化合物在抗菌方面占有显著优势[18]。桂千金子有机提取物均呈酸性,乙酸乙酯萃取物则显示较强的酸性,考虑其可能与桂千金子含有酚酸类化学成分等有关[19-20],其中没食子酸为一种有机酸,在体外对金黄色葡萄球菌等有抑制作用,该发现为后续深入开展抗菌实验提供了实验基础。
细菌性疾病危及人类健康及公共卫生安全。目前,细菌耐药问题日益凸显,临床上仍以抗生素治疗感染性疾病为主。王梦瑜等[21]在分析近1 300种中药后认为,具备抗菌活性的中药通过有效成分的筛选,可为耐药菌的逆转研究提供参考,在中药中需求新的抗菌药物是解决耐药问题的有效途径之一。本实验研究桂千金子提取物对SA26003、MSSA4431、MRSA4290的抗菌作用,明确了桂千金子对金黄色葡萄球菌切实有效的抗菌活性,且对临床分离MRSA菌株也有具有较好的抗菌效果,进一步对临床分离MRSA菌株进行抗菌作用机制初探,外流AKP活性升高及扫描电镜结果一致表明,桂千金子乙醇提取物可能造成细菌细胞壁结构破损,或导致某种物质外流,影响细菌生长代谢,以上实验结果既验证了桂千金子在民间治疗痈疖之功效,也为临床寻求对抗MRSA有效药物提供了新思路。
本研究为桂千金子在民族瑶药中的开发利用提供了一定的实验依据,而具有抗菌作用的具体有效活性成分及其抗菌机制有待进一步研究。
