血小板/淋巴细胞比值对干燥综合征疾病活动程度的评估价值
2022-01-24王华南
王华南
(海南医学院第一附属医院风湿免疫科,海南 海口 570102)
干燥综合征(Sjogren’s syndrome,SS)是常见自身免疫性结缔组织疾病,多见于40~50岁的女性人群,男女比为1∶20~1∶9[1]。此症主要累及外分泌腺体,故也称为自身免疫性外分泌病,临床多表现为口干、眼干涩、猖獗性龋齿和口腔黏膜溃疡等唾液腺/泪腺功能受损症状,可伴有过敏性紫癜、关节痛、干咳气短等其他系统损害症状。由于SS作为一种全身性疾病,患者临床症状表现复杂多样,加上易与其他结缔组织疾病症状相混淆,导致临床准确评估病情仍存在一定困难,至今仍缺乏准确判断疾病活动的临床或免疫学金标准,不利于SS的临床治疗[2]。血小板/淋巴细胞比值(platelet/lymphocyte,PLR)是近年在诸多疾病领域备受重视的新型炎症指标,与恶性肿瘤、感染、危重症和其他自身免疫性疾病的病情变化关系密切[3],但关于SS病情活动评估的应用报道比较缺乏。本研究拟探讨PLR与SS疾病活动度的相关性。
1 资料与方法
1.1 一般资料
选取2019年2月至2021年6月海南医学院第一附属医院风湿免疫科收治的92例SS患者作为研究对象。入选标准:(1)满足《干燥综合征诊断及治疗指南》[4]的SS诊断标准;(2)年龄18~70岁,理解沟通能力正常,对本研究方法及目的知情且同意。排除标准:(1)继发性SS或合并其他自身免疫性疾病者;(2)合并风湿病史或风湿病家族史;(3)合并感染、恶性肿瘤、严重肝肾功能不全或血液系统疾病等;(4)入院前两周接受过SS相关的局部治疗或系统治疗;(5)哺乳期或妊娠期妇女;(6)拒绝配合相关检查和研究者。本研究获海南医学院第一附属医院伦理委员会批准。
1.2 方法
1.2.1 疾病活动度和分组 依据SS患者全身症状、淋巴结、腺体、关节和皮肤等12个系统病变情况,采用常用的欧洲抗风湿联盟SS疾病活动性评估指数(EULAR SS disease activity index,ESSDAI)进行病情活动度评估,系统病变包括4个活动水平:0分为不活动,1、2、3分依次表示低度、中度和高度活动,累计得分相加即为ESSDAI总分,ESSDAI>4分表示SS疾病处于活动期[5]。本研究依据ESSDAI评分情况将92例SS患者分为活动组(ESSDAI>4分)43例和稳定组(ESSDAI≤4分)49例。
1.2.2 资料收集和实验室检测 收集活动组和稳定组SS患者下列资料:性别、年龄、病程、白细胞计数(WBC)、红细胞沉降率(ESR)、C-反应蛋白(CRP)、补体C3、C4、抗SSA抗体阳性、抗SSB抗体阳性、免疫球蛋白G(IgG)和总蛋白等指标。入院后次日抽取患者空腹肘静脉血3 mL,3 000 rpm离心10 min,离心半径10 cm,采用全自动血液分析仪检测血小板(PLT)、淋巴细胞(LYM)并计算PLR,PLR=PLT/LYM。
1.3 统计学分析
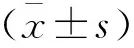
2 结果
2.1 两组临床资料比较
活动组和稳定组性别构成、年龄、病程、WBC计数、总蛋白、抗SSA抗体阳性、抗SSB抗体阳性和补体C3、C4比较,差异无统计学意义(P>0.05);活动组ESR、CRP、IgA、IgG、PLR高于稳定组,差异有统计学意义(P<0.05)。见表1。
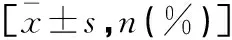
表1 两组临床资料比较
2.2 SS患者PLR与疾病活动指标的相关性
SS患者PLR与ESSDAI评分呈正相关(P<0.05),PLR与实验室指标ESR、CRP、IgA、IgG也均呈正相关(P<0.05)。见表2。

表2 SS患者PLR与疾病活动指标的相关性
2.3 PLR预测SS疾病活动度的ROC曲线分析
将SS患者疾病活动度作为二分类因变量(疾病活动=1,疾病稳定=0),绘制PLR对SS患者疾病活动度的评估的ROC曲线。分析结果显示,PLR的AUC为0.728,95% CI:0.603~0.853,最佳截断值为167.50,敏感度为65.12%,特异度为73.47%。
3 讨论
SS病因机制复杂,至今仍未完全明确,目前多认为与B细胞功能异常所致免疫紊乱、上皮和淋巴细胞异常活化和家族基因遗传易感性等因素有关[6-7]。该病因机制的复杂性导致无法有效对因治疗,医学上也缺乏SS特效根治手段,临床主要采取局部治疗或系统治疗缓解SS症状,稳定病情和减轻组织系统受累损害。临床实际中,SS患者病情多呈慢性进展,需定期复查WBC、ESR、CRP、相关抗体、补体C3、C4、免疫球蛋白等实验室指标了解病情变化情况,以便得到积极有效治疗。但SS患者的实验室指标水平、症状表现的个体差异较大,抗体检测的敏感性偏低,再加上目前SS的研究认识水平落后于系统性红斑狼疮(systemic lupus erythematosus,SLE)、类风湿关节炎(rheumatoid arthritis,RA)等相似疾病,尤其是SS鉴别诊断和治疗领域,使得临床准确评估SS病情尚存困难[8-9]。
ESSDAI评分是目前评估SS病情程度的常用有效手段,敏感性和特异性均较好,对监测病情和评估药物疗效有积极帮助,但ESSDAI评分也存在评价项目较多、耗时长和易受评估者主观因素影响等不足,部分基层地区可能难以准确熟练掌握ESSDAI评分方法。PLR是一项操作简单、检测费用低廉的实验室常规指标。近些年,PLR因能敏感反应机体系统性炎症,而被广泛用于肿瘤、急诊危重者和心脑血管疾病的病情及预后评估[10]。
本研究显示,活动组ESR、CRP、IgA、IgG、PLR均高于稳定组,且SS患者PLR与ESSDAI评分、ESR、CRP、IgA、IgG均呈正相关,提示SS患者病情活动期PLR升高,其水平表达与SS疾病活动相关指标存在紧密关联,上述传统实验室指标水平异常升高提示SS患者自身免疫反应较为强烈,机体炎性活动加重和恶化。本研究还指出,PLR对SS病情活动程度的诊断评估有一定的辅助作用,与王子铭等[11]研究结果一致。PLR与SS病情活动程度的相互影响机制可能是:(1)活动期SS患者体液免疫活化明显,免疫球蛋白IgA、IgG升高,增加抗SSA抗体和抗SSB抗体阳性率,受机体炎性反应加重影响,可激活PLT和趋化因子,促炎性细胞因子释放,参与和加重炎性反应,造成外周血PLT升高和LYM下降,表现为PLR明显升高[12];(2)SS患者PLR异常升高时,活化PLT具有募集白细胞的作用,募集过程可促进微血管血栓形成和上调促炎性因子表达水平,促进SS病情进展和加剧组织系统受累。同时LYM作为白细胞的重要组成部分,活化的PLT可直接吞噬、外渗和黏附于血管壁上的内皮细胞表面,发挥调节白细胞功能的作用,造成白细胞和LYM减少,降低机体免疫抵抗力,明显增加SS患者的组织系统受累和感染风险[13]。本研究不足之处:样本量偏少可能对实验室指标结果和分析造成一定干扰,扩大样本量可弥补此项不足;ROC曲线分析未能比较PLR与其他常用指标如ESR、CRP等对SS病情评估的诊断价值;未能分析PLR与SS患者具体器官脏器损害的关系,后续需深入探讨。
综上所述,PLR与SS病情活动密切相关,且PLR检测简单方便,可成为临床尤其是基层地区诊断评估SS病情程度的辅助指标。
