miR-320a、FOXQ1在胃癌组织中的表达及其与临床病理特征及预后的关系
2022-01-24董奇观杨玉超朱瑞武杨岩
董奇观,杨玉超,朱瑞武,杨岩
(辽宁省健康产业集团抚矿总医院,1.肿瘤放射治疗科;2.神经内科;3.心胸外科;4.肿瘤放射治疗科,辽宁 抚顺 113008)
胃癌是常见的恶性肿瘤之一,患者表现为上腹不适、嗳气,易被忽略,发现时已处于中晚期[1]。了解胃癌发生发展的机制及新型分子标记物,有利于胃癌诊断和确定治疗靶点。microRNAs(miRNAs)是一类高度保守、长度为19~24个核苷酸的内源性非编码单链RNA,通过与靶基因mRNA的3’端非翻译区互补结合,可参与增殖、分化、转移、血管形成、免疫应答等众多生物学过程[2]。研究[3]发现,miRNAs在肿瘤形成、转移、血管形成、免疫应答中发挥调控作用。同时,国外研究[4]表明,miR-320a在胃癌患者血清及组织中低表达。叉头框蛋白Q1(fork head box Q1,FOXQ1)能促进肿瘤细胞的生长、迁移[5]。生物信息学分析显示,miR-320a在FOXQl的3’端非翻译区存在潜在结合位点[6]。本研究旨在探讨miR-320a和转录因子叉头框蛋白Q1(FOXQl)在胃癌组织中的表达及其与临床病理特征及预后的关系。
1 资料与方法
1.1 一般资料
选取2015年1月至2018年1月辽宁省健康产业集团抚矿总医院收治的40例胃癌患者为研究对象。其中男性22例,女性18例;年龄40~70岁,平均(53.71±6.43)岁;≥50岁23例,<50岁17例[7];肿瘤直径≥4 cm 15例,<4 cm 25例[8];肿瘤位置:胃贲13例,胃体10例,胃窦15例,全胃3例;AJCC分期[9]:Ⅰ期8例,Ⅱ期20例,Ⅲ期12例;肿瘤分化程度[10]:低分化10例,中分化14例,高分化16例;淋巴结转移患者18例;浸润程度:深肌层浸润13例,浅肌层浸润10例,无浸润者17例。纳入标准:(1)符合《胃癌诊断标准》中诊断,并经病理学证实为腺癌[11];(2)年龄40~70岁;(3)临床资料完整。排除标准:(1)器质性疾病;(2)合并其他恶性肿瘤者;(3)胃癌切除前进行免疫及化疗等治疗;(4)临床资料不完整者。
1.2 方法
1.2.1 样本采集 采集肿瘤组织两份,一份放入4%甲醛中固定用于免疫化学染色,一份用于提取RNA。另在肿瘤边缘5 cm外采集癌旁组织,液氮冷冻,-80℃保存。
1.2.2 荧光定量PCR检测 取2 mm3样本组织超声匀浆,随后加入1 mL TrizolTM Reagent试剂(上海创赛科技有限公司,货号:15596026),室温静置10 min后加入340 μL氯仿,震荡均匀,4 ℃、12 000 rpm离心10 min,吸取上层水相并加入等体积的异丙醇,震荡均,室温反应10 min,4 ℃、12 000rpm离心10 min,弃上清液,室温放置15 min 晾干,焦碳酸二乙酯水溶解,取l μL RNA经1%琼脂糖凝胶电泳检测RNA完整性,采用核酸蛋白分析仪检测RNA纯度及浓度,然后将RNA逆转为cDNA:计算RNA需要量(反应体系中所需RNA量为1 000 ng,体系为20 μL),用200 μL EP 管,加入RNA的体积为V=1 000 ng/RNA 浓度,剩余体积用无RNA酶的水定容至10 μL;配制反应试剂混合液;吸取10 μL反应混合物加至每管(每管10 μL反应试剂混合物+10 μLRNA液),混匀后置于冰上,行逆转录;将cDNA产物稀释10倍,-20 ℃保存待用。反应条件:25 ℃ 10 min、30 ℃ 45 min,85 ℃ 5 min。以cDNA为模板,按Direce PCR Kit(上海钰博科技有限公司,货号:YB302A)说明进行PCR扩增。引物由上海生工生物工程股份有限公司合成。miR-320a上游引物序列:5’- GTT GGA TCC GGC GTT TCC TTC CGA CAT G-3’,下游引物序列:5’- GCT GAA TTC GTC CAC TGC GGC TGT TCC-3’,扩增片段大小为22 bp;U6上游引物序列:5’-CGC TTCA CGA ATT TGC GTG TCA T-3’,下游引物序列:5’-GCT TCG GCA GCA CAT ATA CTA AAA T-3’,扩增片段大小为370 bp;FOXQ1上游引物序列:5’-CGC GGA CTT TGC ACT TTG AA-3’、下游引物序列:5’-AGC TTT AAG GCA CGT TTG ATG GAG-3’,扩增片段大小为162 bp;β-actin上游引物序列:5 ’-TCC CTG TAT GCC TCT GG-3’,下游引物序列:5’-TGT CAC GCA CGA TTT CC-3’, 扩增片段大小为134 bp。PCR扩增反应体系为20 μL[12],加入以下试剂:cDNA1 μL、引物1 μL、TaqMan GEx MASTERMix 10 μL,加双蒸水补至20 μL。反应条件:95 ℃反应10 min,92 ℃反应15 s,60 ℃反应l min,共40个循环。每个样本做3个复孔。得到的数据用ABI公司(Applied Biosystems)提供的软件SDS2.4计算[13]。选择β-actin作为FOXQ1的内参,选择U6作为miR-320a的内参,所有反应均在PCR仪中完成,每个样本重复3次,得到结果的Ct值(threshold cycle)定义为达到超出实时定量PCR反应中检测阈值时所需要的临界循环数。△Ct表示研究标本中miRNA相对内参的表达量,ACt =CtmiRNA-CtU6,以2-△△Ct表示miRNA相对表达量,△△Ct=(CtmiRNA癌组织-CtU6癌组织)-(CtmiRNA癌旁组织-CtU6癌旁组织),计算出miR-320a相对表达量的平均值为0.54,以miR-320a相对表达量的平均值为界限,>0.54为miR-320a 高表达,≤0.54为miR-320a低表达。
1.2.3 免疫组织化学染色及结果判断 免疫组织化学染色按照En Vision(试剂盒购于福州迈新生物技术开发有限公司,货号:KIT-5020)两步法进行:使用4%甲醛固定标本24 h,常规石蜡包埋,制作切片,切片浸于3%H2O2溶液中3 min,柠檬酸高压抗原修复10 min,-抗4 ℃孵育过夜,通用型二抗-HRP聚合物,37 ℃孵育30 min,滴加DAB显示,显微镜下观察显色情况,苏木素复染,0.1%盐酸乙醇分化,PBS冲洗返蓝,乙醇脱水、透明、中性树胶封固。用阳性切片作为阳性对照,以PBS代替一抗作为阴性对照。FOXQl结果由两位有经验的病理医师采用Greens-pan半定量法判断阳性细胞及细胞染色强度[14-15];每例观察5个以上高倍视野(400×),计数不少于1 000个细胞中的阳性细胞数。FOXQ1表达阳性参考Liang等[16]的判定标准:阳性细胞率≤10%为0分,11%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;染色强度浅黄色为1分,棕黄色为2分,棕褐色为3分。将阳性细胞率得分和染色强度得分相乘即为最后得分,0~3分定义为阴性,4~12分定义为阳性。
1.3 统计学分析
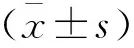
2 结果
2.1 癌组织和癌旁组织miR-320a表达量比较
癌组织中miR-320a相对表达量低于癌旁组织,差异有统计学意义(P<0.05)。见表1。
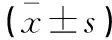
表1 癌组织和癌旁组织miR-320a及FOXQl mRNA相对表达量比较
2.2 癌组织和癌旁组织FOXQl表达情况比较
FOXQl在癌组织中的阳性表达率高于癌旁组织,差异有统计学意义(P<0.05)。见表2及图1。

表2 癌组织和癌旁组织间FOXQl表达[n(%)]

2.3 miR-320a及FOXQl表达水平与胃癌患者临床病理特征的关系
miR-320a及FOXQl表达水平与肿瘤直径、AJCC分期、肿瘤分化程度、淋巴结转移及浸润程度有关(P<0.05);与年龄、性别、肿瘤位置无关(P>0.05)。见表3。

表3 miR-320a及FOXQl表达水平与胃癌患者临床病理特征的关系[n(%)]
2.4 影响胃癌患者预后的因素
对患者进行3年随访,随访时间至2021年2月,均无失访,以死亡为随访终点事件。40例患者死亡12例,3年生存率为70.00%。单因素结果显示,肿瘤直径、AJCC分期、肿瘤分化程度、淋巴结转移、浸润程度及miR-320a、FOXQl表达为影响患者预后的因素(P<0.05);多因素分析显示,肿瘤直径、AJCC分期、肿瘤分化程度、淋巴结转移及浸润程度及miR-320a、FOXQl表达为影响患者预后的独立因素(P<0.05)。见表4。

表4 影响胃癌患者预后的因素
2.5 miR-320a及FOXQl表达与预后的关系
miR-320a低表达和FOXQl阳性表达患者3年生存率低于miR-320a高表达和FOXQl阴性表达患者(60.71%vs.91.67%,χ2=3.832,P=0.039,56.00%vs.93.33%,χ2=6.222,P=0.013)。见图2及图3。


3 讨论
2012年全球新发胃癌95.1万,我国约占50%,且死亡率约占45%[17]。因此,早诊断及治疗对改善预后至关重要。miRNA是一类高度保守、长约19~24个核苷酸的内源性非编码单链RNA,可能参与了增殖、分化、转移、血管形成、免疫应答等众多生物学过程[18]。miR-320a已被证明是一种具有抑制肿瘤增殖和侵袭功能的miRNA[19-20]。在结肠癌中,miR-320a可抑制细胞转移、生长及增殖[21];miR-320a通过抑制Wnt/p-catenin通路抑制前列腺癌的干细胞特性[22];在白血病细胞中miR-320a通过靶定CD71抑制增殖[23];在非小细胞肺癌中,miR-320a可抑制内皮细胞血管形成和肿瘤细胞迁移[24]。此外,miR-320a 能重塑基质纤维细胞,减慢肿瘤发展。另有报道[25]表明,miR-320a具有癌基因的作用。丁兢等[26]研究表明,miR-320a/c/d通过抑制抑癌基因的表达促进肝癌细胞迁移。而本研究证实,癌组织中miR-320a相对表达量低于癌旁组织(P<0.05),与唐淑丽等[27]研究一致,说明胃癌肿瘤形成过程中,miR-320具有抑癌基因功能,其表达降低促进胃癌的形成。miR-320a表达与肿瘤直径、AJCC分期、肿瘤分化程度、淋巴结转移及浸润程度有关(P<0.05),因此推测miR-320a表达降低参与了胃癌发生发展,与胃癌细胞增殖、侵袭与迁移中有关。此外, miR-320a低表达的患者3年生存率低于miR-320a高表达的患者(P<0.05),提示随着miR-320a表达的降低,胃癌病情进展快,恶性程度越高,可进一步促进癌细胞的转移,因此预后较差,进一步说明miR-320a可能是潜在的胃癌治疗靶点。
FOXQ1是核转录调控因子,在发育、代谢、肿瘤及老化中具有重要作用,其通过TGF-B/Smad途径作为NF-kB的核内拮抗剂,阻止NF-kB乙酰化,减少NF-kB过度激活引起的肿瘤;并可减少Shh通路信号转导,抑制肿瘤侵袭转移。同时,Wnt/3-catenin通路参与调控细胞的发育、增殖、分化和粘附[28]。相关研究[29]表明,FOXQ1与胃上皮分化有关。同时杨欣怡等[30]研究发现,FOXQ1表达与肿瘤转移及预后明显相关。本研究发现,FOXQl mRNA相对表达量高于癌旁组织(P<0.05),且FOXQl在癌组织中的阳性表达率高于癌旁组织(P<0.05),提示FOXQl与胃癌发生相关。FOXQl表达与肿瘤直径、分期、肿瘤分化程度、淋巴结转移及浸润程度有关,提示FOXQl高表达可促进胃癌细胞增殖、侵袭与迁移。此外,FOXQl阳性患者3年生存率低于FOXQl阴性患者(P<0.05),提示胃癌中FOXQl阳性表达患者预后较差,可能与其对胃癌细胞转移和侵袭能力调节有关,说明miR-320a可能是潜在的胃癌治疗靶点。但本研究纳入例数较少,且对预后随访时间较短,下一步研究将扩大样本量进一步论证。
综上,miR-320a低表达和FOXQl阳性与胃癌生长、侵袭、转移及不良预后相关,可作为病情评估和预后的靶标分子。
