白细胞介素-33对心力衰竭小鼠趋化因子2/趋化因子2受体介导的调节性T细胞表达及心肌纤维化的影响△
2022-01-23李金贤程新春
李金贤,莫 煊,程新春,谢 荣
[1.新疆维吾尔自治区人民医院康复医学科,乌鲁木齐 830000;2.广州医科大学附属第五医院心理(精神)科,广州 510700;3.新疆维吾尔自治区人民医院老年医学科,乌鲁木齐 830000]
心力衰竭为多种心血管疾病的终末期阶段,具有较高发病率和病死率[1-2]。心力衰竭可由多种原因引起,发病机制比较复杂,研究发现,心肌组织炎症反应、免疫应激、纤维化等导致的心室重构在心力衰竭过程中起到重要作用[3-4]。趋化因子2(chemokine 2,CCL2)又称为单核细胞趋化因子,可识别趋化因子2 受体(CCL2 receptor,CCR2),刺激单核/巨噬细胞、活性T 细胞等炎性细胞,增强机体炎症反应[5-7]。大量研究发现,炎症反应与机体纤维化呈正相关,随着小鼠肺纤维化的发展,小鼠肺组织中炎症反应也增强[8]。白细胞介素(interleukin,IL)-33 为细胞因子IL-1 家族的新成员,是一种生物力学诱导蛋白,主要由心脏成纤维细胞合成[9]。研究发现,IL-33 可阻断心肌纤维化,保护心脏组织,减轻心力衰竭[10-11]。然而CCL2/CCR2 通路在IL-33 治疗心力衰竭过程中是否发挥作用,仍需进一步研究。本研究通过构建小鼠心力衰竭模型,采用重组IL-33 和IL-33 抑制剂处理,探究IL-33 对心力衰竭小鼠的影响以及对CCL2/CCR2 通路的影响,为心力衰竭临床治疗提供新的思路。
1 材料及方法
1.1 动 物
BALB/c 小鼠,雌雄兼有,体质量18~20 g,购自北京北生研生物制品有限公司,许可证号:SYXK(京)2016-0051。适应性饲养一周,自由采食饮水。
1.2 主要试剂
苏木素伊红(Hematoxylin eosin,HE)染色试剂盒(货号:G1120)、Masson 染色试剂盒(货号:G1340)、小鼠鼠重组IL-33(货号:P00159)均购自北京索莱宝科技有限公司。IL-33 抗体(货号:ab207737)购自英国Abcam 公司。CD4 抗体(货号F1773),CD25 抗体(货号:FCMAB189F)购自美国Sigma-Aldrich 公司。CCL2(货号:14-7096-81)、CCR2(货号:PA5-23037)一抗及二抗(货号:31460),均购自美国Thermo Fisher公司。GADPH一抗(51332)购自美国Cell Signaling Technology公司。
1.3 实验仪器
光学显微镜购自日本Olympus 公司,动物彩色多普勒超声检测仪购自上海麦本医疗科技有限公司,流式细胞仪购自美国贝克曼库尔特有限公司,蛋白电泳仪购自北京凯元信瑞仪器有限公司,凝胶成像系统购自美国ProteinSimple 公司。
1.4 实验方法
1.4.1 心力衰竭小鼠动物模型制备 参考参考文献[12],采用冠状动脉结扎法建立小鼠心力衰竭模型。用1.0%戊巴比妥钠按1 mL/kg 剂量腹腔注射,将小鼠麻醉,常规消毒,连接心电图,气管插管,连接至小动物呼吸机,辅助通气。经左侧剪开皮肤,于3~4 肋间钝性分离肌肉组织,露出心脏,在左冠状动脉前降支1~2 mm处结扎。当心电图显示ST 段持续升高,左心室射血分数(left ventricular ejection fraction,LVEF)<45%,表明造模成功。然后迅速将小鼠心脏放回胸腔,消毒缝合。假手术组只打开胸腔,露出心脏,不结扎冠状动脉。
1.4.2 动物分组 按照随机分组,将小鼠分成假手术组、模型组、IL-33 组和IL-33 抑制剂组,每组12 只。造模前1 h,IL-33 组尾静脉注射400 μg/mL重组IL-33 5 μL,IL-33 抑制剂组注射400 μg/mL IL-33 抑制剂12.5 μL,假手术组和模型组注入5μL 磷酸盐缓冲液。
1.4.3 各组小鼠心功能指标检测及样本采集 造模24 h 后,将小鼠麻醉,仰卧固定于手术台,采用多普勒超声心电图进行超声观察,并计算小鼠心脏收缩末期左心室内径(left ventricular internal diameter at end-systole,LVIDs),舒张末期左心室内径(left ventricular internal diameter at end-diastole,LVIDd)、左心室射血分数(left ventricular ejection fraction,LVEF)和左心室短轴缩短率(left ventricu⁃lar fractional shortening,LVFS)变化。
检测完成后,各组小鼠摘眼球取血,肝素抗凝,用于后续流式细胞检测。每组小鼠随机选取6 只,取心脏组织置于甲醛中固定,取另外6 只小鼠心脏于液氮中速冻,置于-80℃中保存。
1.4.4 流式细胞检测免疫功能指标 取1.4.3 制备的抗凝血,加入表面标记抗体CD4 和CD25 混合液,避光孵育加溶血素,900 rmp/min 离心10 min,弃上清,加磷酸盐缓冲液清洗,并将细胞数调整为1×106个细胞/mL,使用流式细胞仪检测。其中CD4+CD25+标记的为调节性T 细胞(T regulatory cell,Treg cell)。
1.4.5 苏木素伊红染色观察各组小鼠心脏组织形态学变化 取出甲醛固定的心脏组织,脱水、透明,石蜡包埋,切片,使用HE 染色,在光学显微镜下观察各组小鼠的心脏组织病理变化。
1.4.6 Masson 染色观察并检测胶原容积分数 取病理组织切片,根据Masson 染色试剂盒进行染色,在光学显微镜下观察,并计算胶原容积分数(collagen volume fraction,CVF)。Masson 染色后,心肌组织为紫红色,胶原纤维被染为蓝色,CVF=胶原纤维面积/切片面积×100%。
1.4.7 Western blot 法检测小鼠心脏组织蛋白水平变化 取-80℃中保存的心脏组织,加入RIPA 裂解液和蛋白酶抑制剂,液氮研磨,提取总蛋白,BCA 试剂盒测定蛋白浓度,取20 mg 蛋白上样十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,分离总蛋白,然后转移到聚偏氟乙烯(PVDF)膜上。在室温下使用5%脱脂奶粉封闭1 h,然后与CCL2、CCR2、GAPDH 一抗孵育,在4℃下过夜,然后洗膜,将膜与二抗在室温下孵育1 h。曝光显色,使用凝胶成像系统分析蛋白质的相对表达量,以GAPDH 为内参蛋白。
1.5 统计学分析
本研究所得数据均采用SPSS 22.0 软件进行统计,计量资料以()表示,采用t检验,多组间比较采用单因素方差分析,进一步两两比较,采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 白细胞介素-33 对小鼠心功能指标的影响
与假手术组相比,模型组小鼠LVIDs 和LVIDd显著升高(P<0.05),LVEF 和LVFS 显著降低(P<0.05);与模型组相比,IL-33组LVIDs和LVIDd显著降低(P<0.05),LVEF 和LVFS 显著升高(P<0.05),IL-33 抑制剂组LVIDs 和LVIDd 显著升高(P<0.05),LVEF 和LVFS 显著降低(P<0.05),见表1。
表1 各组小鼠心功能指标比较 []
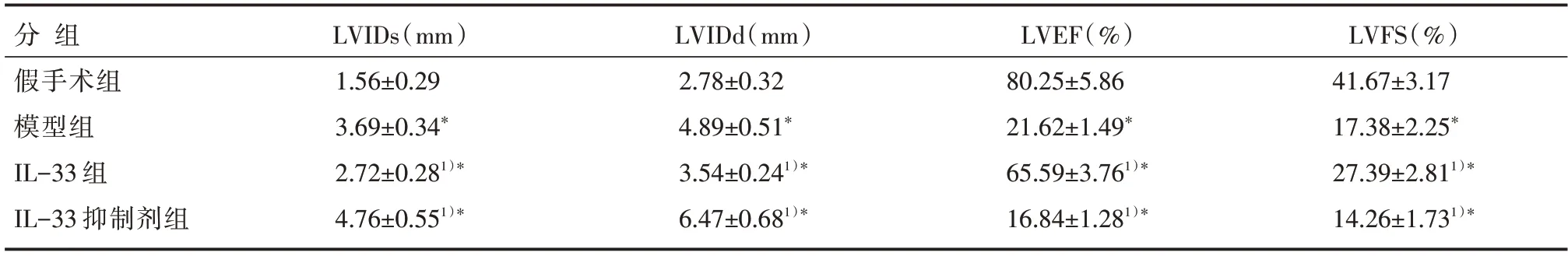
表1 各组小鼠心功能指标比较 []
注:与假手术组相比,*P<0.05;与模型组相比,1)*P<0.05
2.2 白细胞介素-33 对小鼠外周血中调节性T 细胞百分比的影响
与假手术组相比,模型组CD4+CD25+Treg 细胞百分比显著降低(P<0.05);与模型组相比,IL-33组CD4+CD25+Treg 细胞百分比显著升高(P<0.05),IL-33 抑制剂组CD4+CD25+Treg 细胞百分比显著降低(P<0.05),见图1、表2。
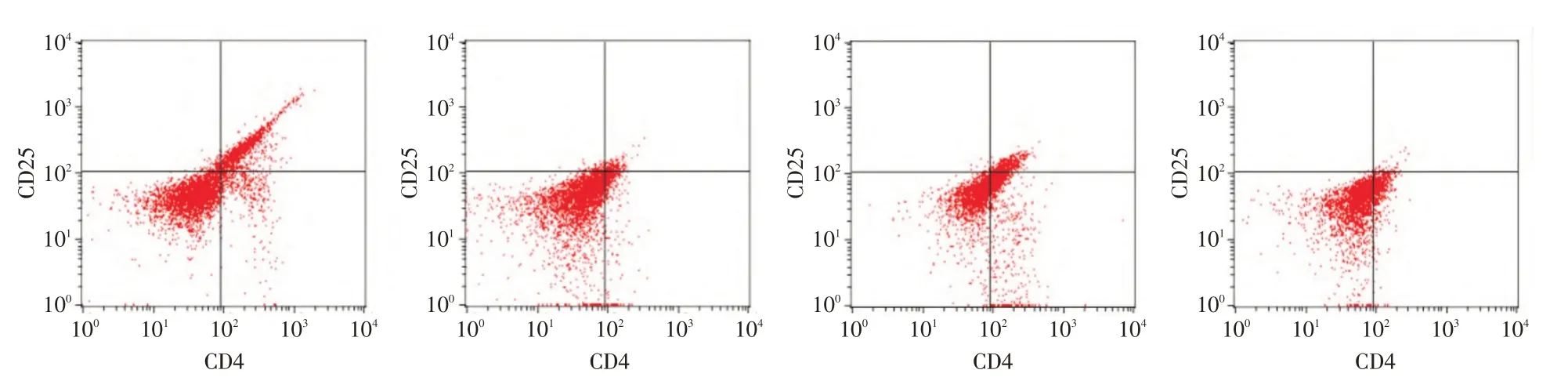
图1 流式细胞术检测结果
表2 各组小鼠外周血中Treg 细胞水平比较 []
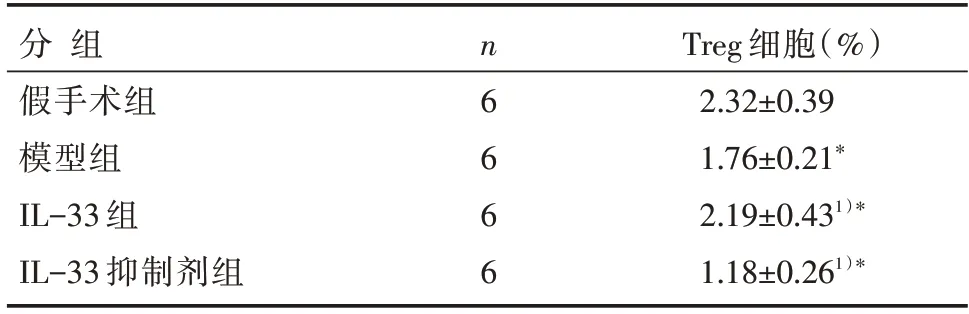
表2 各组小鼠外周血中Treg 细胞水平比较 []
注:与假手术组相比,*P<0.05;与模型组相比,1)*P<0.05
2.3 白细胞介素-33 对小鼠心脏组织病理变化的影响
HE 染色结果显示,假手术组心脏组织正常,心肌细胞排列整齐,肌纤维完整,无炎性细胞浸润。模型组小鼠心肌细胞肥大变性,排列不规则,心肌纤维断裂,间隙增大,出现坏死及纤维化,有大量炎性细胞浸润。与模型组相比,IL-33 组小鼠心脏组织病变程度减轻,炎性浸润程度降低;IL-33 抑制剂组小鼠心脏组织病变程度更加严重,炎性细胞浸润程度升高,见图2。
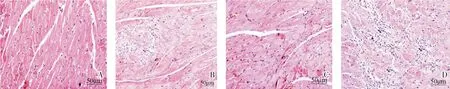
图2 各组小鼠心肌组织HE 染色结果(×200)(A:假手术组;B:模型组;C:IL-33 组;D:IL-33 抑制剂组)
2.4 白细胞介素-33 对小鼠心脏组织纤维化及胶原容积分数的影响
Masson 染色结果显示,假手术组心肌组织正常,几乎无纤维化。模型组小鼠心肌纤维断裂,可见大量胶原纤维沉积。与模型组相比,IL-33 组小鼠心肌组织中胶原纤维沉积减少;IL-33 抑制剂组小鼠心肌组织胶原纤维沉积增加,见图3。
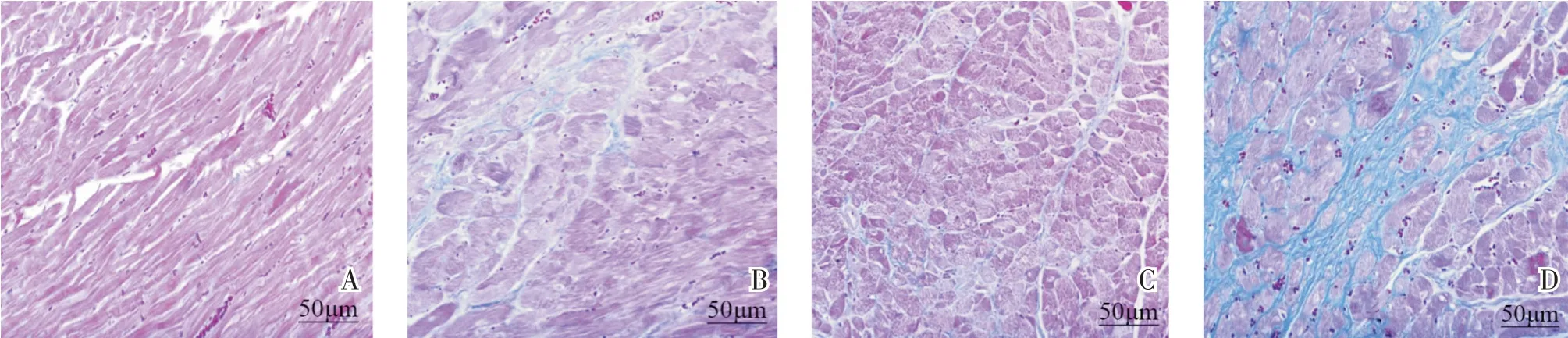
图3 各组小鼠心肌组织Masson 染色结果(×200)(A:假手术组;B:模型组;C:IL-33 组;D:IL-33 抑制剂组)
与假手术相比,模型组小鼠心肌组织CVF 显著升高(P<0.05);与模型组相比,IL-33 抑制剂组小鼠心肌组织CVF 显著升高(P<0.05),IL-33 组小鼠心肌组织CVF 显著降低(P<0.05),见表3。
表3 各组小鼠心脏组织CVF 比较 []
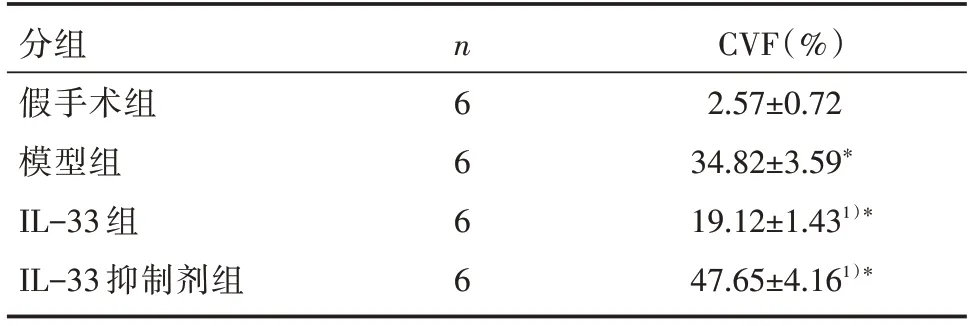
表3 各组小鼠心脏组织CVF 比较 []
注:与假手术组相比,*P<0.05;与模型组相比,1)*P<0.05
2.5 白细胞介素-33 对小鼠心脏组织CCL2、CCR2蛋白水平的影响
与假手术组相比,模型组小鼠CCL2 和CCR2蛋白水平显著升高(P<0.05);与模型组相比,IL-33 组CCL2 和CCR2 蛋白水平显著降低(P<0.05),IL-33 抑制剂组CCL2 和CCR2 蛋白水平显著升高(P<0.05),见图4。
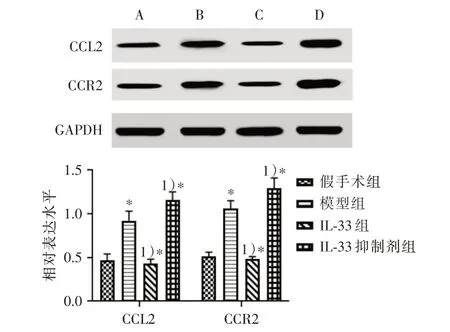
图4 小鼠心脏组织蛋白western blot 检测结果(A:假手术组;B:模型组;C:IL-33 组;D:IL-33 抑制剂组)
3 讨论
心力衰竭是心脏结构、功能、节律或传导异常的结果,主要是由心肌梗死(收缩功能障碍)、原发性高血压(高血压)(舒张功能障碍和收缩功能障碍)引起,或者两者兼而有之[13]。心室重构会引起心排血量不足、心肌舒张和收缩功能障碍、血液循环系统产生淤血等具体临床特征,心肌代谢、心脏收缩舒张功能、心脏负荷、耗氧量、血管扩张等指标对分析心功能损伤的程度具有关键作用[1]。心肌细胞肥大和心肌纤维化是心力衰竭常见的病理生理过程,研究发现,抑制心肌纤维化能有效改善心力衰竭小鼠心功能[14]。本研究采用冠状动脉结扎法建立小鼠心力衰竭模型,结果显示小鼠心肌细胞肥大变性,排列不规则,心肌纤维断裂,间隙增大,出现坏死及纤维化,有大量炎性细胞浸润,LVIDs、LVIDd 和CVF 升高,LVEF、LVFS 降低,表明心力衰竭小鼠心肌组织纤维化,造成心脏功能障碍,说明模型建立成功。Treg 细胞可分泌IL-10等抗炎性细胞因子,抑制对自身和非自身抗原的异常或过度免疫反应[15]。有研究发现,参附注射液可改善慢性心力衰竭患者心功能,可能与提高Treg 细胞比例有关[16]。本研究发现,心力衰竭小鼠外周血中Treg 细胞百分比显著降低,表明心力衰竭小鼠免疫失衡,可能与心功能受损有关。
纤维化是长期存在的心肌负荷过重的标志,心肌纤维化与心肌细胞病理生理之间的关系尚不完全清楚。IL-33/ST2 信号通路在自身免疫性疾病过程中,对心肌细胞肥大、心肌纤维化具有抑制作用[17]。本研究中分别注射重组IL-33 和IL-33抑制剂,结果显示,与模型组相比,IL-33 组小鼠心肌组织病变程度减轻,胶原纤维沉积减少,LVIDs、LVIDd 和CVF 显著降低,LVEF、LVFS 和Treg 细胞百分比显著升高;IL-33 抑制剂组小鼠心肌组织病变程度更加严重,纤维化及坏死面积增大,LVIDs、LVIDd 和CVF 显著升高,LVEF、LVFS 和Treg 细胞百分比显著降低,表明IL-33 可减轻心肌组织纤维化及其他损伤,改善心功能,可能与提高Treg 细胞百分比有关。
CCL2 是一种具有广泛生物学活性的低分子蛋白质,CCR2 是CCL2 的主要受体,CCL2 与CCR2相互作用[18]。在肝纤维化中,CCR2 缺失,可明显减轻CCL4 诱导的纤维化程度,说明CCR2 可参与肝纤维进程[19]。Bajpai 等[20]研究发现,心肌损伤后,CCR2/CCL2 表达量显著升高。本研究结果显示,模型组小鼠心脏组织中CCL2、CCR2 蛋白水平显著升高,表明心力衰竭小鼠心脏组织CCL2、CCR2 处于活化状态,可能与心肌纤维化及心功能受损有关。在肝硬化/肝纤维化中,IL-33 可诱导肝细胞产生微蛋白,降低CCR2/CCL2 表达,防治肝损伤和纤维化[21]。本研究中,心力衰竭小鼠经IL-33和IL-33 抑制剂处理后,IL-33 组小鼠心脏组织CCL2 和CCR2 蛋白水平显著降低,IL-33 抑制剂组CCL2 和CCR2 蛋白水平显著升高,表明IL-33 刺激可抑制心力衰竭小鼠心脏组织中CCL2/CCR2 通路活化,减轻纤维化程度。
综上所述,IL-33 可能通过抑制CCL2/CCR2 通路,减轻心力衰竭小鼠心肌组织纤维化,保护心功能,为研究心力衰竭作用机制提供了新思路,但目前IL-33 在心力衰竭过程中的作用尚不十分明确,具体作用机制仍有待于进一步研究。
