工程化仿生血小板膜包覆纳米颗粒阻断金黄色葡萄球菌的细胞毒性并防止致命的全身感染
2022-01-22JwaKyungKimSatoshiUhiyamaHuaGongAlexanraStreamLiangfangZhangVitorNizet
Jwa-Kyung Kim,Satoshi Uhiyama,Hua Gong,Alexanra Stream,Liangfang Zhang,e,Vitor Nizet,f,
aDivision of Nephrology,Department of Internal Medicine&Kidney Research Institute,Hallym University Sacred Heart Hospital,Anyang 14068,Republic of Korea
bDepartment of Clinical Immunology,Hallym University Sacred Heart Hospital,Anyang 14068,Republic of Korea
cDivision of Host-Microbe Systems and Therapeutics,Department of Pediatrics,University of California San Diego,La Jolla,CA 92093,USA
dDepartment of NanoEngineering,University of California San Diego,La Jolla,CA 92093,USA
eMoores Cancer Center,University of California San Diego Health,La Jolla,CA 92037,USA
fSkaggs School of Pharmacy and Pharmaceutical Sciences,University of California San Diego,La Jolla,CA 92093,USA
金黄色葡萄球菌(S.aureus)是一种常见的人类病原体,它可以引发严重的侵袭性感染,如菌血症、败血症和心内膜炎,具有较高的发病率和死亡率。然而由于细菌的抗生素耐药性增强,如耐甲氧西林金黄色葡萄球菌(MRSA),加剧了此类细菌的发病率和死亡率。金黄色葡萄球菌的发病机制是由毒素的分泌推动的,如膜损伤孔α毒素,它有不同的细胞靶点,包括上皮细胞、内皮细胞、白细胞和血小板。本文采用人体血小板膜包覆纳米颗粒(PNP)作为一种仿生诱饵策略,来中和金黄色葡萄球菌的毒素,并维持宿主细胞的防御功能。血小板膜包覆纳米颗粒保护血小板免受由金黄色葡萄球菌毒素带来的损伤,维持血小板活化和杀菌活性。血小板膜包覆纳米颗粒也同样保护巨噬细胞免受由金黄色葡萄球菌毒素带来的损伤,支持巨噬细胞进行氧化迸发、产生一氧化氮和维持其杀菌活性,并减少耐甲氧西林金黄色葡萄球菌诱导的中性粒细胞胞外杀菌网络。在感染系统性耐甲氧西林金黄色葡萄球菌的小鼠模型中,血小板膜包覆纳米颗粒制剂减少了血液中的细菌数量并防止小鼠发生死亡。总之,目前的研究结果证明了血小板膜包覆纳米颗粒的治疗优点,如中和毒素、保护细胞和增加宿主对侵袭性金黄色葡萄球菌感染的抵抗力。
纳米颗粒
纳米海绵
血小板
金黄色葡萄球菌
细菌毒素
败血症
1.引言
血小板大量分布在血液循环中,它的体积很小,是无细胞核的细胞碎片。血小板的主要功能包括凝血和止血,修补破损的血管。然而,新的证据显示,血小板在感染性疾病中可以发挥哨兵作用[1-3]。先天免疫系统对病原体入侵的反应明显受到血小板相互作用的影响,因为血小板可以感知危险信号并对其做出反应,并将白细胞引导至受伤部位、炎症部位或者病原体入侵部位[4-7]。
血小板在宿主防御机制中发挥多重作用[1-2,8-9]。它可以通过释放包括防御素(defensins)[10]、抗菌肽(cathelicidins)[11]、血栓素(thrombocidins)[12]和趋化因子源性抗菌多肽(kinocidins)[13]在内的抗菌多肽(antimicrobial peptides)直接杀灭细菌。血小板还可以聚集起来捕杀细菌和阻碍病原体传播[14]。通过不同的机制,血小板可以调节储存在细胞颗粒内的各种细胞内介质的释放[3]。这些微粒可以诱发炎症,直接或间接地影响免疫系统效应细胞的募集和活性[15]。控制血小板-白细胞和血小板-细菌之间相互作用的机制非常复杂,这反映了血小板的受体类型也是复杂多样的,如补体受体[16]、Fc-γ受体IIa[17]、Toll样受体[18]、糖蛋白(GP)IIb-IIIa[19]和GPIb[20]。总之,血小板不仅仅是凝血剂,它在保持宿主免疫和炎症反应的良好平衡中也发挥着关键作用。
金黄色葡萄球菌(S.aureus),如耐甲氧西林金黄色葡萄球菌(MRSA),是一种常见的机会性感染革兰氏阳性细菌病原体。由金黄色葡萄球菌引起的疾病很多,如侵袭性血流感染、败血症和心内膜炎[21-22]。重度金黄色葡萄球菌感染的症状通常表现为明显的免疫失调,这在某种程度上是由大量分泌的毒素因子(如α-毒素)引起的。金黄色葡萄球菌毒素可以黏附在宿主细胞上的同源表面受体上,并通过形成膜孔、破坏信号转导途径或激活降解宿主分子的酶来破坏宿主细胞的完整性和损害宿主细胞的功能[23-24]。因为金黄色葡萄球菌分泌的毒素是其发病机制的重要因素,所以清除或中和毒素已成为一种潜在的、可以提高治疗效果的治疗方法。在这一方面,靶向抗体或利用纳米医学中和毒素的方法引起了公众关注[25-27]。其中一种生物医学解毒方法是利用天然细胞膜包裹的纳米颗粒,这种方法引入了仿生设计理念[28-29]。天然细胞膜独特的结构可以让这些纳米颗粒作为诱饵,像海绵一样非特异性地吸收细菌膜毒素因子,从而中和这些因子的细胞溶解活性,而不用考虑它们精确的分子结构[30]。例如,用天然红细胞膜包覆聚合物纳米颗粒开发出的红细胞(RBC)膜涂层“纳米海绵”,可保护实验小鼠免受纯化α-毒素蛋白的致命侵袭[31],并且还会减小感染耐甲氧西林金黄色葡萄球菌或A组链球菌皮肤疾病的实验小鼠模型的病灶范围[32-33]。在大肠杆菌败血症的实验小鼠模型中,巨噬细胞膜包覆的“纳米海绵”结合细菌脂多糖(LPS)并与促炎细胞因子隔离,从而减慢了细菌传播的速度并降低了小鼠的死亡率[34]。
经过证明,血小板可以帮助宿主抵抗侵袭性金黄色葡萄球菌感染。实验组小鼠体内缺少抗体介导的血小板会损害其清除金黄色葡萄球菌的功能。与正常对照小鼠相比,实验组小鼠肾脏中的细菌负荷更高、细胞因子反应更强烈、存活率低都证明了这一点[35]。另一项研究表明,血小板可以增强腹腔巨噬细胞对金黄色葡萄球菌的吸收能力和细胞内杀伤机制,这可能与一种依赖于血小板因子β1-防御素的机制有关[8]。血小板是金黄色葡萄球菌α-毒素的重要靶标,因为它们在其表面膜上表达含有解聚素和金属蛋白酶结构域的蛋白10(ADAM10),即已鉴定的α-毒素受体[36]。在小鼠中,α-毒素介导的血小板受损和聚集会引发金黄色葡萄球菌败血症的肝损伤[37]。
由于血小板在防御金黄色葡萄球菌方面起重要作用,并且是病原体膜毒素的靶点,本文假设,仿生人体血小板膜或血小板膜包覆纳米颗粒(PNP)的生物可降解聚合物纳米颗粒核,可以用于强化血小板介导的对病原体的防御。当前的研究工作证明了血小板膜包覆纳米颗粒在中和细菌毒素、保护细胞,以及增加宿主对侵袭性金黄色葡萄球菌感染的抵抗力方面的治疗益处。
2.实验材料和方法
2.1.血小板膜的衍生
在临床使用期限到期的24~48 h内,从圣地亚哥血库获得人类O型阴性(通用血型)富血小板血浆(PRP),该血浆储存在标准柠檬酸葡萄糖(ACD)溶液中。在先前研究的基础上,该富血小板血浆可用于制造全功能血小板膜[38]。将含有50 mmol·L-1乙二胺四乙酸(EDTA;赛默飞世尔科技,美国)和300 μL蛋白酶抑制剂(PI;赛默飞世尔科技,美国)的磷酸盐缓冲盐水(PBS)溶液添加到富血小板血浆制剂中以抑制血小板活化。在室温下以4000 r·min-1的速度离心血小板15 min,然后去除上清液,将沉淀的血小板重新悬浮在PBS+1 mmol·L-1EDTA和蛋白酶抑制剂片剂中。
2.2.血小板“纳米海绵”的制备
用等分的(1.2 mL)血小板制剂(约3×109个细胞)包覆1 mg聚乳酸-羟基乙酸共聚物(PLGA)核。通过三次冻融循环获得血小板膜悬浮液:首先将等分试样在零下80℃下冷冻,接着在室温下解冻,然后在相对离心力(rcf)为8000的条件下离心7 min以进行离心造粒。最后,将它们重新悬浮在水中并通过Pierce BCA蛋白质检测试剂盒(赛默飞世尔科技,美国)进行定量。血小板膜包覆纳米颗粒由两个阶段获得:第一步,采用纳米沉淀法使用溶解在10 mg·mL-1丙酮中的0.67 dL·g-1羧基封端的50∶50聚乳酸-羟基乙酸共聚物(LACTEL可吸收聚合物)制备直径约80 nm的聚合物核,然后将溶解的1 mL聚乳酸-羟基乙酸共聚物快速加入3 mL水中,并将混合物搅拌12 h以蒸发丙酮直至得到浓度为2.5 mg·mL-1的纳米颗粒。第二步,将血小板膜制剂与纳米颗粒核以1∶1的比例(膜蛋白与聚合物的质量)结合。利用频率为42 kHz、功率为100 W的超声波处理5 min,将血小板膜囊泡分散并与聚乳酸-羟基乙酸共聚物粒子融合,以实现膜包覆。
2.3.血小板膜包覆纳米颗粒大小分布和包覆分析
当膜蛋白与聚合物的质量比为1∶1时,得到的颗粒比聚乳酸-羟基乙酸共聚物核略大,聚乳酸-羟基乙酸共聚物表面的zeta电位与血小板膜衍生囊泡的相近,说明膜成功包覆。事实上,包覆层增强了聚乳酸-羟基乙酸共聚物核的胶体稳定性,使其在生理盐水浓度下更容易聚集。本研究采用动态光散射(Zetasizer Nano ZS ZEN 3600;Malvern Panalytical Ltd.,英国)分析血小板膜包覆纳米颗粒,进行三次实验,以确定其大小和一致性。利用透射电子显微镜(TEM),将血小板膜包覆纳米颗粒放置在400目碳涂层铜网格(Electron Microscopy Sciences,美国)上,用1%醋酸双氧铀(EM Sciences,美国)染色,然后用Zeiss Libra 120 PLUS能量过滤式透射电子显微镜(EFTEM,德国)观察。
2.4.菌株和α-毒素
本研究采用了耐甲氧西林金黄色葡萄球菌菌株USA-300/TCH1516及其同源人类白细胞抗原(HLA)突变体(Sun BioRxiv,美国)。在37℃下,在Todd-Hewitt液体培养基(THB;赛默飞世尔科技,美国)中繁殖菌株至对数生长中期[光密度600 nm(OD600)=0.4],在4000 r·min-1下离心10 min后得到球状物,接着洗涤一次,然后重新悬浮在磷酸盐缓冲盐水中,直至得到所需的稀释度。将确定的细菌接种物的稀释板当作菌落形成单位(CFU)。重组α-毒素购自Sigma-Aldrich公司(#H9395;美国)。
2.5.血小板分离
在受试者知情并同意的情况下,通过静脉采血术从健康人类供体中收集静脉血,并用ACD抗凝剂(体积分数为16.67%;Sigma-Aldrich,美国)对血液进行抗凝。在离心机不制动的情况下,以1000 r·min-1的离心速度对血液离心10 min,得到富血小板血浆,然后采用富血小板血浆的前三分之二以避免白细胞污染。在1500 r·min-1的离心速度下离心10 min,从富血小板血浆中分离出血小板,然后将其重悬于室温下的无血清Roswell Park Memorial Institute 1640培养基(赛默飞世尔科技,美国)中。
2.6.血小板细胞毒性测定
选取经血小板膜包覆纳米颗粒(1 mg·mL-1)或者空白对照预处理的人体血小板(每孔1×107个),在室温下放置30 min,然后暴露在耐甲氧西林金黄色葡萄球菌培养物的3 μL上层清液中1 h。将样品以500g(g=9.8 m·s-²)加速度离心5 min,使用Promega测定法测定从血小板释放到培养基中的乳酸脱氢酶(LDH)。
2.7.血小板杀菌能力测定
为了评估分离血小板对细菌的杀灭作用,首先在室温下用1.0 mg·mL-1的血小板膜包覆纳米颗粒或空白对照对血小板进行预处理30 min,然后经10 μL耐甲氧西林金黄色葡萄球菌感染,感染复数MOI=0.1(平均每个血小板感染0.1个细菌),时长为1 h。为了计数菌落形成单位并计算耐甲氧西林金黄色葡萄球菌的死亡率,同时与原始接种物进行对比,实验采用Sonic Dismembrator 550(赛默飞世尔科技,美国)对稀释板进行3 s的超声处理。
2.8.血小板活化测定
在Todd-Hewitt液体培养基中过夜培养细菌(温度为37℃),然后以4000 r·min-1的速度离心分离15 min,得到耐甲氧西林金黄色葡萄球菌上清液。接下来,采用血小板膜包覆纳米颗粒或者空白对照对1.25~2.5 μL耐甲氧西林金黄色葡萄球菌上清液进行预混和,然后用其处理1×107个血小板。在37℃下行培养一段时间后,用藻红蛋白(PE)抗人体CD62p(P-选择素)抗体(Biolegend,美国)在室温下对样本染色20 min,然后用1 mL磷酸盐缓冲盐水稀释。分别采用FACSCalibur流式细胞术(BD Biosciences,美国)和FlowJo v10.2软件(Becton,Dickinson and Company,美国)对P-选择素的表达进行测量和分析。根据尺寸大小将人体血小板和血小板膜包覆纳米颗粒分离出来,然后用人体血小板进行藻红蛋白的平均荧光分析。
2.9.巨噬细胞的制备及细胞存活率测定
在RPMI+10%胎牛血清(FBS)中培养人髓系白血病单核细胞(THP-1)(American Type Culture Collection,美国)。采用25 nmol·L-1佛波醇12-十四酸酯13-乙酸酯(phorbol 12-myristate 13-acetate,PMA; Sigma-Aldrich,美国)将人髓系白血病单核细胞分化成巨噬细胞,然后在RPMI+10%胎牛血清中冷却24 h。为了测定细胞毒性,每孔接种5×105个人髓系白血病单核细胞,并在室温下用1 mg·mL-1血小板膜包覆纳米颗粒或空白对照进行30 min的预处理,然后暴露在耐甲氧西林金黄色葡萄球菌上清液(1.25~10.00 μL)中,时长为1 h,温度为37℃。采用3-(4,5-二甲基-2-噻唑基)-2,5-二苯基四氮唑溴盐(MTT)细胞增殖检测试剂盒(ab211091;Abcam plc.,美国)对人髓系白血病单核细胞及其分化的巨噬细胞的存活率进行测定,通过在590 nm处的吸光度来量化MTT向甲瓒的三磷酸腺苷(ATP)转化。
2.10.巨噬细胞杀菌能力测定
在人髓系白血病单核细胞分化的巨噬细胞杀菌能力测定中,将分化的巨噬细胞用1 mg·mL-1血小板膜包覆纳米颗粒或空白对照处理30 min,然后感染耐甲氧西林金黄色葡萄球菌,感染复数MOI=1.0。采用Triton X-100(0.025%;Sigma-Aldrich,美国)溶解细胞,并连续稀释以便计数菌落形成单位和计算耐甲氧西林金黄色葡萄球菌的死亡率,同时与原始接种物进行对比。
2.11.巨噬细胞的氧化迸发以及一氧化氮生成测定
在氧化迸发测定中,人髓系白血病单核细胞分化的巨噬细胞负载了25 μmol·L-12,7-二氯荧光素二乙酸酯(DCFH-DA;赛默飞世尔科技,美国),在不含Ca2+和Mg2+的Hanks平衡盐溶液中(HBSS;Mediatech,美国),在室温下旋转30 min。然后用有或没有血小板膜包覆纳米颗粒的耐甲氧西林金黄色葡萄球菌(MOI=1.0)感染巨噬细胞,并在37℃下培育。每隔15~30 min,用Spectra-Max M3(Molecular Devices,美国)对比485 nm激发/520 nm发射的荧光强度。为了量化在相同的暴露条件下人髓系白血病单核细胞分化巨噬细胞产生的亚硝酸盐,实验采用了符合制造商方案的Greiss试剂(Promega,美国)。
2.12.人类中性粒细胞胞外杀菌网络的染色和量化
从由健康成人供体采集的血液中分离中性粒细胞,根据制造商的说明,采用的分离液是PolymorphPrep分离液(Progen Biotechnik GmbH,德国)。接下来,将5×105个中性粒细胞置于24孔板的孔中,采用空白对照、25 nmol·L-1的佛波醇12-十四酸酯13-乙酸酯、耐甲氧西林金黄色葡萄球菌或与血小板膜包覆纳米颗粒预混合的耐甲氧西林金黄色葡萄球菌刺激20 min(MOI=10,平均每个中性粒细胞感染10个细菌),并在37℃下培育3 h。为了便于观察,采用磷酸盐缓冲盐水+2%牛血清白蛋白(BSA;Sigma-Aldrich,美国)中的抗髓过氧化物酶抗体(MPO)(1∶300;Calbiochem,美国)对固定在4%多聚甲醛中的细胞进行染色,时长为1 h,然后放入Alexa Fluor 488山羊抗兔试剂盒(1∶500;Life Technologies,美国)中染色45 min,最后,在2%磷酸盐缓冲盐水-牛血清蛋白稀释的1 μmol·L-1Hoechst-3342-三盐酸盐中复染10 min,接着在荧光显微镜下观察成像。同时,采用Quant-iTTM Pico-Green dsDNA检测试剂盒(Invitrogen,USA)对中性粒细胞胞外杀菌网络(NET)进行定量,此试剂盒加入了微球菌核酸酶溶液以便将中性粒细胞胞外杀菌网络的DNA释放到上清液中。向溶液中加入500 mmol·L-1乙二胺四乙酸终止微球菌核酸酶反应。根据制造商的说明制备了PicoGreen溶液并培育5 min,然后用480 nm激发/520 nm发射的过滤器测量荧光信号。
2.13.细胞因子量化测定
根据制造商的方案,实验采用酶联免疫吸附试验(ELISA)试剂盒(R&D systems,美国),选取已感染的人髓系白血病单核细胞,在其分化的巨噬细胞上清液中定量细胞因子白细胞介素(IL)-8和IL-1β。实验重复进行三次或四次。
2.14.活体小鼠体内感染金黄色葡萄球菌实验
在存活率研究中,耐甲氧西林金黄色葡萄球菌培养物在Todd-Hewitt液体培养基中生长至对数中期,并在磷酸盐缓冲盐水中洗涤一次。接下来,将3×108菌落形成单位通过腹腔(i.p.)注射到远系繁殖的10~12周龄的CD1小鼠(Charles River,美国)的腹膜内。在血小板膜包覆纳米颗粒组中,在小鼠感染耐甲氧西林金黄色葡萄球菌后,立即通过静脉注射一次100 μL的5 mg·mL-1血小板膜包覆纳米颗粒,3 h后再注射一次。监测每日存活率,共持续监测6 d。在单独实验中,采用相同的耐甲氧西林金黄色葡萄球菌剂量和血小板膜包覆纳米颗粒处理方案,在小鼠死亡6 h后,测定细菌菌落形成单位,并定量测定血清、脾脏中的肿瘤坏死因子(TNF)和白细胞介素-6(IL-6)。
2.15.统计分析
所有实验都重复进行两次或三次,最少独立重复两次。所有数据均以平均值的标准平均误差(SEM)或标准偏差(SD)表示。采用单向方差分析(ANOVA)或t检验(Graph Pad Prism 5.03)进行统计评估(*:P<0.05;**:P<0.01;***:P<0.001)。
2.16.符合伦理原则
动物实验研究遵守了加利福尼亚大学圣迭戈分校动物保护和管理委员会协议(IACUC,协议S00227M)。在实验过程中尽一切努力减少实验动物使用量并尽力减少实验给动物带来的痛苦。血小板分离所需要的血液是通过静脉穿刺从健康志愿者身上获得的,并经过了加利福尼亚大学圣迭戈分校人类研究保护项目(Human Research Protection Program)的批准。
3.结论
3.1.血小板膜包覆纳米颗粒的制备和分析
本研究的目标是构建一种血小板膜包覆纳米颗粒。这种血小板膜包覆纳米颗粒由天然血小板双层膜包裹的聚乳酸-羟基乙酸共聚物核组成。采用血小板膜壳模拟母体血小板的表面,吸收不同分子结构的耐甲氧西林金黄色葡萄球菌的毒素因子,从而降低毒性并保持血小板对耐甲氧西林金黄色葡萄球菌的抵御能力[图1(a)]。细胞膜来自血库中刚过期(<24~48 h)的血小板浓缩物,这种血小板浓缩物通过低渗裂解、机械破碎和差速离心得到,其细胞膜保留了膜成分和相应的功能[38]。选择乙二胺四乙酸作为抗凝剂,以螯合二价阳离子(如钙离子),并在稳定处理血小板的同时避免激活凝血过程[38]。此外,添加了蛋白酶抑制剂以防止血小板聚集[38]。超声处理产生了膜囊泡,膜囊泡融合聚乳酸-羟基乙酸共聚物核得到最终的血小板膜包覆纳米颗粒。聚合物内芯可稳定外膜,防止其破碎或与其他膜融合,从而优化体外和体内的稳定性。进行膜包覆后,经动态光散射测量,血小板膜包覆纳米颗粒的直径从(88.4±5.6)nm增加到(120.0±4.8)nm,这反映了聚合物核被细胞膜双层包裹[图1(b)、(c)]。透射电子显微镜清楚地显示聚乳酸-羟基乙酸共聚物核被单层膜均匀包覆,表明血小板膜包覆纳米颗粒形成[图1(d)]。
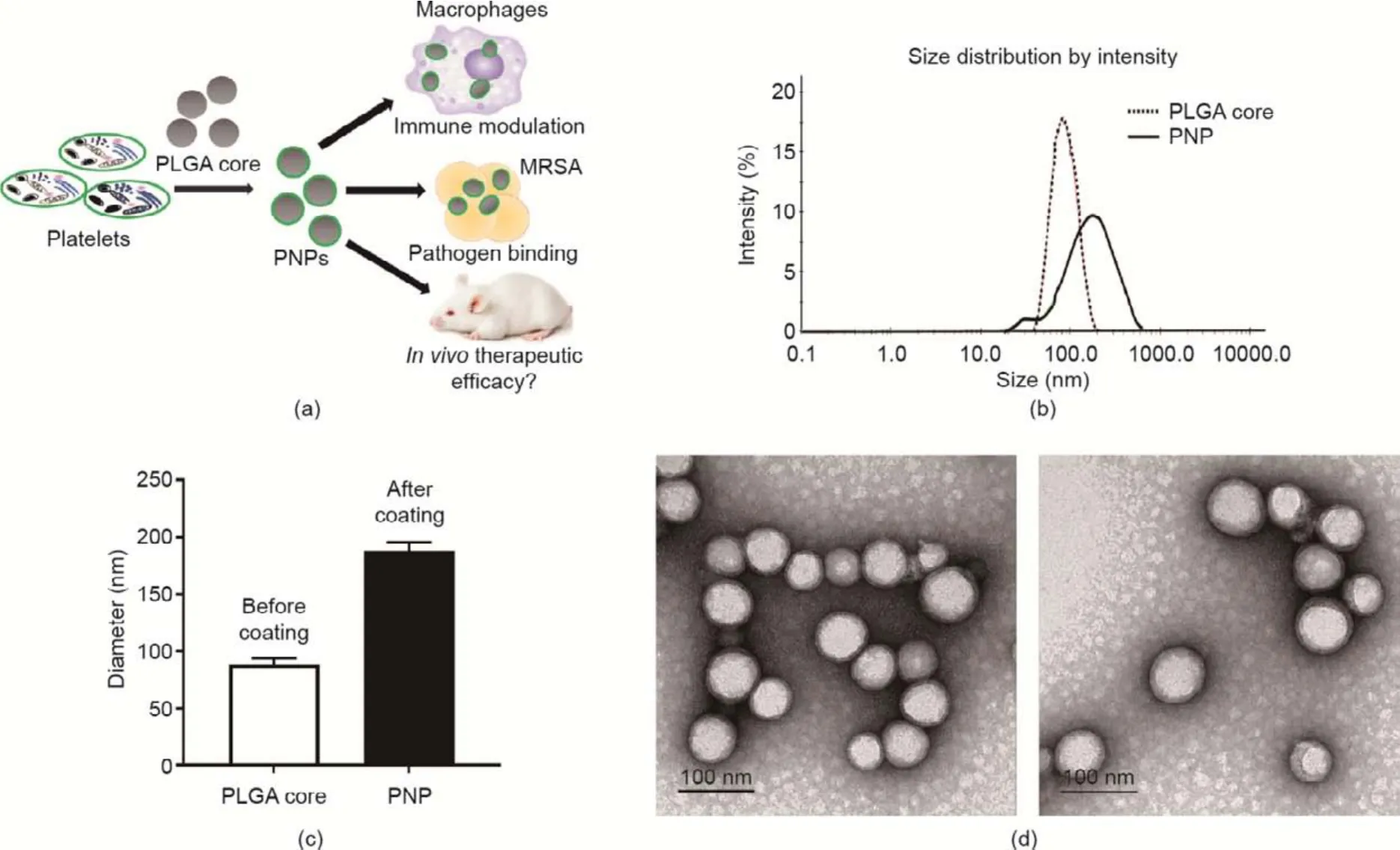
图1.血小板膜包覆纳米颗粒的配方和分析。(a)模型展示了应用血小板膜包覆纳米颗粒调节免疫细胞、结合病原体和控制体内治疗效果的基本原理;(b)、(c)采用动态光散射来测量血小板膜包覆前后的聚乳酸-羟基乙酸共聚物核的流体动力学尺寸(直径单位为nm);(d)展示了用醋酸双氧铀复染剂获得的血小板膜包覆纳米颗粒的透射电子显微镜图像。
3.2.血小板膜包覆纳米颗粒防止耐甲氧西林金黄色葡萄球菌上清液引起的人体血小板损伤和功能障碍
细菌毒素,如金黄色葡萄球菌α-毒素可以损害和抑制宿主细胞的功能[35,39]。本文首先研究了血小板膜包覆纳米颗粒是否可以保护人体血小板,让其免受耐甲氧西林金黄色葡萄球菌上清液的细胞毒性的损害。将人体血小板与耐甲氧西林金黄色葡萄球菌上清液一起培育1 h后,实验观察到有大量的乳酸脱氢酶释放,血小板受到损伤;然而,血小板膜包覆纳米颗粒可以让这种情况显著好转:耐甲氧西林金黄色葡萄球菌上清液中乳酸脱氢酶的释放量为0.52±0.13(光密度值),而经过血小板膜包覆纳米颗粒处理的释放量为0.27±0.08(光密度值)(P=0.002)[图2(a)]。与释放富含抗菌肽的α颗粒[2]相关的血小板活化可以采用P-选择素的表面表达进行量化。将人体血小板暴露于耐甲氧西林金黄色葡萄球菌上清液后,实验发现与血小板膜包覆纳米颗粒一起培育可以显著减少P-选择素的表达时间,并大大增加其表达强度[图2(b)、(c)]。这表明血小板膜包覆纳米颗粒有助于维持血小板关键的反应功能。为了研究血小板的细胞保护作用和功能激活作用是否可以改善机体的先天免疫活性,在血小板膜包覆纳米颗粒存在和缺失的两种情况下评估了血小板对耐甲氧西林金黄色葡萄球菌的杀灭能力。经过血小板膜包覆纳米颗粒处理后,血小板杀灭耐甲氧西林金黄色葡萄球菌的能力显著增强[图2(d)、(e)],表明血小板膜包覆纳米颗粒可以保护血小板,减轻耐甲氧西林金黄色葡萄球菌对血小板的损伤,这种保护作用可能会改善宿主的防御功能。
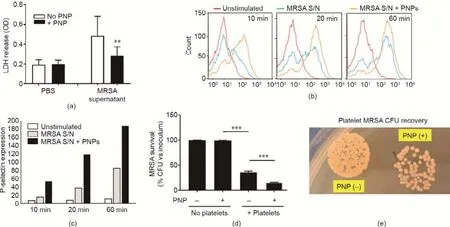
图2.血小板膜包覆纳米颗粒可预防由耐甲氧西林金黄色葡萄球菌上清液引起的人体血小板损伤和功能障碍。(a)采用光密度值测定的乳酸脱氢酶释放量显示血小板膜包覆纳米颗粒可降低耐甲氧西林金黄色葡萄球菌上清液诱导的血小板细胞毒性,耐甲氧西林金黄色葡萄球菌上清液中乳酸脱氢酶的释放量为0.52±0.13(光密度值),而经过血小板膜包覆纳米颗粒处理的释放量为0.27±0.08(光密度值)(P=0.002)。(b)、(c)在血小板膜包覆纳米颗粒存在和不存在的两种情况下,暴露于耐甲氧西林金黄色葡萄球菌上清液的血小板的P-选择素表达。经过血小板膜包覆纳米颗粒处理后,P-选择素的表达从早期时间点(10 min)开始显著增加。(d)、(e)经过血小板膜包覆纳米颗粒处理后,血小板活力增强,同时也提高了其杀灭耐甲氧西林金黄色葡萄球菌的能力。**:P<0.01;***:P<0.001。
3.3.血小板膜包覆纳米颗粒防止耐甲氧西林金黄色葡萄球菌上清液引起的人体巨噬细胞损伤和功能障碍
在预先或者不预先对耐甲氧西林金黄色葡萄球菌上清液与血小板膜包覆纳米颗粒进行培养30 min的两种情况下,检查了耐甲氧西林金黄色葡萄球菌上清液对人髓系白血病单核细胞活性产生的影响。如图3(a)所示,在血小板膜包覆纳米颗粒存在的情况下,乳酸脱氢酶的释放量减少了近75%。采用MTT法进一步测定细胞活力,结果显示,当耐甲氧西林金黄色葡萄球菌上清液与血小板膜包覆纳米颗粒进行预混合处理后,1 h后的人髓系白血病单核细胞的活力显著增强(与对照组相比)[图3(b)]。实验也测量了人髓系白血病单核细胞分化的巨噬细胞中乳酸脱氢酶的释放量,显示了血小板膜包覆纳米颗粒显著的保护作用[图3(c)]。最后,在存在或不存在血小板膜包覆纳米颗粒的两种情况下,用活体耐甲氧西林金黄色葡萄球菌感染人髓系白血病单核细胞分化的巨噬细胞,结果表明“纳米海绵”处理显著增强了巨噬细胞对病原体的杀灭能力[图3(d)]。

图3.血小板膜包覆纳米颗粒可预防耐甲氧西林金黄色葡萄球菌上清液引起的人体巨噬细胞损伤和功能障碍。(a)乳酸脱氢酶细胞毒性测试;(b)MTT试验表明,血小板膜包覆纳米颗粒处理使人髓系白血病单核细胞的毒性降低了约75%;(c)血小板膜包覆纳米颗粒还提高了经过耐甲氧西林金黄色葡萄球菌上清液处理后的人髓系白血病单核细胞分化巨噬细胞的活力;(d)不管细菌载量和培育时间如何,用血小板膜包覆纳米颗粒预处理过的人髓系白血病单核细胞分化的巨噬细胞都具有更高的杀菌效率。*:P<0.05;**:P<0.01;***:P<0.001。
3.4.血小板膜包覆纳米颗粒对抗细胞毒性可维持巨噬细胞和中性粒细胞的效应反应
本研究进一步检查了血小板膜包覆纳米颗粒对参与抗菌反应的巨噬细胞的某些关键功能产生的影响。活性氧(ROS)的产生,即氧化迸发,是巨噬细胞抗菌防御的关键因素,这一观点得到了证实,实验证明患有烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶缺乏症(慢性肉芽肿病),氧化迸发功能受损的患者感染金黄色葡萄球菌的概率较高[40]。为了应对耐甲氧西林金黄色葡萄球菌,血小板膜包覆纳米颗粒增加了人髓系白血病单核细胞(THP-1)分化巨噬细胞活性氧的产生量[图4(a)]。诱导型一氧化氮合酶(iNOS)产生的一氧化氮也有助于抗菌防御,这一观点得到了实验证实,实验证明缺少诱导型一氧化氮合酶的小鼠感染金黄色葡萄球菌的情况更严重[41]。为了应对耐甲氧西林金黄色葡萄球菌,血小板膜包覆纳米颗粒也同样促进人髓系白血病单核细胞分化的巨噬细胞产生一氧化氮[图4(b)]。金黄色葡萄球菌感染诱导巨噬细胞焦亡,这种细胞死亡过程依赖炎症小体激活并与IL-1β的释放相关联[42]。在实验早期,IL-1β的产生量有所减少[图4(c)];一致地是,细胞毒性测定中乳酸盐脱氢酶(LDH)的释放量也有减少[图3(a)],这表明细胞焦亡是巨噬细胞对金黄色葡萄球菌攻击产生的反应,并且血小板膜包覆纳米颗粒吸收毒素,在一定程度上可以减轻相关细胞毒性和细胞因子的释放。血小板表达IL-1β受体(IL-1R)[43],因此用血小板膜包覆纳米颗粒隔绝IL-1β细胞因子可能有助于观察到差异。最后,金黄色葡萄球菌毒素[44-45]和活化的血小板[46]也会引起中性粒细胞胞外杀菌网络(NET),这可能会有促炎和促凝血作用,导致加重败血症[47]或心内膜炎[48]。通过免疫染色观察和Picogreen定量检测释放的DNA,发现血小板膜包覆纳米颗粒显著抑制了耐甲氧西林金黄色葡萄球菌诱导的由体外人中性粒细胞组成的中性粒细胞胞外杀菌网络的形成[图4(d)、(e)]。

图4.血小板膜包覆纳米颗粒对巨噬细胞活化和中性粒细胞杀菌机制的影响。(a)对超氧化物的生成进行DCFH-DA测定,可知血小板膜包覆纳米颗粒会增加巨噬细胞的氧化迸发;(b)在血小板膜包覆纳米颗粒处理的巨噬细胞中观察到亚硝酸盐的产生量增加,亚硝酸盐的生成量反映了一氧化氮的生成量;(c)在血小板膜包覆纳米颗粒处理的巨噬细胞中,最早时间点(第4 h)处细胞因子IL-1β的产生量减少;(d)在存在或不存在血小板膜包覆纳米颗粒情况下,由耐甲氧西林金黄色葡萄球菌引发的人类中性粒细胞胞外杀菌网络的免疫染色,PMA作为阳性对照;(e)采用PicoGreen测定对中性粒细胞胞外杀菌网络进行定量分析。*:P<0.05;**:P<0.01;***:P<0.001。
3.5.血小板膜包覆纳米颗粒可提高系统性感染耐甲氧西林金黄色葡萄球菌小鼠的存活率
上述体外研究表明,血小板膜包覆纳米颗粒可以阻断耐甲氧西林金黄色葡萄球菌诱导的血小板和巨噬细胞的细胞毒性,增强两种细胞类型的抗菌能力。这些发现表明血小板膜包覆纳米颗粒有潜在的治疗体内金黄色葡萄球菌感染的作用。在先前用于药代动力学和生物分布评估的啮齿动物静脉注射研究中,超过90%的血小板膜包覆纳米颗粒可以在30 min内分布到组织内,尤其是肝脏和脾脏[38]。重要的是,先前在非感染性适应症小鼠模型中使用血小板膜包覆纳米颗粒时未出现凝血异常,如免疫性血小板减少症[49]和动脉粥样硬化[50]等症状。8只小鼠为一组,准备100 μL的腹腔内注射液(含3×108菌落形成单位的耐甲氧西林金黄色葡萄球菌),通过腹腔注射到小鼠体内诱发系统性感染。在加入血小板膜包覆纳米颗粒的实验组中,在小鼠感染耐甲氧西林金黄色葡萄球菌后,立即将5 mg·mL-1血小板膜包覆纳米颗粒直接注射到血流中,经过3 h后再次注射[图5(a)]。注射两次的目标是提供一个适度扩展的治疗覆盖窗口,寻求减轻病原体介导的毒性损伤的方法,防止细胞因子风暴的传播,并防止因败血症引起的早期死亡。经过血小板膜包覆纳米颗粒处理的小鼠的存活率显著提高,在没有接受抗生素治疗的情况下,仍有37.5%的小鼠存活了5天,而对照组中的所有小鼠都在前48 h内死亡[图5(b)]。在处理条件相同的一个单独实验中,在感染耐甲氧西林金黄色葡萄球菌6 h后收集血液,确定细菌菌落形成单位和血清细胞因子的水平。血液中耐甲氧西林金黄色葡萄球菌的菌落形成单位显著降低(P=0.036),这与注射两剂血小板膜包覆纳米颗粒相关[图5(c)、(d)];脾脏计数出现减少的趋势,但程度轻微未达到统计学意义。与对照组相比,血小板膜包覆纳米颗粒组中血清白细胞介素6对抗耐甲氧西林金黄色葡萄球菌的水平也有所降低[图5(e)]。
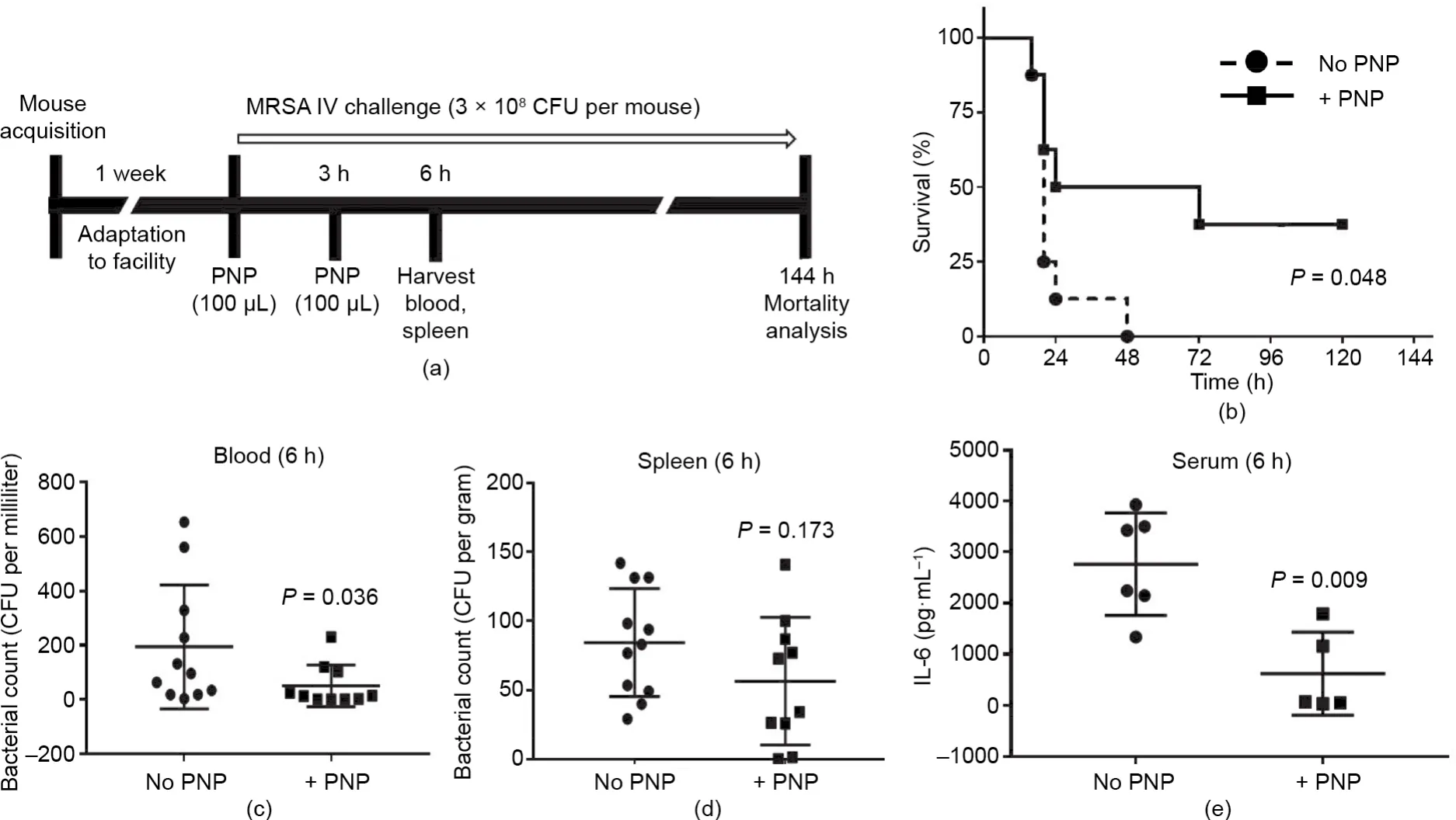
图5.血小板膜包覆纳米颗粒可提高系统性感染耐甲氧西林金黄色葡萄球菌小鼠的存活率。(a)体内实验设置的示意图。(b)在小鼠腹腔内注射耐甲氧西林金黄色葡萄球菌(每只小鼠注射3×108菌落形成单位)144 h后小鼠的存活率。接种细菌后立即注射100 μg 5 mg·mL-1的血小板膜包覆纳米颗粒,3 h后再注射一次(每组n=8)。血小板膜包覆纳米颗粒具有显著提高存活率的优点。(c)~(e)在血小板膜包覆纳米颗粒处理实验中,血液、脾脏和血清的杀灭细菌能力得到增强。
4.讨论
本研究证明了血小板膜包覆纳米颗粒可用于治疗系统性感染耐甲氧西林金黄色葡萄球菌的原理。这种益处很有可能是多方面的,包括:①减少与毒素相关的血小板损伤,从而更快速有效地发挥血小板的抗菌活性;②保护巨噬细胞免受耐甲氧西林金黄色葡萄球菌的溶解损伤,从而使巨噬细胞更有效地调配活性氧和一氧化氮,实现有效杀菌;③隔离血小板膜中的某些细菌毒素(如成孔毒素)。此外,因为血小板表达Toll样受体(如TLR2)和细胞因子受体(如IL-1R),所以它可以清除促炎细菌细胞壁成分和细胞因子以调节败血症引发的过度炎症。后一种机制与巨噬细胞膜包覆纳米粒子的体内治疗效果相似,在感染细菌脂多糖内毒素血症和大肠杆菌败血症的小鼠模型中,可以阻挡两种疾病带来的致命伤害[34]。虽然先前的研究表明红血球“纳米海绵”可以保护小鼠免受来自金黄色葡萄球菌上清液中分泌蛋白制剂引起的致命伤害[31],但是目前的血小板膜包覆纳米颗粒研究是第一份关于仿生膜包覆纳米颗粒治疗活体金黄色葡萄球菌系统性感染的报告。
最近的一项研究表明,全世界因败血症引发的人类死亡率高达19.7%[51],但是目前仍然没有专门批准的药物治疗败血症[52]。抗生素耐药性细菌菌株(如耐甲氧西林金黄色葡萄球菌)的种类和数量不断增加,这让有效治疗败血症变得更加困难[53]。在此背景下,与单克隆抗体方法或其他针对单个毒素或宿主炎症因子的特殊分子结构的方法相比,由血小板膜包覆纳米颗粒或由其他细胞膜包覆“纳米海绵”是一种治疗败血症更“通用”的方法。其他研究结果也证明了血小板膜包覆纳米颗粒具有高效的治疗能力。例如,有证据表明血小板膜包覆纳米颗粒可减少巨噬细胞的细胞吞噬,同时不会在自体血浆中诱导人类补体激活;它们可以有选择性地与人类和啮齿动物受损的血管内皮细胞结合,同样也能与血小板黏附型病原体结合[31],这可能有利于它们在血管内感染了金黄色葡萄球菌的常见部位积聚。
总之,本研究表明,血小板膜包覆纳米颗粒可以保护感染系统性耐甲氧西林金黄色葡萄球菌的血小板,期间通过吸收循环毒素来减小血小板受到的损伤、延长血小板的存活时间、加快血小板的激活速度、增强血小板杀菌能力。血小板膜包覆纳米颗粒还可以保护和支持巨噬细胞的先天免疫功能。这种仿生解毒策略作为一种辅助疗法值得进一步探索,以改善感染耐甲氧西林金黄色葡萄球菌患者的临床状况,为当前的临床管理方法扩展了一条新途径。
5.研究局限性
系统性感染耐甲氧西林金黄色葡萄球菌的小鼠研究不能完全代替人类感染的机理,因为小鼠对病原体具有相对抵抗力,并且需要非常高的剂量才能引起器官衰竭和死亡风险。此外,对于疑似败血症患者,需要进行快速的临床干预——通常是在确认病原体微生物学之前——并且患者可能患有一种或多种并存病,增加了发生负面结果的风险。因此,“纳米海绵”疗法被视为是护理标准的补充。
Acknowledgements
This work was supported by National Institutes of Health grants HL125352 and U01AI124316(VN).
Compliance with ethics guidelines
Jwa-Kyung Kim,Satoshi Uchiyama,Hua Gong,Alexandra Stream,Liangfang Zhang,and Victor Nizet declare that they have no conflict of interest or financial conflicts to disclose.
