噬菌体随机肽库筛选HPV45亚型L1蛋白抗原表位
2022-01-22彭亚允陈玉梅周景明刘红亮祁艳华丁培阳朱习芳王爱萍
彭亚允, 栗 宁, 陈玉梅, 周景明, 刘红亮, 祁艳华, 梁 超, 丁培阳, 朱习芳, 王爱萍
(郑州大学 生命科学学院 河南 郑州 450001)
0 引言
宫颈癌是世界上女性常见的癌症之一,现已证实高危型人乳头瘤病毒的持续感染是宫颈癌的主要病因。在大多数发展中国家,女性癌症患者总数中有25%为宫颈癌患者[1]。随着生物技术和检测方法的发展,已经有300多种HPV亚型被鉴定,已明确的高危亚型有12种,而HPV45属于高危亚型之一,与宫颈癌的发生密切相关[2]。L1蛋白是HPV病毒衣壳的主要结构蛋白,可组装形成72个五聚体[3]。L2蛋白是次要结构蛋白,它与病毒基因组DNA和L1蛋白都密切相关。L1蛋白在体外可以自组装成病毒样颗粒(VLPs),其外观与天然病毒颗粒相似[4-5]。这些VLPs已被证明具有高度免疫原性,并在开发预防性疫苗中起重要作用[6-7]。L1蛋白含有多个抗原表位,而表位是可以诱导人体产生细胞免疫应答和体液免疫应答的基本单位,此外,它还是抗原特异性结合相应抗体的部位。
通过单克隆抗体或多抗血清确定HPV L1蛋白的表位研究有很多,比如基于假病毒中和实验筛选中和表位(pseudovirion-based neutralization assay,PBNA)[8],L1蛋白重叠多肽免疫血清筛选鉴定B细胞表位[3]等;另外还有基于噬菌体肽库获得模拟表位的研究[9]。噬菌体展示技术,也称为体外选择技术,是一种将肽或蛋白质与噬菌体外壳蛋白结合并在噬菌体表面展示的生物技术[10]。噬菌体展示技术是蛋白质-蛋白质相互作用研究的关键工具,可用于筛选靶向单克隆抗体的抗原模拟表位,并且通过这种方法筛选表位更加简单[11-12]。但是很少有人使用噬菌体展示技术筛选HPV45 L1蛋白的表位。本研究成功制备了抗HPV45 L1蛋白的单克隆抗体,使用噬菌体随机十二肽库筛选,并通过Dot-ELISA和间接竞争ELISA鉴定了单克隆抗体识别的HPV45 L1蛋白的线性表位,为进一步研究HPV45 L1蛋白的结构和功能提供帮助。
1 材料和方法
1.1 菌株、试剂、细胞和噬菌体肽库
SUMO-HPV45 L1-BL21(DE3)原核表达菌株和SP2/0骨髓瘤细胞由郑州大学生命科学学院分子免疫学实验室保存;p45Shell假病毒制备质粒由Prof. John T. Schiller惠赠;Ph.D.-12TM噬菌体展示肽库试剂盒和大肠杆菌ER2738购自New England BioLabs;RPMI Medium 1640、HAT Supplement从Gibco购买;辣根过氧化物酶偶联的山羊抗小鼠IgG(HRP-goat anti mouse IgG)、抗His单克隆抗体购自Abbkine;X-gal,PEG 8000、四环素购自Solarbio。
1.2 重组L1蛋白的表达、纯化及鉴定
BL21(DE3)-SUMO-HPV45 L1重组表达菌株以1∶1 000的比例接种在含有氨苄抗生素的LB液体培养基中,37 ℃培养过夜。次日,将1 mL过夜培养物添加到100 mL LB培养基中,37 ℃培养至OD600为0.6~0.8,加入0.1 mmol/L异丙基-β-D-硫代半乳糖苷(Isopropyl-β-D-thiogalactoside, IPTG),在16 ℃恒温培养12 h后,离心收集细菌培养物,使用磷酸盐缓冲液重悬。用超声破碎仪裂解菌体,12 000 r/min离心15 min,收集可溶性重组L1蛋白,使用Ni-NTA亲和层析方法对蛋白进行纯化,通过12% SDS-PAGE,Western-blot鉴定纯化的L1蛋白,并通过血凝实验(hemagglutination test, HA)鉴定重组蛋白活性。其中western-blot鉴定时一抗选用的是1∶5 000稀释的抗-His单抗。HA鉴定:SUMO-45 L1连续用PBS进行2倍连续倍比稀释,从1∶2、1∶4、1∶8至1∶512,以PBS作为阴性对照。将50 μL的0.8%小鼠红细胞悬液添加到每个孔中,并将反应板放置2 h,观察重组蛋白的血凝活性。
1.3 单克隆抗体的制备与鉴定
使用纯化的SUMO-45L1蛋白(40 μg)与弗氏佐剂混合(体积比1∶1)免疫Balb/c小鼠,细胞融合前三天,使用纯化的SUMO-45L1蛋白(40 μg)对小鼠尾静脉注射进行一次超强免疫。使用聚乙二醇以8∶1的比例将脾细胞与SP2/0骨髓瘤细胞进行融合,通过酶联免疫吸附实验(Enzyme-linked immunosorbent assay,ELISA)筛选阳性杂交瘤细胞株,通过有限稀释法亚克隆。三轮亚克隆后获得了稳定分泌抗L1蛋白单克隆抗体的杂交瘤细胞株,制备单抗腹水,并通过辛酸硫酸铵法纯化。
1.3.1单克隆细胞株的ELISA筛选方法 将SUMO-45 L1蛋白用CBS(pH 9.6)稀释到4 μg/mL,以50 μL/孔的量包被96孔酶标板;用5%猪血清37 ℃封闭2 h;将50 μL待测样品添加到每个孔中,37 ℃孵育1 h,洗涤3次;1∶5 000稀释的HRP-goat anti mouse IgG作为二抗,37 ℃孵育1 h,洗涤6次,3、3′、5、5′-四甲基联苯胺底物显色10 min,加入2 mol/L H2SO4终止反应,酶标仪读取OD450值。筛选过程中将重组表达的含pESUMO空载的超声上清(含SUMO-tag)作为包被原同步进行ELISA检测,并作为平行对照,排除非特异反应。
1.3.2免疫荧光实验(IFA) 将293T细胞培养在96孔板中,当细胞密度达到70%时,依照jetPRIME®转染试剂说明书进行转染。选用HPV假病毒制备的质粒p45shell和pcDNA3.1-GFP转染293T细胞,48 h后,用预冷的甲醇将细胞固定20 min,晾干后用PBS洗涤3次。将纯化后的单抗3C11用PBS以1∶100稀释后加入到细胞孔中,使用未免疫的小鼠血清作为阴性对照,在37 ℃孵育1 h,PBS洗涤3次,将FITC-羊抗鼠抗体用PBS以1∶100的比例加入上述孔中,37 ℃孵育1 h。PBS洗涤5次,通过荧光倒置显微镜观察细胞。
1.3.3ELISA鉴定单抗与HPV-18、31、53、58 L1蛋白的反应性 HPV-18、31、53、58 L1蛋白由我们实验室制备。用碳酸盐缓冲液(pH为9.6)将纯化的HPV-18、31、53、58 L1蛋白稀释至4 μg/mL,加入酶标孔中,37 ℃孵育3 h,PBST洗涤后加入5%的猪血清于4 ℃封闭过夜。将单抗上清用PBS进行稀释,以50 μL/孔加入到酶标板中,37 ℃孵育1 h。PBST洗涤5次,将HRP标记的羊抗鼠IgG以1∶5 000进行稀释,每孔50 μL,37℃孵育1 h。PBST洗涤后加入3、3′、5、5′-四甲基联苯胺过氧化物酶底物,显色10 min后,加入2 mol/L硫酸终止反应,用酶标仪检测各待检孔的OD450值。
1.4 从随机噬菌体展示12肽库进行生物淘选
使用噬菌体随机十二肽库来淘选与抗L1蛋白单克隆抗体结合的噬菌体。在第一轮生物淘选中,将单抗3C11用NaHCO3缓冲液稀释至终浓度为100 μg/mL,4 ℃包被过夜。次日,TBST(TBST:含0.1% Tween-20的TBS;TBS:50 mmol/L Tris-HCl,150 mmol/L NaCl,pH 7.5)洗涤3次后,将封闭缓冲液(0.1 mol/L NaHCO3、5 mg/mL BSA,0.02% NaN3,pH8.6)加入孔中,37 ℃孵育2 h,洗涤6次后,用TBST将噬菌体稀释为2×1011pfu/mL,每孔100 μL,37 ℃孵育1 h。TBST洗涤10次,加入洗脱缓冲液(Glycin-HCl,0.2 mol/L,pH2.2),置于室温2 h,然后加入15 μL中和缓冲液(Tris-HCl,pH 9.1)。取10 μL洗脱液进行滴度的测定,剩余的洗脱液用于扩增。在第二轮、第三轮生物淘选中,包被单抗的浓度分别为75 μg/mL、50 μg/mL。TBST中Tween-20的浓度分别为0.2%、0.3%。第三轮不需进行噬菌体的扩增,直接进行滴度的测定。
1.5 阳性噬菌体克隆的鉴定
从第三轮测定洗脱物滴度的平板上随机挑取20个噬菌体克隆,分别在大肠杆菌ER2738中扩增,然后通过间接ELISA进行鉴定。将单抗3C11用NaHCO3缓冲液稀释至浓度为10 μg/mL、4 ℃孵育过夜。次日,弃去包被液,PBST洗涤3次,加入5%脱脂奶,37 ℃封闭2 h。弃去封闭液,将挑取的噬菌体克隆以1∶400比例稀释加入孔中,37 ℃孵育1 h。PBST洗涤5次后,加入用脱脂奶以1∶5 000稀释的HRP标记的抗M13抗体,37 ℃孵育1 h。PBST洗涤后,加入3、3′、5、5′-四甲基联苯胺过氧化物酶底物,避光显色5 min后,加入2 mol/L硫酸终止反应,酶标仪测其OD450值。
1.6 DNA测序及肽的合成
将阳性噬菌体克隆送至金维智生物公司测序,使用DNASTAR软件,将测序结果与HPV45 L1蛋白序列通过NCBI(http:∥www.ncbi.nlm.nih.gov,No.AGU90648.1访问)进行比对。将与L1蛋白原始序列比对上的序列送至吉尔生物公司进行多肽的合成。
1.7 多肽与单抗的反应性鉴定
1.7.1Dot-ELISA 首先,通过戊二醛法将BSA和多肽连接。然后,将NC膜裁剪成长条状,吸取1 μL BSA-多肽溶液滴到NC膜上,用纯化的L1蛋白作为阳性对照,BSA溶液作为阴性对照,SUMO空载超声上清液为无关对照。将膜浸于5%脱脂奶中,在37 ℃封闭2 h,PBST洗涤3次,将膜浸于单抗3C11中,37 ℃孵育1 h,PBST洗膜5次。将膜与1∶5 000稀释的HRP标记的羊抗鼠IgG在37 ℃孵育1 h,洗涤后使用AEC试剂盒显色,并用蒸馏水终止反应。
1.7.2间接竞争ELISA 将L1蛋白用CBS缓冲液稀释至4 μg/mL,加入酶标孔中,37 ℃孵育3 h,弃去包被液,加入5%猪血清4 ℃封闭过夜。将合成肽用PBS倍比稀释(初始稀释度为1∶40)后与3C11混合,并加入到L1蛋白包被的孔中于37 ℃孵育1 h,其余步骤与上述ELISA方法。
1.8 生物信息学分析
从NCBI(http:∥www.ncbi.nlm.nih.gov)获得HPV45 L1蛋白的氨基酸序列(Genebank,No.AGU90648.1),然后用Robetta软件对HPV45 L1蛋白的3D结构模型进行建模,使用PYMOL软件显示筛序表位的空间分布。
2 结果
2.1 重组L1蛋白的表达、纯化与鉴定
诱导表达后通过SDS-PAGE分析重组SUMO45 L1蛋白的可溶性表达情况,如图1所示,结果发现SUMO45 L1蛋白主要以可溶性形式表达(图1a),通过Ni-NTA亲和层析柱纯化目的蛋白,SDS-PAGE结果表明纯化后目的蛋白条带单一,分子量约为75 KDa,纯度约90%(图1b)。Western-blot结果表明,纯化后的SUMO-45L1蛋白可以与抗His单抗发生反应(图1c)。将纯化的SUMO-45L1蛋白进行血凝实验,结果表明当重组L1蛋白稀释至1∶16时,仍能够使0.8%小鼠红细胞悬液完全凝集,稀释至1∶128时仍能使0.8%小鼠红细胞悬液发生凝集,表明纯化后的SUMO-45L1蛋白具有类似于天然病毒的血凝活性,可以使小鼠红细胞发生凝集(图1d)。

图1 重组蛋白的表达、纯化及血凝活性鉴定
2.2 单克隆抗体的制备及鉴定
用纯化后的L1蛋白免疫Balb/c小鼠,细胞融合后经过三轮亚克隆后,筛选出四株可以稳定分泌L1蛋白单克隆抗体的杂交瘤细胞株,分别命名为2F5、3B7、3C11、3G11。如表1所示,阳性对照NC为无关杂交瘤细胞株培养上清,M1~M10为培养上清稀释倍数,分别为1∶40,1∶80,…,1∶20 480。通过间接ELISA法测其效价,其中3C11效价最高,达1∶10 240以上。如表2所示通过ELISA鉴定单抗3C11与HPV-18、31、53、58 L1蛋白的交叉反应性,结果表明3C11仅与HPV45 L1蛋白发生特异性反应,而与HPV-18、31、53、58 L1蛋白均不发生反应。如图2所示进一步通过IFA实验鉴定单克隆抗体3C11,结果显示3C11与在293T细胞中瞬时表达的HPV45 L1蛋白具有良好的反应性,与阴性对照(NC,pcDNA3.1转染的293T细胞)不发生反应。

图2 抗HPV31 L1蛋白单克隆抗体的筛选与鉴定
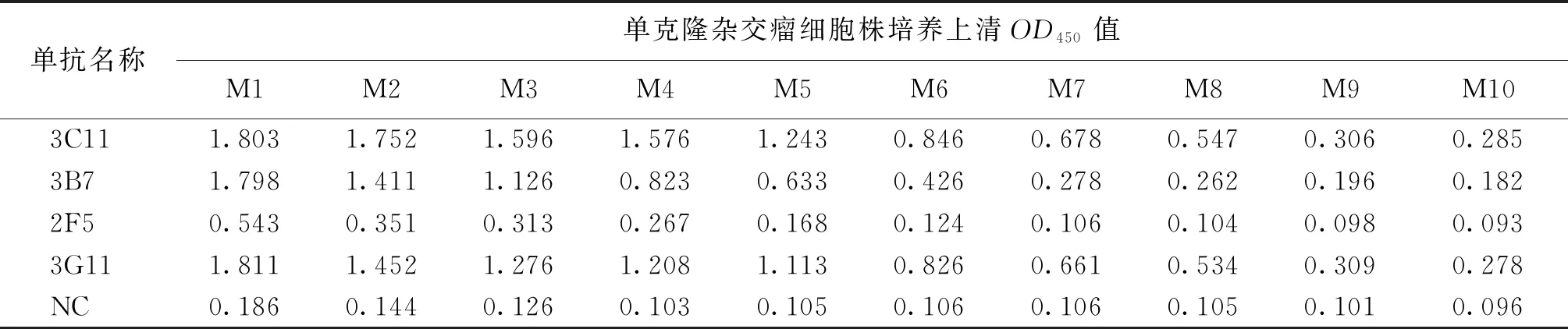
表1 ELISA测定单克隆杂交瘤细胞株培养上清的效价

表2 ELISA测定单抗3C11的特异性
2.3 噬菌体十二肽库的生物淘选和富集
如表3所示以纯化的单克隆抗体3C11为包被原,使用噬菌体十二肽库进行三轮生物淘选,经过三轮淘选后,其富集率比第一轮提高了5×103倍,并且在每一轮淘选后噬菌体量均有所增加,表明与3C11结合的噬菌体得到了良好的富集。

表3 噬菌体的富集情况
2.4 间接ELISA筛选阳性噬菌体克隆
如图3所示,x轴上1~20代表20个噬菌体克隆,原始肽库作为NC(阴性对照),PBS为空白对照(BC)。从第三轮测定洗脱物滴度的固体平板上随机选取了20个噬菌体克隆,间接ELISA结果显示有19个阳性克隆,其中12个噬菌体克隆可以与单抗3C11呈现强阳性反应。

图3 间接ELISA鉴定20个噬菌体克隆
2.5 阳性噬菌体克隆的测序与序列比对
将12个强阳性噬菌体克隆送至金维智生物公司进行测序。如表4所示,分析测序结果发现阳性克隆C5、C8、C9、C10、C14、C17具有相同的氨基酸序列,克隆C3、C6、C12、C15、C16、C19显示为不同的氨基酸序列。将上述氨基酸序列与 HPV45 L1蛋白的原始序列用DNASTAR中的MegAlign软件进行比对,发现这些克隆比对上的氨基酸与HPV45 L1蛋白的氨基酸序列“381VPNTYD386”相同,说明“381VPNTYD386”极可能为单抗3C11识别HPV45 L1蛋白的抗原表位。

表4 阳性噬菌体克隆所对应的氨基酸序列
2.6 表位肽的合成和鉴定
为了进一步鉴定筛选到的多肽381VPNTYD386,进行肽的合成并与载体BSA偶连,通过Dot-ELISA和间接竞争ELISA进行鉴定。如图4所示,Dot-ELISA结果表明,单抗3C11可以与BSA偶连的多肽及HPV 45 L1 蛋白全长发生反应,而与阴性对照载体蛋白BSA和无关对照SUMO-tag均不反应。间接竞争ELISA结果表明,该BSA偶连的多肽可以抑制3C11与L1蛋白的结合,且随着多肽浓度的升高,OD450值越低,表明抑制率越高。该结果表明381VPNTYD386为单抗3C11识别HPV45 L1蛋白的抗原表位。

图4 多肽与单抗反应性的Dot-ELISA和间接竞争ELISA鉴定
2.7 生物信息学分析抗原表位的定位
Robetta软件进行HPV45 L1蛋白的3D结构建模,如图5(a)所示(http:∥new.robetta.org/results.php?id=30879),通过PYMOL软件对表位“381VPNTYD386”的空间分布进行分析,如图5(b)中红色所示。

图5 HPV45 L1蛋白的同源建模及表位定位分析
3 讨论
抗原表位的筛选鉴定方法有许多,例如,噬菌体展示的随机肽库,免疫学实验和软件预测等是最常见的方法[12-13]。单克隆抗体是用于绘制病毒蛋白抗原表位的有用工具[14],可以用单克隆抗体从噬菌体展示的随机肽库中淘选模拟抗原线性或不连续的表位[15],与其他筛选表位的方法相比,噬菌体展示技术更简单、更快、更方便[16]。
目前许多研究使用噬菌体展示技术来获得模拟表位,但是很少有报道使用噬菌体展示技术筛选HPV45 L1蛋白的表位,不过有研究者使用其他的方法来预测抗原的表位。Ghorban等通过使用BCPREDS服务器预测了HPV45 L1蛋白的表位位于74~93 aa、127~146 aa、165~184 aa、198~217 aa、314~333 aa、336~355 aa、375~394 aa、425~444 aa、456~475 aa、503~522 aa,HPV45 L2蛋白的表位位于40~59 aa、55~74 aa、82~101 aa、348~367 aa[17-18]。Dey等[19]通过使用Analysis Resource、ABCpred服务器以及IEDB(Immune Epitope Database)预测HPV45 L1蛋白的表位位于75~89 aa、157~171 aa、194~208 aa、301~314 aa。Wang等[20]鉴定了一种抗L2单克隆抗体(14H6),该抗体可以中和HPV-6、11、16、18、31、33、35、45、52、58、59亚型制备的假病毒颗粒,最终识别了L2蛋白的线性表位,位于21~30 aa。在本研究中,我们使用抗L1蛋白的单克隆抗体通过亲和淘选噬菌体十二肽库筛选了HPV45 L1蛋白的线性表位“381VPNTYD386”,该表位正好包含在Ghorban使用BCPREDS服务器预测的表位375~394 aa之中。
综上所述,我们成功制备了抗HPV45 L1蛋白的单克隆抗体,并结合噬菌体展示的随机肽库筛选并鉴定了HPV45 L1蛋白的线性表位“381VPNTYD386”,该研究为进一步分析HPV45L1蛋白的结构和功能关系奠定基础。
