抗氧化损伤因子在胎膜早破未足月儿胎盘中的表达及作用
2022-01-22王大鹏牛颖颖王昕琦金贞爱
王大鹏 牛颖颖 王昕琦 金贞爱
(延边大学附属医院新生儿科,吉林延吉 133000)
早产是围生期常见的不良妊娠结局之一,由于它的高发病率、致残率和病死率,使其成为一个主要的全球公共卫生问题[1-2]。现阶段我国每年出生人口数量呈现下降趋势,国内三孩政策得到了全面实施,高龄孕产妇的增加,导致早产的发生率有所上升,影响了出生人口素质[3],其中约50%是由未足月胎膜早破(preterm premature rupture of membranes,PPROM)引起[2,4]。Menon等[4]指出氧化应激和活性氧可能是导致PPROM的因素,胎膜早破可能是炎症-氧化应激轴功能紊乱引起的一种胎膜疾病。核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)、血红素氧合酶1(heme oxygenase-1,HO-1)及NAD(P)H:醌氧化还原酶1[NAD(P)H:quinone oxidoreductase-1,NQO1]是体内主要的抗氧化损伤因子。目前国内外研究认为PPROM与氧化应激可能有关,临床上尚缺乏关于PPROM预测的确切指标[1]。Nrf2/HO-1信号通路是机体最主要的内源性抗氧化信号通路,本研究假设Nrf2、HO-1、NQO1对PPROM的发生有影响,通过分组对照观察其在PPROM胎盘上的相对表达量,希望对于确定PPROM的临床高危因素,降低PPROM的发病率,改善新生儿预后提供科学依据。
1 资料与方法
1.1 研究对象
前瞻性选取2019~2020年在延边大学附属医院新生儿科住院的新生儿为研究对象,其中PPROM新生儿30例,足月胎膜早破(term premature rupture of membranes,TPROM)新生儿32例,足月无胎膜早破新生儿35例。纳入标准:(1)未足月胎膜早破组和足月胎膜早破组符合胎膜早破的诊断标准;(2)PPROM新生儿胎龄为32~36+6周,足月新生儿胎龄≥37周;(3)全部患儿及其母亲临床资料完整。排除标准:(1)产妇有基础疾病:妊娠糖尿病、妊娠高血压、凝血障碍,心脏病等;(2)产妇有严重的产科并发症:羊水栓塞、子痫、胎儿宫内窘迫等;(3)产妇孕期滥用药物;(4)产妇存在精神障碍及认知障碍;(5)多胎妊娠。本研究已获得延边大学附属医院医学伦理委员会批准(延医伦审2021025号)。
1.2 样本采集
胎盘组织采集:胎儿娩出后,立即在脐带附近纵切面取胎盘组织。其中一部分胎盘组织放置于EP管中,-80℃冰箱冻存;另一部分用4%的甲醛溶液进行固定。
1.3 相关疾病定义及诊断标准
(1)TPROM:胎膜在妊娠满37周及以后出现的破裂。(2)PPROM:胎膜在妊娠满37周之前出现的破裂。(3)胎膜早破的诊断标准[5]:临床表现为产妇阴道流液体或外阴湿润;阴道液pH值≥6.5。(4)绒毛膜羊膜炎的诊断标准[6]:镜下可见中性粒细胞在绒毛结缔组织、羊膜或绒毛膜板浸润,淋巴细胞在绒毛膜滋养层、绒毛膜羊膜结缔组织浸润。
1.4 苏木精-伊红染色法观察胎盘组织炎症变化
应用苏木精-伊红(hematoxylin-eosin,HE)染色法观察3组胎盘组织的炎症改变。胎盘组织切片,厚度4μm,经烘片、脱蜡、水化,然后染色、脱水,最后中性树胶封片,于显微镜下观察病理改变。
1.5 免疫组织化学染色法检测胎盘组织中Nrf2、HO-1及NQO1水平
采用免疫组织化学染色法检测Nrf2、HO-1和NQO1在胎盘组织中的表达。胎盘组织切片,厚度3μm,经烘片、脱蜡、水化、抗原修复,加入一抗(稀释比例均为1∶200,均购自美国Abcam公司),置于4℃冰箱过夜;加入反应增强液(北京中衫金桥生物技术有限公司,通用二步法试剂盒PV-9000)30 min,加入增强酶标山羊抗小鼠/兔IgG聚合物(北京中衫金桥生物技术有限公司,通用二步法试剂盒PV-9000)室温孵育20 min。DAB显色5 min;应用半定量积分法对染色结果进行判定。见表1。

表1 半定量积分法对免疫组化染色结果的判定
1.6 Western blot检测胎盘中NRF2、HO-1及NQO1的表达水平
应用Western blot法检测胎盘组织中Nrf2、HO-1和NQO1蛋白的表达水平。取适量胎盘组织,加入组织裂解液进行匀浆,匀浆液以4℃、12 000 r/min的条件离心10 min,收集上清液并检测蛋白浓度。根据检测结果将30μg蛋白样本用于Western blot检测,在SDS聚丙烯酰胺凝胶中进行电泳,分离不同分子量的蛋白,电转移至硝酸纤维素膜,用5%脱脂牛奶室温封闭硝酸纤维素膜1 h;加入Nrf2、HO-1、NQO1一抗(1∶1 000,英国Abcam公司)和GAPDH一抗(1∶2 500,英国Abcam公司)4℃孵育硝酸纤维素膜16~24 h;而后加入二抗(1∶2 000)室温孵育硝酸纤维素膜1 h,加入1 mL的ECL化学发光剂,曝光并拍照,曝光图片采用Image J图像扫描并分析条带灰度值,以Nrf2、HO-1、NQO1蛋白条带与内参GAPDH蛋白条带的灰度值的比值表示Nrf2、HO-1、NQO1蛋白相对表达量。
1.7 统计学分析
采用SPSS 26.0统计软件对数据进行统计学分析,计量资料采用均数±标准差(±s)表示,多组间比较采用方差分析,组间两两比较采用SNK-q检验;计数资料以例数或百分率(%)表示,多组间比较采用卡方检验,组间两两比较采用卡方分割法,调整检验水准P<0.017为差异有统计学意义。余P<0.05为差异有统计学意义。
2 结果
2.1 HE染色法观察胎盘组织炎症变化
HE染色结果显示,足月无胎膜早破组、足月胎膜早破组、未足月胎膜早破组出现急性绒毛膜羊膜炎的比例分别为17%(6/35)、38%(12/32)、60%(18/30),差异有统计学意义(χ2=12.716,P=0.002),其中足月胎膜早破组与足月无胎膜早破组相比,出现急性绒毛膜羊膜炎的比例差异无统计学意义(P>0.017),但均低于未足月胎膜早破组(P<0.017)。在足月无胎膜早破组和足月胎膜早破组中,急性绒毛膜羊膜炎主要表现为中性粒细胞存在于绒毛膜板下;在未足月胎膜早破组中,急性绒毛膜羊膜炎主要表现为中性粒细胞在绒毛膜板和羊膜中呈片状聚集,病变弥漫。见图1。

图1 镜下观察三组胎盘组织中急性绒毛膜羊膜炎病理情况(苏木精-伊红染色,×200) 足月无胎膜早破组和足月胎膜早破组中急性绒毛膜羊膜炎主要表现为中性粒细胞存在于绒毛膜板下。未足月胎膜早破组中急性绒毛膜炎主要表现为中性粒细胞存在于绒毛膜板和羊膜中,呈片状聚集,病变弥漫。黑色箭头示中性粒细胞。
2.2 免疫组化法观察各组胎盘组织中Nrf2、HO-1及NQO1表达水平
Nrf2主要表达于胎盘滋养层细胞的细胞质中,足月胎膜早破组和足月无胎膜早破组胎盘组织中Nrf2阳性表达率高于未足月胎膜早破组(P<0.017),足月无胎膜早破组胎盘组织中Nrf2阳性表达率与足月胎膜早破组比较差异无统计学意义(P<0.017),见表2及图2。
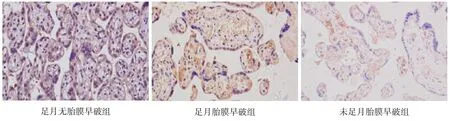
图2 三组胎盘组织中Nrf2的表达水平(免疫组化,×200) 足月无胎膜早破组和足月胎膜早破组胎盘组织中Nrf2的阳性表达水平均高于未足月胎膜早破组。Nrf2的阳性表达呈棕黄色。

表2 三组胎盘组织中Nrf2的表达分析
HO-1主要表达于胎盘滋养细胞的细胞质及部分间质细胞的细胞质和细胞膜中,足月胎膜早破组和足月无胎膜早破组胎盘组织中HO-1阳性表达率高于未足月胎膜早破组(P<0.017),足月无胎膜早破组胎盘组织中HO-1阳性表达率与足月胎膜早破组比较差异无统计学意义(P<0.017),见表3及图3。
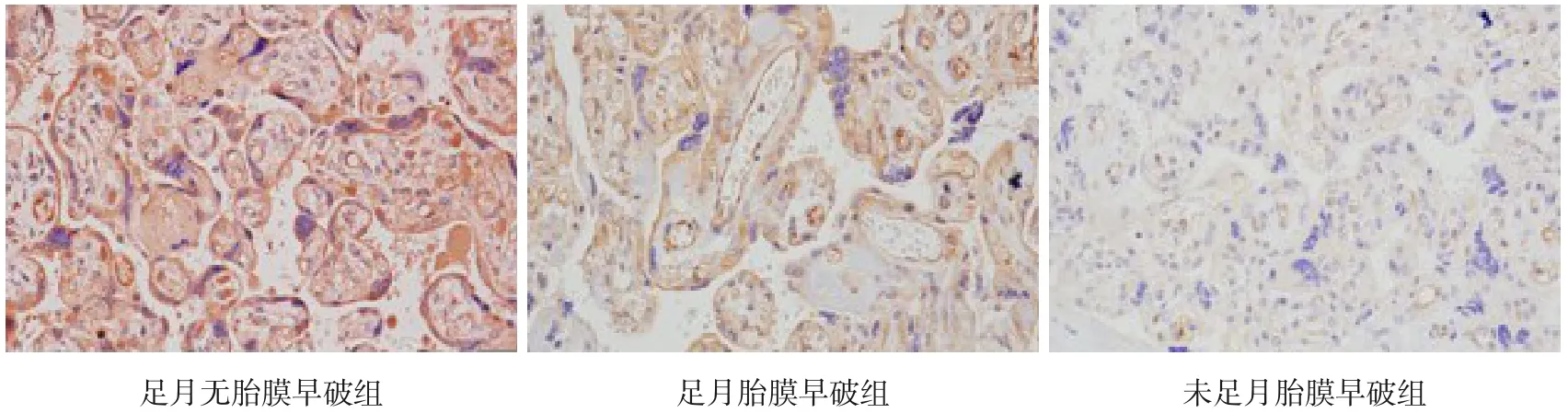
图3 三组胎盘组织中HO-1的表达水平(免疫组化,×200) 足月无胎膜早破组和足月胎膜早破组胎盘组织中HO-1的阳性表达水平均高于未足月胎膜早破组。HO-1的阳性表达呈棕黄色。
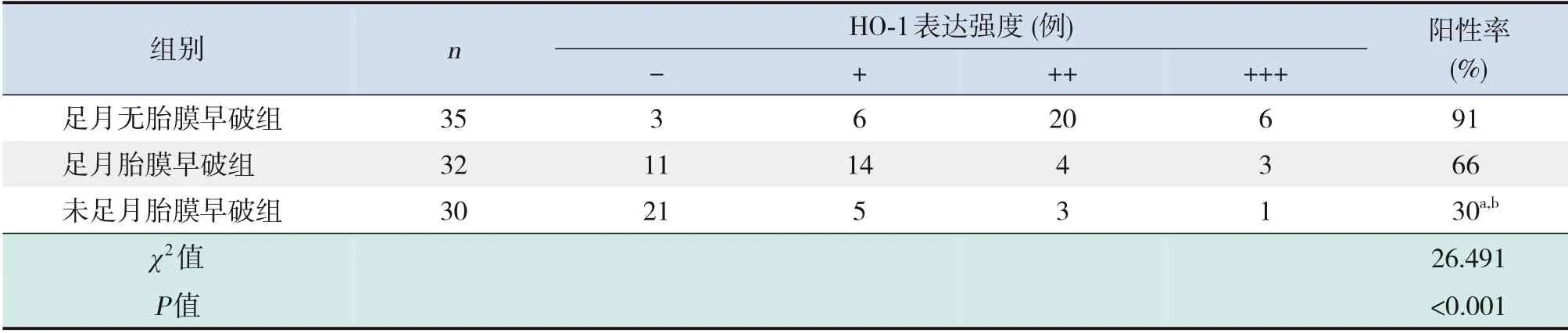
表3 三组胎盘组织中HO-1的表达分析
NQO1主要表达于胎盘滋养细胞的细胞质中,足月胎膜早破组和足月无胎膜早破组胎盘组织中NQO1阳性表达率高于未足月胎膜早破组(P<0.017),足月无胎膜早破组胎盘组织中NQO1阳性表达率与足月胎膜早破组比较差异无统计学意义(P<0.017),见表4及图4。
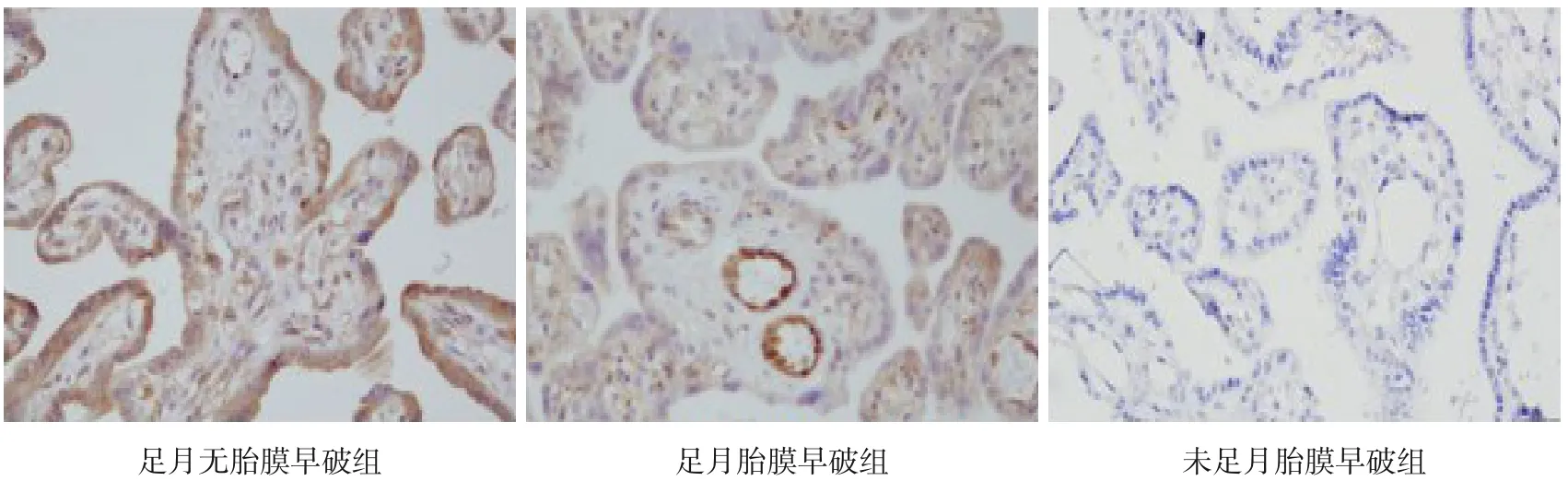
图4 三组胎盘组织中NQO1的表达水平(免疫组化,×200) 足月无胎膜早破组和足月胎膜早破组胎盘组织中NQO1的阳性表达水平均高于未足月胎膜早破组。NQO1的阳性表达呈棕黄色。

表4 三组胎盘组织中NQO1的表达分析
2.3 三组胎盘组织中Nrf2、HO-1及NQO1的蛋白相对表达量变化
足月胎膜早破组和足月无胎膜早破组产妇胎盘组织中Nrf2、HO-1及NQO1的蛋白相对表达量高于未足月胎膜早破组(P<0.05),足月胎膜早破组产妇胎盘组织中Nrf2、HO-1及NQO1的蛋白相对表达量与足月无胎膜早破组比较,差异无统计学意义(P>0.05),见表5及图5。

图5 Western blot法检测三组胎盘组织中Nrf2、HO-1及NQO1的蛋白相对表达量电泳图
表5 三组胎盘组织中Nrf2、HO-1及NQO1的蛋白相对表达量比较 (±s)
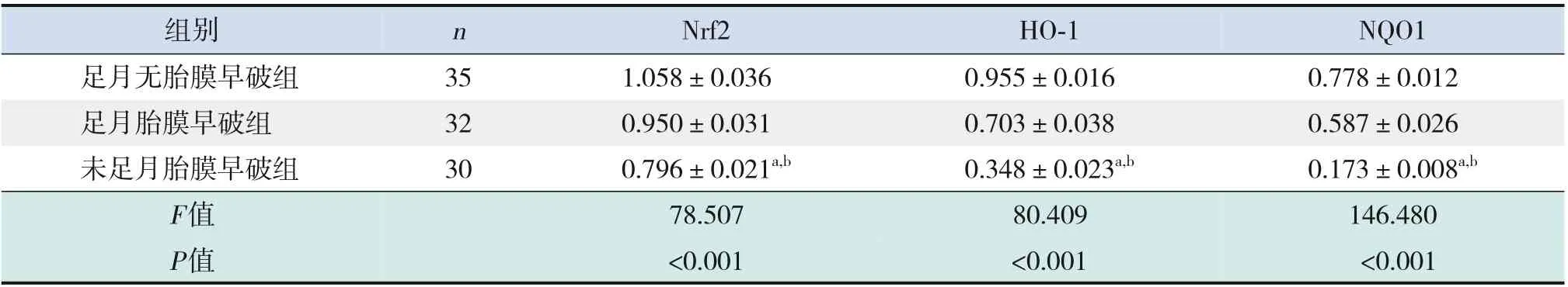
表5 三组胎盘组织中Nrf2、HO-1及NQO1的蛋白相对表达量比较 (±s)
注:[Nrf2]核因子E2相关因子2;[HO-1]血红素氧合酶1;[NQO1]NAD(P)H:醌氧化还原酶1。a示与足月无胎膜早破组比较,P<0.05;b示与足月胎膜早破组比较,P<0.05。
?
3 讨论
Menon等[4]指出氧化应激和活性氧可能是导致胎膜早破的因素之一,胎膜早破可能是炎症-氧化应激轴功能紊乱引起的一种胎膜疾病,确切机制尚不清楚。PPROM的氧化应激水平高,抗氧化酶水平较低,氧化应激导致活性氧的生成,在胎膜中激活主转录因子NF-κB途径,导致多种促炎因子的激活,是自发性早产和PPROM的重要影响因素。Nrf2、HO-1及NQO1是常见氧化应激标志物,在很多器官都有实验报道Nrf2/HO-1信号轴在各种氧化应激性疾病中的调节作用,例如阿尔兹海默症、急性肾损伤、动脉粥样硬化,在胎膜早破中研究较少。
Nrf2是调控细胞氧化应激反应的重要转录因子,同时也是维持细胞内氧化还原稳态的中枢调节者。Sussan等[6]研究发现,Nrf2缺乏的小鼠胎盘活性氧和炎症细胞因子水平增高。Chhetri等[7]研究发现,Nrf2活化可抑制凝血酶诱导的环氧合酶-2蛋白水平和前列腺素E2、IL-β的分泌,降低凝血酶对胎膜的促炎作用[6],这提示了PPROM的发生与活性氧存在一定的关系。本研究应用免疫组化和Western blot法检测Nrf2在三组中的表达情况,发现足月胎膜早破组和足月无胎膜早破组胎盘组织中Nrf2阳性表达率高于未足月胎膜早破组,足月无胎膜早破组与足月胎膜早破组比较,差异无统计学意义。与Lim等[8]基因组学实验研究结果一致,该研究结果提示Nrf2在人胎膜中具有抗炎作用,Nrf2减少增加了炎症和感染诱导的促炎细胞因子水平。提示抗氧化因子Nrf2对预防PPROM的发生具有一定的作用。
HO-1是Nrf2调控的抗氧化因子,是一种重要的抗氧化酶,在体内发挥着重要的生理作用。当Nrf2被活性氧激活时转化为HO-1,HO-1也可以中和活性氧,HO-1受独立的PI3K/Akt/Nrf2信号通路调控,氧化应激损伤可激活PI3K/Akt信号通路,进而诱导Nrf2入核,从而使HO-1表达增加[9]。HO-1影响着妊娠期间子宫血管的收缩和胎盘的发育[10],是减少流产发生率的一个因素,HO-1表达水平降低与妊娠并发症有关,缺乏严重时会导致胚胎死亡。本研究通过免疫组化和Western blot法检测HO-1在三组中的表达,显示足月胎膜早破组和足月无胎膜早破组胎盘组织中HO-1阳性表达率高于未足月胎膜早破组,足月无胎膜早破组与足月胎膜早破组比较,差异无统计学意义,提示HO-1在妊娠过程中起着重要的抗氧化作用。
NQO1是Nrf2调控的抗氧化因子,对保护内源性和外源性醌,以及在氧化还原平衡中发挥重要作用[11-12]。研究发现,NQO1在子痫前期患者胎盘组织中的表达水平低于正常者胎盘组织,这可能是由于胎盘血管内皮的氧化损伤,导致子痫前期的发生[13]。本研究采用免疫组化和Western blot法检测NQO1在三组胎盘组织中的表达情况,发现足月胎膜早破组和足月无胎膜早破组胎盘组织中NQO1阳性表达率高于未足月胎膜早破组,足月无胎膜早破组与足月胎膜早破组比较,差异无统计意义,提示NQO1是体内重要的抗氧化损伤因子。
导致胎膜早破的因素很多,常是多因素共同作用的结果,其中氧化应激导致的胎膜弹性降低,胎盘和胎儿细胞衰老和PPROM有密切关系。胎盘和胎膜组织经历氧化应激和细胞损伤后,导致胎盘胎膜结构和生化发生改变,胎膜老化且弹性降低。胎儿衰老的细胞产生独特的组织微环境,释放分娩信号。妊娠的过程就是氧化和抗氧化的平衡,当这个平衡被打破之后,胎盘和胎儿生化发生改变,导致了PPROM。
综上所述,本研究结果显示,未足月胎膜早破组的胎盘组织中Nrf2、HO-1及NQO1的相对表达量均最低,是PPROM的重要影响因素,可能与氧化应激过程中过度消耗有关。证实了Nrf2、HO-1、NQO1的减少在PPROM中的重要性,该结论为临床孕妇PPROM的预防和治疗提供了新思路,例如未来是否通过研发增加Nrf2表达的药物来治疗和控制氧化应激引起的PPROM,降低PPROM的发病率,从而改善新生儿预后。但本研究局限于延边地区且是小样本研究,其是否适用于所有PPROM患者,还需要纳入多地区行大样本进一步研究。
利益冲突声明:作者声明不存在利益冲突关系。
