早产儿坏死性小肠结肠炎影响因素分析及发病预测模型的构建
2022-01-22王又平郑美玉肖晔莹曲洋明武辉
王又平 郑美玉 肖晔莹 曲洋明 武辉
(吉林大学白求恩第一医院新生儿科,吉林长春 130000)
新生儿坏死性小肠结肠炎(neonatal necrotizing enterocolitis,NEC)是一种新生儿特别是早产儿中常见的胃肠道危重症,其特征为肠道损伤,可导致全消化道壁坏死、穿孔,甚至死亡[1]。NEC在早产儿中发病率最高、程度最重,是23~28周早产儿死亡的主要原因,约占新生儿死亡比例的十分之一[2]。幸存患儿往往有生长发育不良、胃肠道疾病如短肠综合征等后遗症,这给家庭及社会带来沉重的负担。
目前,NEC的发病机制尚不明确,目前已经报道的高危因素包括早产[3-5]、缺氧[6]、动脉导管未闭(patent ductus arteriosus,PDA)[7]、配方奶喂养[5,8]、贫血[9]、输血[10-11]、抗生素暴露[12]、感染[13]等,但NEC发病的病理生理学十分复杂,涉及母体、新生儿及治疗等多重方面,无法凭借单一因素预测疾病的发病风险。且NEC发病时不具特异性,病情进展迅速,在症状出现时疾病已然发生,在短时间内就可能发生全肠管的坏死穿孔及全腹腹膜炎等严重后果,因此及早预测、判断、控制病情的发生发展及针对高危因素的预防具有重要意义。本研究拟回顾性分析早产儿发生NEC的影响因素及生后24 h血常规参数等临床资料,应用统计学方法制作一个综合的预测评分表并验证其在预测NEC发生风险中的准确性,充实NEC模型相关研究,为临床工作提供指导。
1 资料与方法
1.1 研究对象
回顾性选取2011年1月1日至2020年12月31日吉林大学白求恩第一医院收治的Ⅱ期及Ⅲ期NEC早产儿298例纳入病例组;并按照1∶1比例随机抽取同期与病例组患儿胎龄±1周、入院时间±1周、出生体重±200 g的非NEC早产儿300例纳入对照组。纳入标准:(1)胎龄<37周;(2)入院日龄≤24 h且具有生后24 h内第1份血常规;(3)相关病例资料完整。排除标准:合并器官及系统发育畸形、先天性遗传代谢疾病等。本研究经过我院伦理委员会批准(2021-042)。
1.2 一般资料的收集
收集病例组及对照组临床资料包括:(1)患儿基本信息及围生期基本情况;(2)母亲围生期相关信息;(3)发生NEC前治疗措施;(4)确诊NEC前伴发疾病;(5)辅助检查:生后24 h内首次血常规参数。
诊断标准:NEC诊断及分期参照修正Bell-NEC分级标准[14];新生儿窒息、PDA、颅内出血、巨细胞病毒感染、尿路感染、肺炎、新生儿感染、早发型败血症、晚发型败血症诊断根据第5版《实用新生儿学》[14]。
1.3 统计学分析
因早产儿红细胞比容(hematocrit,HCT)、平均红细胞体积(mean corpuscular volume,MCV)等参数目前没有明确公认的参考范围,因此我们随机抽取10年中1 000例早产儿血常规相关参数进行分析,根据ROC曲线选取对应截取值进行分组。
应用SPSS 23.0统计软件对数据进行统计学分析;使用3.6.1版本的R语言rms包绘制列线图。计量资料采用中位数(四分位数间距)[M(P25,P75)]表示,组间比较采用Mann-WhitneyU检验;计数资料采用百分率(%)表示,组间比较采用χ2检验;对单因素分析有意义的因素及相关因素进行多因素logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料分析
病例组和对照组胎龄、性别、出生体重、出生方式、发病前应用肠内营养比例、Apgar 1 min及5 min评分比较差异均无统计学意义(P>0.05),见表1。
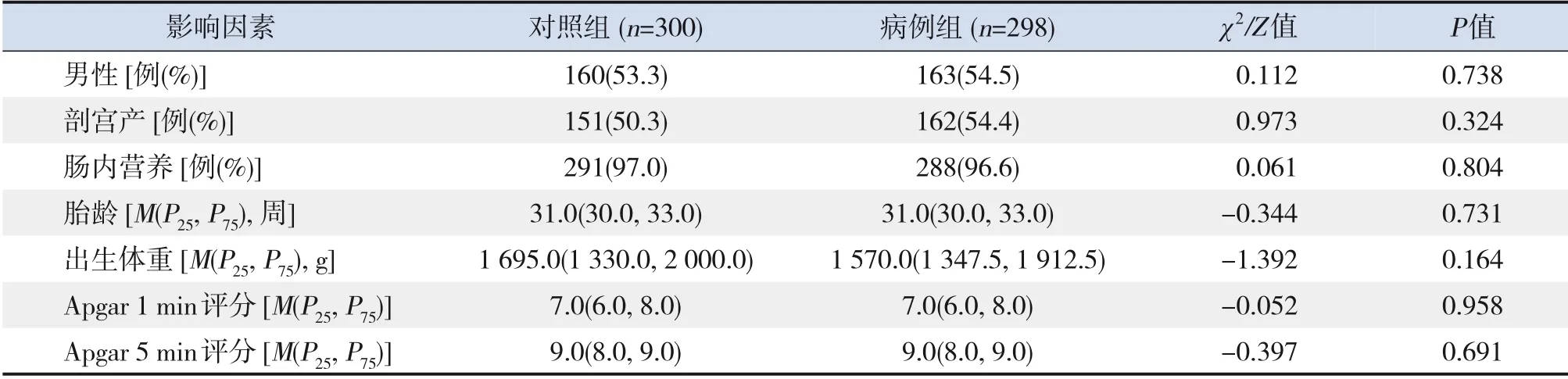
表1 病例组与对照组一般资料比较
2.2 早产儿NEC发病的单因素及多因素分析
对可能影响早产儿NEC发病的65个因素(包括国内外已报道文献中可能与NEC相关的影响因素及生后24 h内血常规参数等)进行单因素分析,结果提示:PDA、Ⅱ度及以上颅内出血、早发型败血症发生率,晚期使用抗生素(生后>7 d)、使用肺表面活性物质(pulmonary surfactant,PS)、经外周静脉穿刺中心静脉置管(peripherally inserted central catheter,PICC)、生后应用糖皮质激素、使用母乳强化剂、发病前使用益生菌、发病前输红细胞悬液比例,母乳喂养率、HCT、MCV、平均血小板体积(mean platelet volume,MPV)、血小板分布宽度(platelet distribution width,PDW)在两组间差异均有统计学意义(P<0.05),见表2~3。

表2 母亲及围生期因素
将上述单因素分析有意义的危险因素进一步行多因素logistic回归分析,其中Ⅱ度及以上颅内出血、PICC、使用母乳强化剂、发病前输红细胞悬 液、HCT>49.65%、MCV>114.35 fL、MPV>10.95 fL为早产儿NEC发病的独立危险因素;使用PS、发病前使用益生菌、PDW>11.8 fL为保护因素。见表4。

表3 早产儿因素

表4 早产儿NEC发病危险因素的logistic回归分析

表3 (续)
2.3 NEC预测列线图的建立与验证
所有独立及相关的风险因素用于建立NEC风险估计列线图(图1)。采用bootstrap验证方法对得到的模型进行内部验证。列线图显示了预测NEC风险的良好准确性,若存在Ⅱ度及以上颅内出血,则得分35;未用PS,得分40;应用PICC,得分29;使用母乳强化剂,得分67;发病前未口服益生菌,得分60;发病前输红细胞悬液,得分54;HCT>49.65%,得分98;MCV>114.35 fL,得分35;MPV>10.95 fL,得分48;PDW<11.8 fL,得分35。若与上述假设相反,则得分为0。将各影响因素的得分相加,得到总分,即可得出NEC的预测概率。
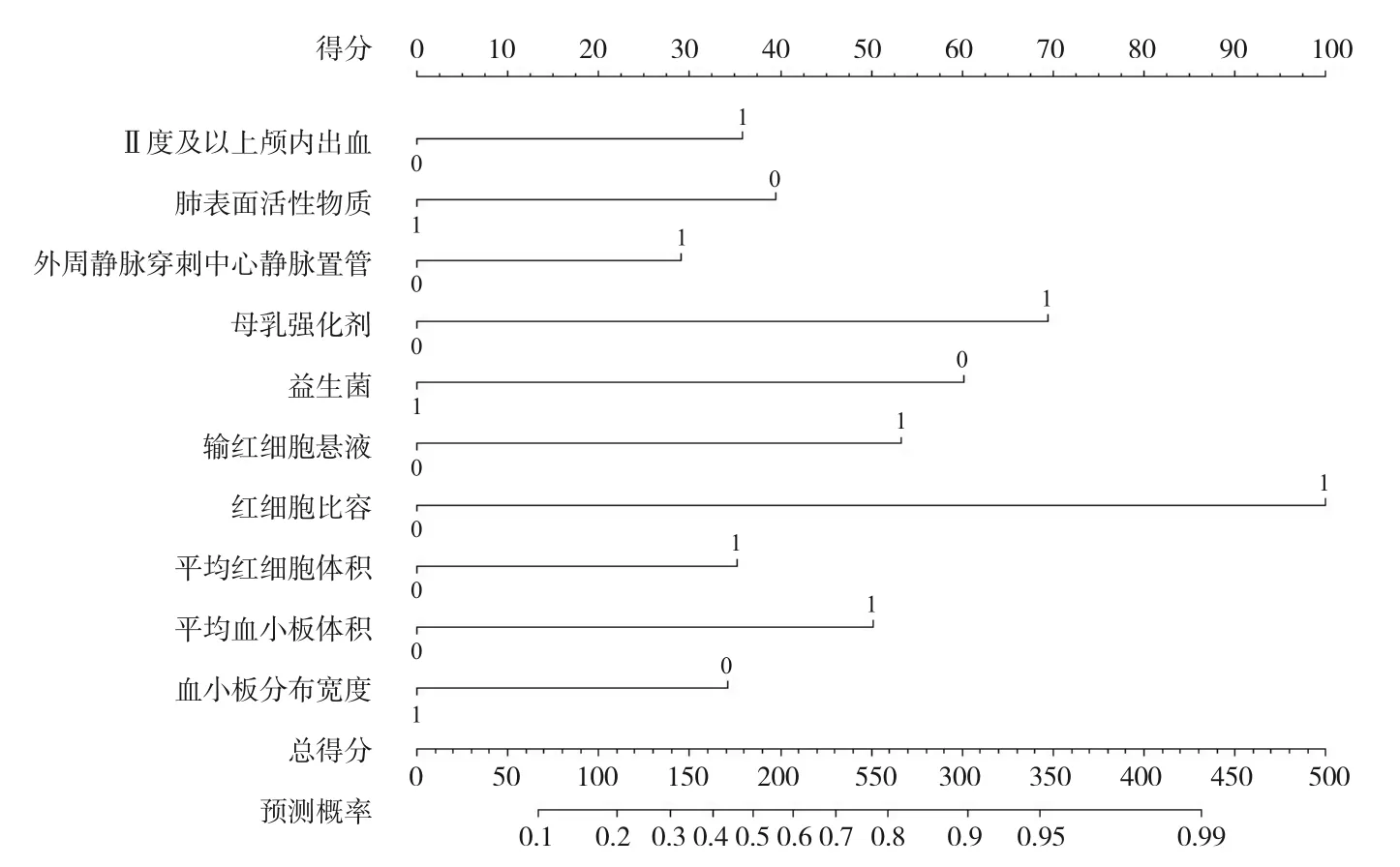
图1 早产儿NEC发病风险估计列线图 将各变量“是/使用/大于”赋值为1,“否/未用/小于”赋值为0,每个变量两个赋值点分别对应“0分”或“得分”,将各变量的得分相加,得到总得分,即可得出NEC的预测概率。
验证列线图结果提示:调整后的C指数为0.844(图2),代表该模型的预测性能良好;列线图总分的最佳截断值为171.02,鉴别有无NEC的灵敏度、特异度分别为74.7%、80.5%(图3)。
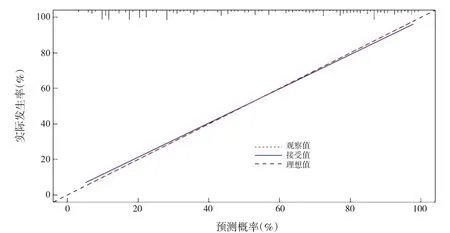
图2 早产儿NEC发病风险估计列线图验证结果 用一致性指数(C指数)测量列线图的预测性能,并用1 000倍bootstrap样本进行校正以减少过拟合偏差。调整后的C指数为0.844,列线图预测NEC风险的准确性良好。
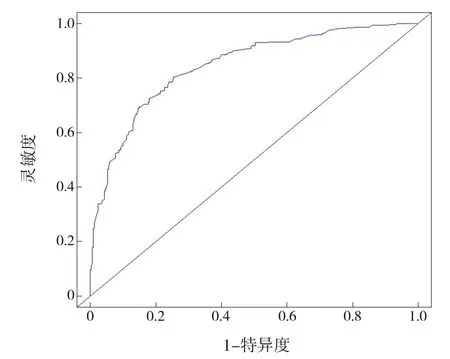
图3 早产儿NEC发病风险列线图ROC曲线
3 讨论
NEC约占早产儿病死率的1/10,存活者可能留有生长发育不良、胃肠道疾病等多种后遗症,严重威胁早产儿的生命安全和生存质量。2021年,中国医师协会新生儿科医师分会循证专业委员会[15]根据本病的危险因素、发病机制等制定了NEC临床诊疗指南,对NEC的预防、诊断、治疗及喂养策略方面提供了不同证据等级的建议。但是迄今为止尚未有研究综合各项因素对NEC的发生作出预判模型。因此,我们致力于建立一个依据影响因素、生后早期血常规参数的NEC发病预测模型,为临床工作提供帮助。
本研究回顾性分析了我院10年间Ⅱ期及以上NEC患儿发病的影响因素及生后24 h内血常规参数等临床资料,结果表明Ⅱ度及以上颅内出血、PICC、使用母乳强化剂、输注红细胞悬液、HCT>49.65%、MCV>114.35 fL、MPV>10.95 fL是早产儿发生NEC的独立危险因素,而使用PS、服用益生菌、PDW>11.8 fL是其发生的保护因素,本研究应用上述影响因素构建了NEC风险评估列线图。在目前可用的预测工具中,风险评估列线图可以提供个性化的、高度准确的风险评估,而且使用方便。迄今为止,NEC风险评估模型鲜有,本研究建立了一个NEC风险评估列线图,其中包括10个容易得到的变量。C指标支持了该模型有良好的预测性能,预测结果与实际观测结果吻合较好。该模型预期能够在生后早期甄别发生NEC风险较高的早产儿,并在临床上达到及早预防、及时治疗、改善预后的目的。
本研究发现Ⅱ度以上脑室出血是NEC发生的危险因素,这可能与缺血缺氧相关。缺血缺氧时发生的潜水反射使肠道血流量减少,引起肠壁损伤,导致局部NO合成增加和氧自由基释放,炎症反应与血小板活化因子和肿瘤坏死因子等细胞因子的释放导致进一步的黏膜损伤,从而促使NEC的发生[16-18]。本研究显示应用母乳强化剂患儿NEC发生率更高,这与之前的研究[19]不一致。但是之前的研究证据质量较低,母乳强化剂的使用可能会通过加重早产儿肠道吸收负担引起缺血缺氧,从而导致NEC的发生。本研究还发现益生菌对NEC具有保护作用,之前的研究[20-21]也有类似的报道,芽孢杆菌、肠球菌、双歧杆菌和嗜热链球菌能有效预防Ⅱ期NEC。
本研究还发现生后24 h内血液学参数与NEC的发生相关,HCT>49.65%、MCV>114.35 fL、MPV>10.95 fL为NEC发病的危险因素,而PDW>11.8 fL为其保护因素。NEC的发病机制与肠道缺氧缺血有着密切关系,贫血被认为是导致肠系膜血流改变,最终导致组织灌注不良和肠道损伤的潜在病因[22]。有研究指出血液的携氧能力低于生长组织的需要水平时,无氧代谢和副产品(如乳酸)的产生增强,在组织缺氧过程中,由于细胞三磷酸腺苷(adenosine triphosphate,ATP)需求和需氧ATP产生水平不相等而引起的不足,部分可以通过糖酵解、肌酸激酶反应和腺苷酸激酶反应等厌氧ATP来源来满足[16]。这些反应最终可能导致细胞功能障碍和死亡,可能是引发NEC的原因。已有研究报道HCT、MCV和MPV是NEC的危险因素[23-26],但目前尚无生后早期PDW与NEC之间关系的研究报道,因此仍然需要更多前瞻性研究证实PDW与NEC的关系。
在我们建立的风险预测列线图中,我们对每个危险因素赋予对应的得分,“总分”是将早产儿的10个影响因素得分相加得到的。根据每个新生儿的“总分”,可以得到NEC的预测概率。以171.02为截断值,总结了该模型的灵敏度为74.7%,特异度为80.5%,说明其在临床上具有较高的应用价值。基于这些预测,列线图可以作为降低NEC发生率及指导临床诊疗的工具。本文相较于刘延霞等[27]设计的预测模型,预测性能更佳。其具有一定的优越性:(1)本文将国内外已报道的关于NEC相关因素均已纳入,相关因素较多,并对其进行独立分析,可以对临床进行指导;(2)新生儿生后早期的血液学指标能够反映母体及自身双重情况,早期识别具有NEC高风险患儿可以有效降低发病率,血液学指标的加入对NEC患儿的早期识别与分析提供参考,使医务人员及时给予关注,并改善预后。本研究存在一定局限性:(1)样本来自于单中心,具有单一性,需要其他中心的数据进行验证;(2)本研究为回顾性研究,回顾性分析年代跨度较大,病例资料记录及完整性有所差异,需要更多的前瞻性研究来验证模型的可靠性;(3)本研究纳入的影响因素系依据国内外已报道的因素作参考,但由于对母体及新生儿可获取资料有限,无法一一纳入分析。
综上,Ⅱ度及以上颅内出血、PICC、使用母乳强化剂、输注红细胞悬液、HCT>49.65%、MCV>114.35 fL、MPV>10.95 fL是早产儿发生NEC的独立危险因素。使用PS、生后早期应用益生菌、PDW>11.8 fL为早产儿发生NEC的保护因素。NEC发病风险预估列线图在NEC的早期预判和有针对性的预防及早期干预方面有一定的临床价值。
