热处理对鲈鱼肌原纤维蛋白结构及功能特性的影响
2022-01-21郑云芳李晨张芳汪少芸
郑云芳,李晨,张芳,汪少芸
(福州大学生物科学与工程学院,福建 福州 350108)
0 引言
海鲈鱼学名为日本真鲈,肉质鲜美[1]、口感爽滑、滋味醇香、营养丰富,富含多种维生素、不饱和脂肪酸以及各种人体所需的氨基酸[2],有健脾胃、补肝肾、止咳化痰等作用.热处理是鲈鱼等食品加工过程中常见的一种方式.加热处理可降低食品中的致病菌的数量,有效延长食品的货架期,但是会改变食品的颜色、风味.蛋白质分子的规整结构受热诱导会展开或者折叠,使原本紧密的结构变得松散.而温度过高时,蛋白质分子间的运动加快,维持蛋白质一级和二级结构的氢键、肽键等共价键被破坏,蛋白质发生聚集[3].蛋白分子肽链受热后,连接肽链的共价键被破坏,可能引起蛋白质之间的相互作用发生改变,导致蛋白质的结构发生改变[4],最终改变肌原纤维蛋白的理化特性.不同的加热温度、加热时间和加热方式对鲈鱼蛋白的结构产生影响,进而影响蛋白的功能特性.
本研究通过设置不同的加热温度和时间,测定巯基质量摩尔浓度、浊度、紫外吸收光谱、内源性荧光、拉曼光谱、Ca2+-ATPase等指标来反映蛋白结构和功能特性的变化,并利用主成分和聚类分析等初步建立构象变化与功能特性之间的联系.通过研究相关的理化指标,将蛋白结构的变化与功能特性进行有效关联,可以为蛋白类食品的功能化设计打下一定基础.
1 材料与方法
1.1 实验材料
鲜活珠海鲈鱼,购于福州市永辉超市;EGTA,购自美国Sigma公司;五水合硫酸铜、乙二胺四乙酸、十二烷基硫酸钠,购自西陇科学股份有限公司;5, 5′-二硫代双(2-硝基苯甲酸),购自麦克林生化科技公司;超微量ATP酶(Ca2+)测试盒,购自南京建成研究所;酒石酸钾钠,购自广东光华化学厂.所有药品均为分析纯.
1.2 主要仪器设备
高速冷冻离心机 (TG16-WS湘智离心机有限公司);紫外可见分光光度计 (GENESYS 10S 美国赛默飞世尔科技公司);荧光光谱仪 (Fluoromax-4 法国Horiba Instrument公司);Zetasizer激光粒度分析仪 (ZEN3600 英国马尔文公司);多功能酶标仪 (SpectraMax i3x 美谷分子仪器上海有限公司).
1.3 实验方法
1) 肌原纤维蛋白的提取.肌原纤维蛋白的提取是参照Park[5]的方法,略作修改.
2) 热处理.将制得的肌原纤维蛋白溶液放置于离心管中,利用水浴锅对肌原纤维蛋白进行加热处理,当加热温度和时间达到设计的条件时取出样品,置于冰水浴中冷却至室温.
3) 测定巯基质量摩尔浓度.利用Ellman法测定肌原纤维蛋白的总巯基和活性巯基的质量摩尔浓度[6].
4) 测定表面疏水性.利用溴酚蓝法测定肌原纤维蛋白的表面疏水性[7].将1 mL肌原纤维蛋白与200 μL 1 mg·mL-1的溴酚蓝混合,振荡反应10 min,5 000 r·min-1离心15 min,取上清液稀释10倍后在595 nm处测定吸光度.以溴酚蓝结合量表示表面疏水性.每个样品重复测定3次.
5) 紫外吸收光谱测定.根据Wang等[8]的方法,略作修改.将加热后的肌原纤维蛋白溶液用磷酸盐缓冲液稀释至0.5 mg·mL-1,扫描范围为190~400 nm.每个样品重复测定5次.
6) 内源性荧光测定.参照Xu等[9]的方法测定.将肌原纤维蛋白浓度调整为0.5 mg·mL-1,设置激发波长为295 nm,发射光谱范围为300~450 nm.每个样品扫描5次.
7) Ca2+-ATPase活性检测.利用超微量ATP酶(Ca2+)测试盒测定鲈鱼肌原纤维蛋白的Ca2+-ATPase活性的变化.
8) 拉曼光谱测定.采用InVia Reflex激光显微拉曼光谱仪测定热处理后肌原纤维蛋白的二级结构,设置激光波长为785 nm,扫描范围400~3 600 cm-1,光谱分辨率为1 cm-1.每个样品重复测定3次.
9) 浊度测定.参照韩敏义等[10]的方法测定热处理前后的浊度.将蛋白浓度调整为1 mg·mL-1,测定处理前后的样品在340 nm处的吸光度,以磷酸盐缓冲液作为空白.每个样品重复测定3次.
10) 乳化性测定.根据Agyare等[11]的方法测定乳化性.取3 mL蛋白溶液,加入1 mL花生油,10 000 r·min-1高速剪切均质1 min,吸取50 μL乳化液,加入5 mL 0.1 g·mL-1SDS溶液,测定乳化液在500 nm处的吸光值,记作A0.静置10 min后,重复上述操作,将测得的吸光值记作A10.
11) 数据处理及统计分析.采用SPSS软件进行相关性和显著性分析,采用Origin软件进行作图.利用Simca多元变量统计分析软件进行主成分和聚类分析.
2 结果与讨论
2.1 巯基质量摩尔浓度
加热温度和加热时间对巯基质量摩尔浓度的影响如图1所示.由图1可知,不同加热温度处理后的肌原纤维蛋白的活性巯基质量摩尔浓度先增后减.热处理前后蛋白的总巯基质量摩尔浓度减少.刚开始巯基质量摩尔浓度的下降速度快,而后下降速度减缓.当加热温度为90 ℃时,肌原纤维蛋白总巯基质量摩尔浓度下降了13.90%.90 ℃时肌原纤维蛋白的活性巯基质量摩尔浓度为83.03 mmol·kg-1,下降了17.16%.
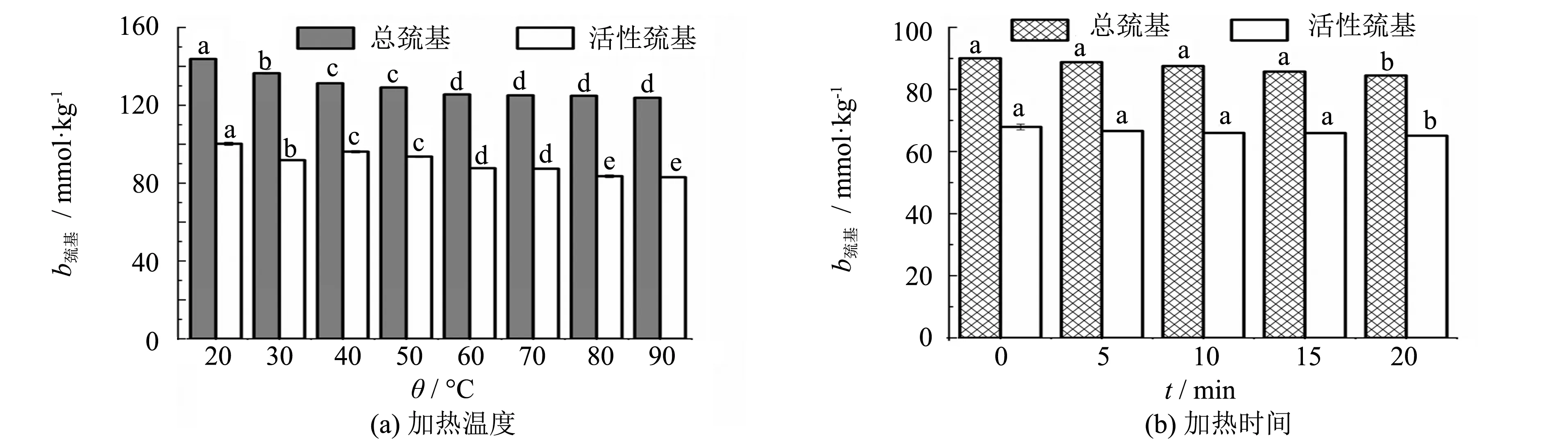
注: 不同小写字母表示热处理与对照组间差异具有统计学意义(P<0.05), 以下同 图1 加热温度和加热时间对巯基质量摩尔浓度的影响Fig.1 Effect of heating temperature and heating time on sulfhydryl molality
随着加热时间的延长,肌原纤维蛋白的总巯基和活性巯基的质量摩尔浓度逐渐下降.当加热时间为20 min时,肌原纤维蛋白的总巯基质量摩尔浓度为84.47 mmol·kg-1,下降了6.15%,活性巯基质量摩尔浓度为65.07 mmol·kg-1,下降了4.20%.
总巯基所具备的活性为各种反应提供了物质基础[12].蛋白质的构象变化常常与巯基和疏水基团的暴露有关[13].热处理后巯基质量摩尔浓度下降的原因是因为加热使肌原纤维蛋白结构发生转变,埋藏于蛋白分子内部的巯基转移至表面,活性巯基增加.温度进一步上升,高温促进了巯基的氧化反应,蛋白完全变性和聚集,生成二硫键和聚集体,巯基被掩盖,因而质量摩尔浓度降低.
2.2 表面疏水性
表面疏水性的大小以溴酚蓝结合质量表示,加热温度和加热时间对表面疏水性(m溴酚蓝)影响如图2所示.由图2可以看出,随着加热温度的提高,肌原纤维蛋白的表面疏水性先增大后减小.当加热温度为60 ℃时,肌原纤维蛋白的表面疏水性达到最大.继续增大加热温度,表面疏水性减小.随着加热时间的延长,肌原纤维蛋白的表面疏水性呈现减小的趋势.当加热时间为20 min时,肌原纤维蛋白的表面疏水性降至最低点,比对照组下降了19.18%.
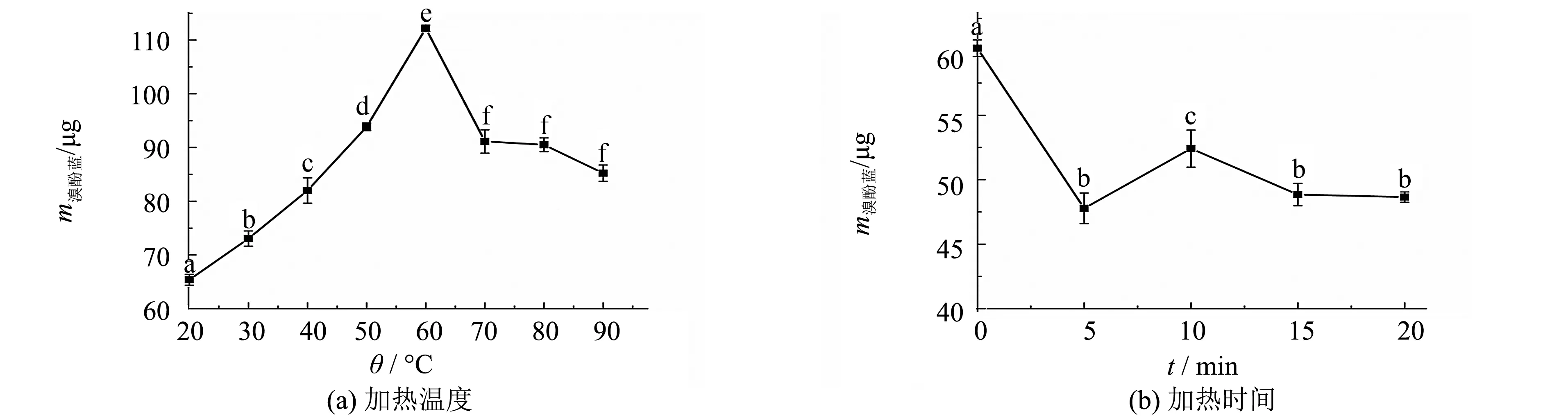
图2 加热温度和加热时间对表面疏水性的影响Fig.2 Effect of heating temperature and heating time on surface hydrophobicity
疏水域的暴露被认为是形成大型肌球蛋白聚集体的先决条件.Benjakul等[14]发现在加热过程中,鱼类肌原纤维蛋白的表面疏水性的变化可以分为2个阶段.第一阶段,表面疏水性随温度升高逐渐增大;第二阶段,疏水性残基完全暴露于极性环境中,表面疏水性基本不变.
2.3 紫外吸收光谱
浊度大小以蛋白质芳香族氨基酸的吸光值表示.加热温度和加热时间对紫外吸收光谱的影响如图3所示.图3表明肌原纤维蛋白的紫外吸收随着加热温度的增大而增强,最大吸收峰发生蓝移.超过40 ℃时,紫外吸收增加的程度较为明显.当加热温度达到90 ℃时,与不加热的肌原纤维蛋白相比,加热处理后的肌原纤维蛋白的最大吸收峰值增加了33.84%.随着加热时间的延长,肌原纤维蛋白的紫外吸收光谱的紫外吸光度逐渐增加.当加热时间为20 min时,肌原纤维蛋白的最大吸收峰值增加了7.26%.
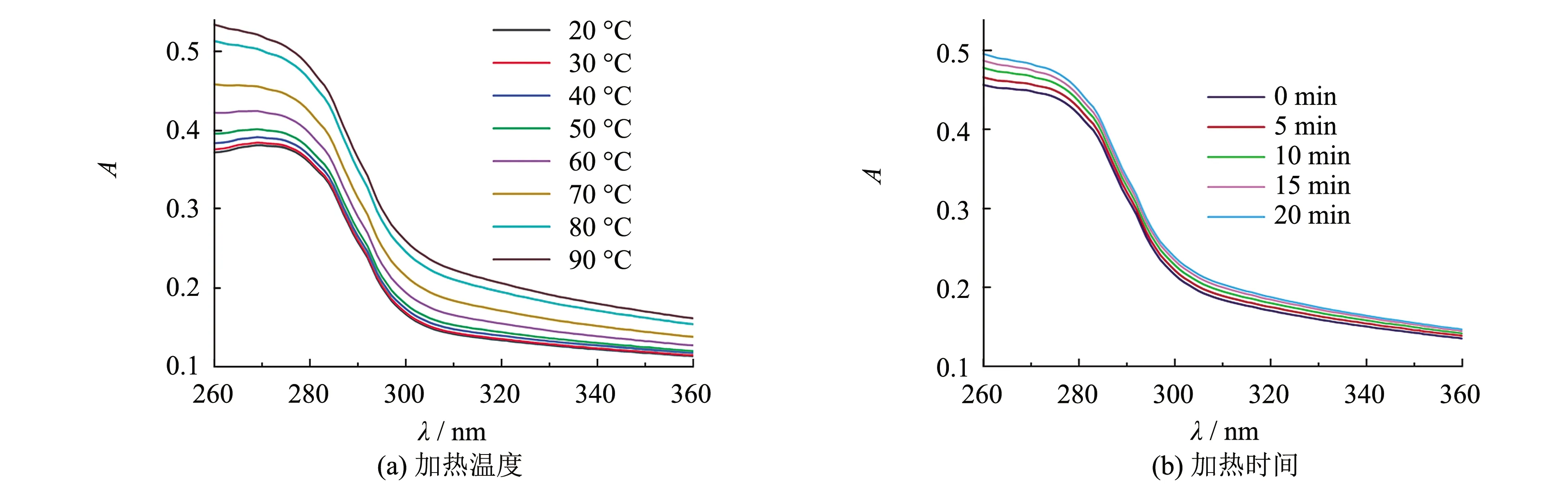
图3 加热温度和加热时间对紫外吸收光谱的影响Fig.3 Effect of heating temperature and heating time on ultraviolet absorption spectra
热处理使肌原纤维蛋白紫外吸收强度增加的原因可能是热处理使蛋白质的结构展开,构象发生改变,埋藏在分子内部的生色基团暴露,导致紫外吸收特征峰值升高[15].紫外吸收光谱图中的最大吸收峰发生蓝移,说明蛋白质所处的环境极性增加,蛋白质结构展开[16].
2.4 荧光光谱
加热温度和加热时间对荧光光谱的影响如图4所示.由图4可知,随着加热温度的升高,肌原纤维蛋白的内源性荧光强度逐渐降低,发生了荧光猝灭,最大吸收峰轻微红移.当加热温度为90 ℃时,荧光强度下降了9%.随着加热时间的延长,肌原纤维蛋白的内源性荧光强度下降.当加热时间为20 min时,肌原纤维蛋白的内源性荧光强度下降的程度不明显,仅减少了1.92%.加热可能造成蛋白结构的破坏,引起生色基团暴露在溶剂中,导致荧光强度降低[17].热处理改变了蛋白肽链的折叠形式,蛋白展开,色氨酸残基暴露于表面.活性基团的暴露增强了分子间相互作用,造成分子的再聚集,进一步导致更多色氨酸残基被包埋于疏水区域,从而引起内源荧光强度的下降.
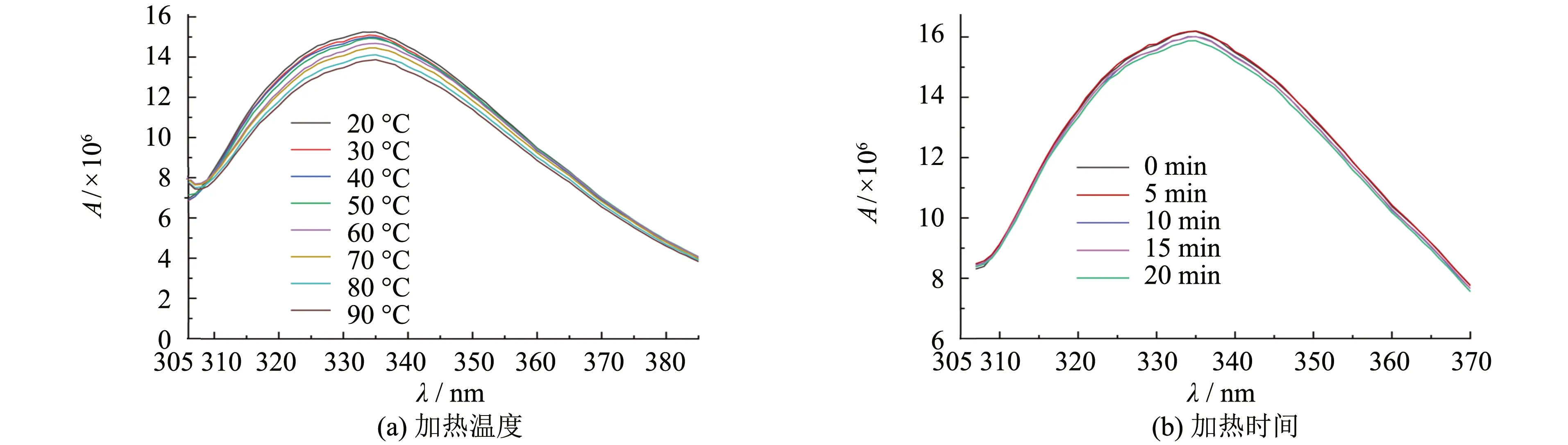
图4 加热温度和加热时间对荧光光谱的影响Fig.4 Effect of heating temperature and heating time on fluorescence spectra
吸收峰位波长红移原因可能是由于加热使肌原纤维蛋白内部疏水结构与区域暴露,色氨酸侧链基团暴露在蛋白质分子外部,处于极性环境中.袁丽等[18]发现经过不同的温度处理后鳙鱼肌球蛋白的荧光强度随温度升高,逐渐降低,出现荧光猝灭的现象.
2.5 Ca2+-ATPase活性
蛋白质酶促反应中无机磷的质量分数变化表示热处理过程中Ca2+-ATPase的变化情况, 如图5所示.随着加热温度的升高,Ca2+-ATPase活性逐渐减小.当加热温度达到50 ℃时,肌原纤维蛋白的Ca2+-ATPase的活性急剧降低.当加热温度超过80 ℃时,Ca2+-ATPase的活性几乎降为0,此时随着加热温度的继续升高,Ca2+-ATPase的活性不变.

图5 加热温度和加热时间对Ca2+-ATPase的影响Fig.5 The effect of heating temperature and heating time on Ca2+-ATPase
Ca2+-ATPase活性随加热时间延长而降低.Ca2+-ATPase活性在加热初始阶段,急剧下降,几乎降为0.继续延长加热时间,肌原纤维蛋白Ca2+-ATPase的活性不变.肌球蛋白与Ca2+-ATPase的活性密切相关,Ca2+-ATPase的活性下降反映了肌球蛋白的热变性和聚集.
2.6 二级结构
拉曼光谱法不但具备无损检测的特点,并且操作简单,可被用于预测蛋白的二级结构.通过分析肌原纤维蛋白拉曼光谱谱图的特征峰的峰位、峰强度以及峰面积,结合相关分析软件可推测肌原纤维蛋白结构的变化.加热温度和加热时间对二级结构的影响如图6所示.由图6分析可知,随着加热温度的提高,α-螺旋递减,β-折叠和无规卷曲的比例增加.与对照组相比,当加热温度为90 ℃时,肌原纤维蛋白的α-螺旋占比降至23.35%,下降了64.63%,此时无规卷曲和β-折叠的比例达到最大值,分别为25.50%和35.95%,增加了1.99倍和1.41倍.

图6 加热温度和加热时间对二级结构的影响Fig.6 Effect of heating temperature and heating time on secondary structure
随着加热时间的延长,肌原纤维蛋白的α-螺旋占比降低,β-折叠和无规卷曲的比例增加,β-转角的比例先增后减.当加热时间为20 min时,α-螺旋占比降至21.45%,比对照组下降了63.02%,β-折叠和无规卷曲增加至36.57%和25.18%,分别增加了97.89%和2.84倍.二级结构比例的变化说明热处理使肌原纤维蛋白的α-螺旋向β-折叠和无规卷曲转化.变性是由于肌原纤维蛋白中α-螺旋区域解折叠而引发的,然后暴露疏水和巯基残基,这些残基随后参与聚集和胶凝过程.
2.7 浊度
利用比色法比较浊度,可用于检测蛋白质聚集的程度[19].加热温度和加热时间对浊度的影响如图7所示.图7说明经过不同加热温度处理后的肌原纤维蛋白浊度逐渐增大.90 ℃时,肌原纤维蛋白的浊度显著增加,增大了40.51%.说明此时肌原纤维蛋白发生聚集,悬浮颗粒直径变大,浊度升高.
随着加热时间的延长,肌原纤维蛋白的浊度逐渐增大.当加热时间为20 min时,肌原纤维蛋白的浊度增加了9.65%.在加热过程中,肌球蛋白重链和轻链可能改变其构象,然后聚集形成不溶性物质.质地和功能特性的变化与蛋白质变性和聚集有关[20].
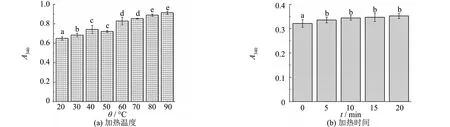
图7 加热温度和加热时间对浊度的影响Fig.7 Effect of heating temperature and heating time on turbidity
2.8 乳化性
加热温度和加热时间对乳化性的影响如图8所示.图中EAI为乳化活性指数,ESI为乳化稳定指数.由图8可知,随着加热温度的升高,肌原纤维蛋白的乳化性和乳化稳定性先增后减.80 ℃时,乳化活性达到最大值为24.695 m2·g-1,乳化性增加了19.46%.60 ℃时,肌原纤维蛋白的乳化稳定性最大,增加了42.35%.经过加热蛋白的结构展开,更容易向油-水界面和气-液界扩散,乳化性的增大.过高的温度会破坏蛋白质在两相界面的吸附作用,不利于形成稳定的乳化体系.

图8 加热温度和加热时间对乳化性的影响Fig.8 Effect of heating temperature and heating time on emulsifying properties
随着加热时间的延长,肌原纤维蛋白的乳化性和乳化稳定性先增后减.当加热时间为5 min时,肌原纤维蛋白的乳化性和乳化稳定性达到最大,分别为36.137 m2·g-1和33.88%.与对照组相比,肌原纤维蛋白的乳化性和乳化稳定性分别增加了1.02倍和4.92%.
2.9 主成分分析
利用多元变量统计分析软件对不同加热温度处理后的肌原纤维蛋白理化指标进行主成分分析,结果如图9所示.
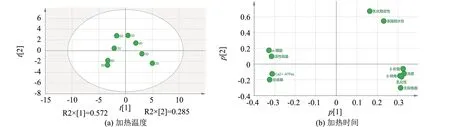
图9 不同加热温度的主成分得分图和载荷图Fig.9 Principal component score diagram and load diagram with different heating temperature
分解得到2个主成分.第一主成分的解释率为0.572,第二主成分的解释率为0.285.评分图显示不同加热温度下的样品明显分开,表示不同加热温度对肌原纤维蛋白的理化性质有较大的影响.80 ℃和90 ℃的样品位置接近,差别较小.α-螺旋和活性巯基的距离近,关联性强.β-折叠、乳化性和浊度的距离近,关联性强.α-螺旋、β-折叠、无规卷曲和乳化性被主成分介绍的程度高.
对不同加热时间处理后的肌原纤维蛋白理化指标进行主成分分析,分解得到2个主成分.第一主成分的解释率为0.705,第二主成分的解释率为0.199.如图10所示,评分图显示不同加热时间下的样品明显分开,表示不同加热时间对肌原纤维蛋白的理化性质有较大的影响.不加热的样品与加热处理的样品差别较大.加热时间为15和20 min样品的位置接近,差别较小.浊度和无规卷曲的距离近,关联性强.α-螺旋、Ca2+-ATPase和表面疏水性的距离近,关联性强.
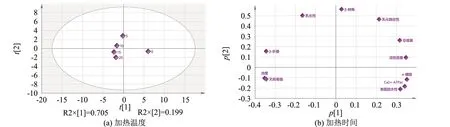
图10 不同加热时间的主成分得分图和载荷图Fig.10 Principal component score diagram and load diagram with different heatingtime
2.10 聚类分析
观察聚类图(图11)发现,20、30、40和80 ℃被聚为1类,50和60 ℃聚为1类.70和90 ℃各自分别为1类.乳化性、总巯基、浊度、I760/I1003、I850/I830、β-折叠、α-螺旋、无规卷曲、溶解度、起泡性、Ca2+-ATPase等指标聚为1类,表明这些指标间有密切联系.
5和10 min被聚为1类,15和20 min聚为1类、0 min为1类.总巯基、浊度、I760/I1003、I850/I830、β-折叠、α-螺旋、无规卷曲、溶解度、起泡性、Ca2+-ATPase等指标聚为1类,表明这些指标间有密切联系.
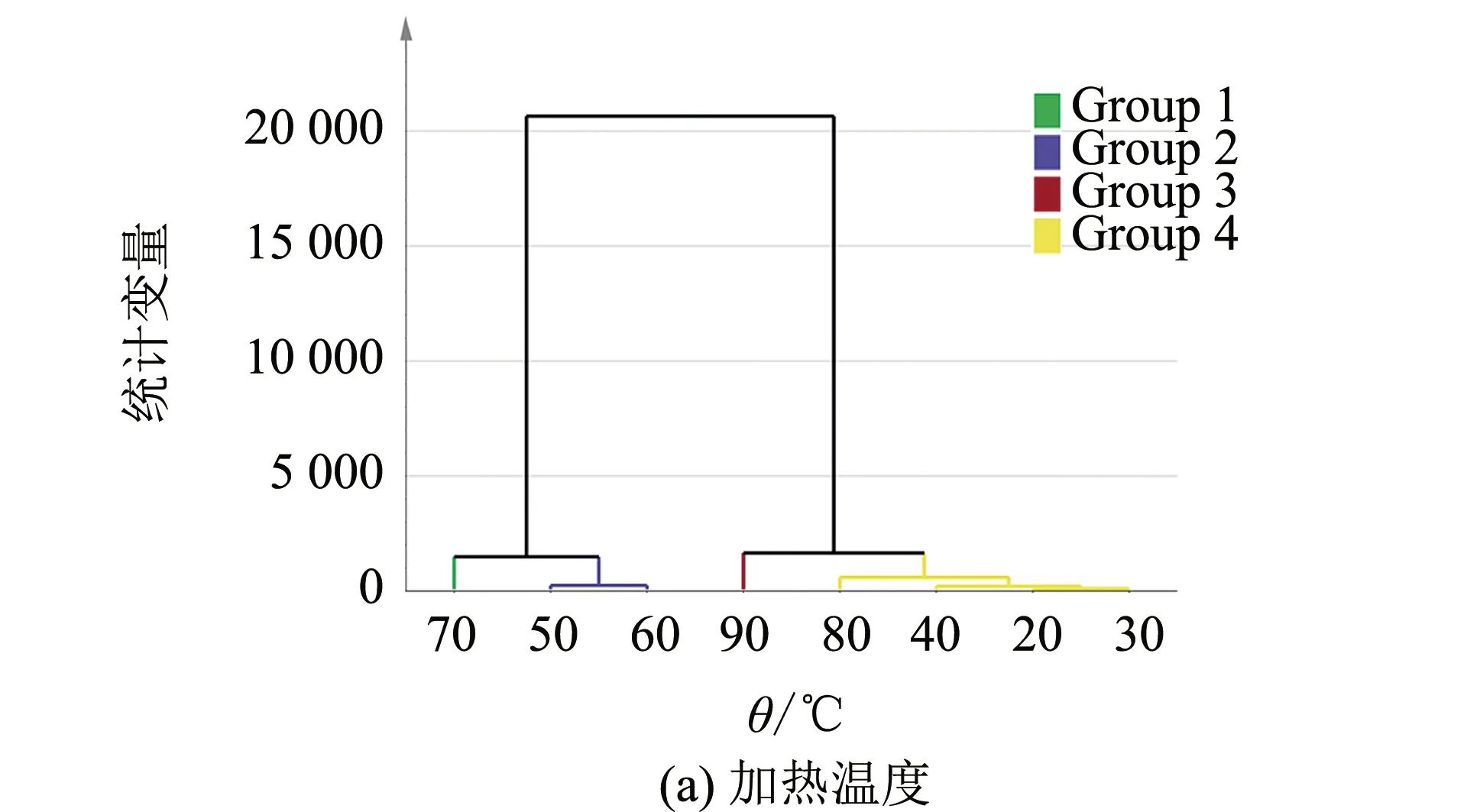
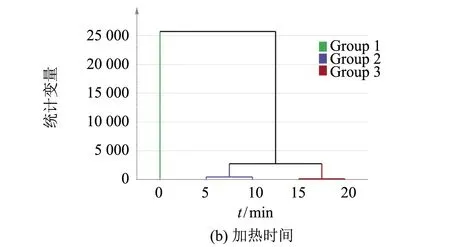
图11 不同加热温度和加热时间的聚类分析(Group 1~Group 4分别代表依属于不同距离函数的指标)
3 结语
热处理使肌原纤维蛋白的巯基质量摩尔浓度减少、紫外吸光度和浊度增大、荧光强度下降、Ca2+-ATPase活性下降.加热温度升高,肌原纤维蛋白的表面疏水性先增大后减小.热处理使肌原纤维蛋白的α-螺旋比例减少,β-折叠和无规卷曲的比例增加.热处理后的肌原纤维蛋白的乳化性和乳化稳定性先增后减.主成分和聚类分析表明蛋白质的不同结构会对功能特性的影响是不同的.主成分分析表明α-螺旋、β-折叠、无规卷曲和乳化性被主成分介绍的程度高.可以通过设计不同加热温度和时间使肌原纤维蛋白的功能特性得到有效的发挥.
