烟草黑胫病拮抗菌HZ15的发酵条件优化
2022-01-21曾舒泉钮徐融魏聪聪何明川兰明先谢永辉王志江詹莜国吴国星金红岗
曾舒泉,钮徐融,魏聪聪,何明川,兰明先,谢永辉,王志江,詹莜国,吴国星,金红岗
(1.云南农业大学 植物保护学院,云南 昆明 650201;2.云南省烟草公司 昆明市公司,云南 昆明 650051;3.云南中烟有限责任公司 红云红河集团 原料部,云南 昆明 650231)
烟草黑胫病(Tobacco black shank)是由烟草疫霉(Phytophthoraparasiticavar.nicotianae)引起的土传性真菌病害[1]。近年来,该病由于发病快、分布广、防治难等特点,已经成为我国烟草最严重的病害之一[2]。目前在烤烟生产上对烟草黑胫病采用以抗病品种筛选利用和合理轮作的农业防治措施为主,化学防治及其他防治措施为辅的综合防治手段[3]。但由于对农药的不合理使用,各地烤烟田间病原菌开始出现不同程度的抗药性[4-6]。化学农药的不合理使用不仅会使病原菌抗性进一步加强,更会加大环境污染,引发粮食安全问题。生物防治兼具高效、无毒、无残留和低成本等特点[7],利用微生物进行防治的方法在植物病害治理的舞台上亦扮演着愈来愈关键的角色,已经成为当前的研究热点。近年来,对烟草黑胫病拮抗菌的研究逐渐增多。目前已报道的对烟草黑胫病具有防治效果的细菌主要有芽孢杆菌(Bacillusspp.)[8-11]和假单胞菌(Pseudomonasspp.)[12-14]两大类,其中有关假单胞菌的报道较少[15]。因为假单胞菌能产生大量的抗生素物质,所以常被作为生防菌加以利用[16-18],但在其抑菌机制和菌剂开发等方面还属于空白,需要开展大量的研究[19]。除了利用拮抗细菌外,有研究发现木霉菌[20]和青霉菌[21]同样对烟草黑胫病具有较好的抑制效果。本课题组前期从1种鳞翅目昆虫的幼虫肠道内分离并筛选出1株对烟草黑胫病菌有较好拮抗效果的铜绿假单胞菌HZ15菌株。本试验以HZ15菌株发酵后的细菌浓度为指标,采用单因素试验和正交试验的方法,对HZ15菌株的发酵培养基和发酵条件等进行了优化,以期为HZ15菌株菌悬液的大量发酵培养、铜绿假单胞菌生防菌剂的开发与应用,以及烟草黑胫病的生物防治提供理论依据和参考。
1 材料与方法
1.1 试验材料
1.1.1 供试菌种 HZ15菌株为本课题组从1种鳞翅目幼虫肠道分离筛选所得,经鉴定为铜绿假单胞菌(Pseudomonasaeruginosa),保存于云南农业大学农药学实验室。
1.1.2 供试培养基 营养琼脂培养基(NA):牛肉膏0.60 g、蛋白胨2.00 g、NaCl 1.00 g、蒸馏水200 mL,在121 ℃下灭菌20 min(下同)。蛋白胨酵母培养基(LB):蛋白胨2.0 g、酵母浸粉1.00 g、NaCl 2.00 g、蒸馏水200 mL。细菌基础培养基(CM):葡萄糖1.00 g、(NH4)2SO40.40 g、柠檬酸钠0.20 g、MgSO4·7H2O 0.04 g、K2HPO40.80 g、KH2PO41.20 g、蒸馏水200 mL。蛋白胨酵母蔗糖培养基(YSP):蛋白胨2.00 g、酵母浸粉1.00 g、蔗糖4.00 g,蒸馏水200 mL。牛肉膏酵母葡萄糖培养基(NYBD):牛肉浸膏1.60 g、酵母浸粉1.00 g、葡萄糖2.00 g、蒸馏水200 mL。燕麦培养基(OA):燕麦30.0 g、琼脂18.0 g、蒸馏水1000 mL。
1.2 试验方法
1.2.1 拮抗菌抑菌活性的检测 采用平板对峙法,用无菌打孔器(5 mm)在病原菌平板上打孔,将菌块接入新配制的OA平板中央;再用无菌接菌环挑取拮抗菌,分别在距OA平板中央3 cm的四周等距接种拮抗菌4次,设置3个重复;在28 ℃下培养3 d,然后观察并测量处理平板上烟草疫霉菌的菌落直径,并取平均值计算其抑菌率。以不接种拮抗菌作为对照。抑菌率的计算公式为:抑菌率=(对照平板菌落直径-处理平板菌落直径)/对照平板菌落直径×100%。
1.2.2 种子液的制备 挑取固体培养基上的HZ15单菌落于100 mL LB液体培养基中,在28 ℃、摇床转速180 r/min的条件下振荡培养24 h,备用。
1.2.3 培养基对细菌生长的影响 向NA、LB、CM、YSP、NYBD五种100 mL液体培养基中各加入50 μL种子液,在28 ℃、180 r/min的摇床中振荡培养24 h,采用分光光度法测定菌液在波长600 nm处的OD值,从而确定细菌浓度。每组设置3个重复,下同。
1.2.4 碳源对细菌生长的影响 以上述试验筛选出的培养基为基础培养基,分别加入葡萄糖、麦芽糖、蔗糖、乳糖、淀粉作碳源,配制不同碳源的培养基进行HZ15的发酵培养。在培养24 h后分别测定菌液在波长600 nm处的OD值,以确定最佳碳源。
1.2.5 氮源对细菌生长的影响 以上述试验筛选出的培养基为基础培养基,分别加入NH4Cl、NH4NO3、酪氨酸、谷氨酸、蛋白胨作氮源,配制不同氮源的培养基进行发酵培养。在培养24 h后分别测定菌液在波长600 nm处的OD值,以确定最佳氮源。
1.2.6 初始pH值对细菌生长的影响 在上述优化培养基的基础上,分别调节培养基pH值至4、5、6、7、8、9、10,再在不同pH值培养基中各接种50 μL种子液,在28 ℃、180 r/min的摇床中振荡培养24 h,测定不同初始pH值下菌液在波长600 nm处的OD值。
1.2.7 初始接菌量对细菌生长的影响 分别接种0.05%、0.1%、0.5%、1%、2%、2.5%种子液于上述优化培养基中,发酵培养24 h,测定不同初始接菌量下菌液在波长600 nm处的OD值。
1.2.8 装液量对细菌生长的影响 在250 mL三角瓶中分别配制20、40、80、100、120、160 mL的优化培养基,再各接种50 μL种子液,于28 ℃、180 r/min的条件下振荡培养24 h,测定不同装液量下菌液在波长600 nm处的OD值。
1.2.9 温度对细菌生长的影响 在上述优化培养基的基础上,分别设置温度至20、24、28、32、36、40 ℃,发酵培养24 h,测定不同温度下菌液在波长600 nm处的OD值。
1.2.10 转速对细菌生长的影响 在上述优化培养基的基础上,分别设置摇床转速至140、160、180、200、220、240 r/min,发酵培养24 h,测定不同转速下菌液在波长600 nm处的OD值。
1.2.11 光照时间对细菌生长的影响 采用优化培养基,分别设定光照时间为0、4、8、12、16、20、24 h/d,在发酵培养24 h后测定不同光照时间下菌液在波长600 nm处的OD值。
1.2.12 发酵时间对细菌生长的影响 采用上述优化的培养基配方、初始pH值、温度和转速,分别发酵培养12、24、36、48、60、72、96、108、120、132、144 h,测定不同发酵时间对细菌生长的影响,并绘制HZ15的生长曲线。
1.2.13 发酵条件的正交试验 根据上述单因素试验结果,采用最优培养基配方,选择初始接菌量、装液量和转速这3个因素,设置3因素3水平的正交试验(表1),以筛选出最佳的发酵条件。

表1 正交试验设计因素
1.3 统计分析
采用SPSS 26.0和Microsoft Excel 2010对试验数据进行处理分析和图表制作;采用Duncan’s新复极差法检验不同处理间的差异显著性。
2 结果与分析
2.1 HZ15菌株对烟草疫霉的抑制效果
拮抗菌HZ15菌株与烟草疫霉的平板对峙试验结果如图1所示,HZ15菌株对烟草疫霉的抑菌效果显著且稳定,处理平板上烟草疫霉菌落的直径约为2.01 cm,抑制率约为77.1%,表明HZ15是1株对烟草黑胫病病原菌具有较好拮抗作用的生防菌。

a:对照。b:平板对峙。
2.2 培养基对细菌生长的影响
由图2可以看出,不同培养基对HZ15菌株生长的影响存在显著差异。HZ15菌株在NA、YSP、LB这3种培养基上生长较好且在三者间差异不明显,但HZ15菌株在YSP上生长最快,菌液浓度最高,OD值为2.700;HZ15菌株在CM培养基上生长速度最慢,OD值只有1.966。因此,以YSP培养基作为HZ15菌株生长的基础培养基。

图中标注不同小写字母代表处理间差异显著(P<0.05),下同。
2.3 碳源对细菌生长的影响
由图3可以看出,5种不同碳源对HZ15菌株生长的影响存在显著差异。HZ15菌株在葡萄糖、麦芽糖、蔗糖、乳糖和淀粉等碳源培养基上都能生长,其中以蔗糖为碳源的培养基最适合HZ15菌株的生长,在振荡培养24 h后OD值为2.551;其次为乳糖、麦芽糖、葡萄糖。相比之下,以淀粉为碳源的培养基不适合细菌生长,OD值仅为0.643。因此,选用蔗糖为发酵培养基的最佳碳源。

图3 碳源对细菌生长的影响
2.4 氮源对细菌生长的影响
由图4可知,5种氮源对HZ15菌株生长的影响具有显著性差异。HZ15菌株在氯化铵、硝酸铵和蛋白胨等氮源培养基上都能生长,当以蛋白胨为氮源时HZ15菌株生长最快,在振荡培养24 h后OD值为2.647;其次为氯化铵和硝酸铵,表明HZ15菌株可以较好地利用NH4+和NO3-;当以酪氨酸和谷氨酸为氮源时OD值分别仅为0.023和0.036,这表明HZ15菌株对这两种氨基酸的利用率较低。因此,选用蛋白胨作为培养基的最佳氮源。

图4 氮源对细菌生长的影响
2.5 初始pH值对细菌生长的影响
由图5可知,不同初始pH值对HZ15菌株生长的影响具有显著性差异。HZ15菌株在pH 5~9条件下均可以生长,生长最适的pH值范围为5~7,这表明HZ15菌株的生长喜欢微酸至中性环境;当pH值为7时细菌的浓度最高,OD值为2.674;当pH值为4和10时HZ15基本上没有生长,这表明过酸或过碱都对HZ15菌株的生长有抑制作用。
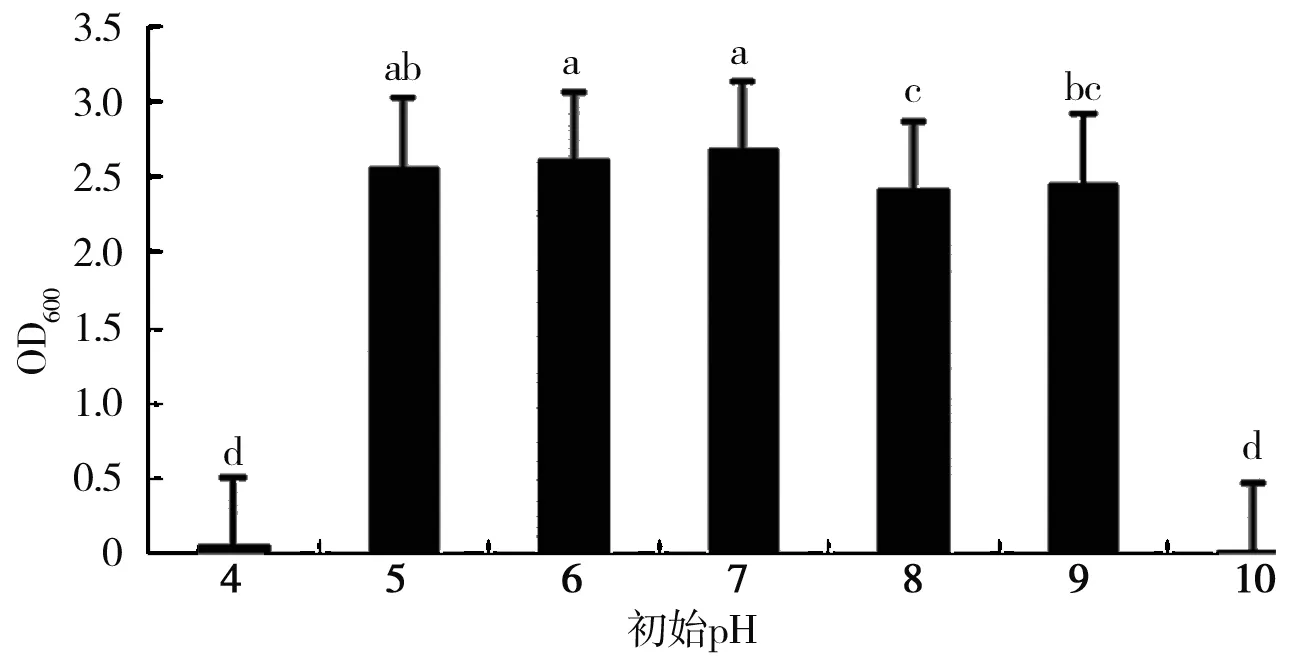
图5 初始pH值对细菌生长的影响
2.6 初始接菌量对细菌生长的影响
由图6可知,不同初始接菌量对HZ15菌株生长的影响具有显著差异。当初始接菌量为1%、2%、2.5%时细菌的生长速度差异不明显;当初始接菌量为2.5%时HZ15菌株的生长速度最快,培养24 h后菌液浓度最高,OD值为2.620;当初始接菌量为0.05%时,HZ15菌液的浓度最低,OD值只有2.495。
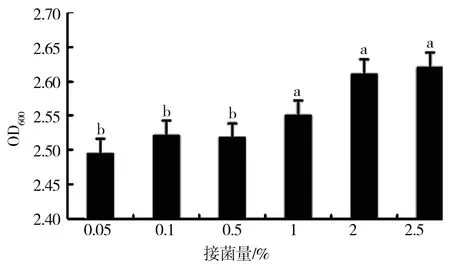
图6 初始接菌量对细菌生长的影响
2.7 装液量对细菌生长的影响
由图7可以看出,在250 mL三角瓶内用不同装液量培养HZ15菌株的情况下,不同的处理对其生长的影响存在显著差异。当装液量为20 mL时,HZ15菌液的浓度最高,OD值为3.123;其次为装液量40 mL;当装液量为160 mL时,HZ15菌液的浓度最低,OD值仅有2.211;随着装液量由20 mL向160 mL递增,OD值逐渐下降,这也表明HZ15菌株的生长需要氧气,且氧气含量越高,生长越旺盛。

图7 装液量对细菌生长的影响
2.8 温度对细菌生长的影响
由图8可知,不同温度对HZ15菌株生长的影响具有显著差异。HZ15菌株在20~40 ℃下均可以生长,当发酵温度为36 ℃时HZ15菌株生长最快,OD值为2.688;其次为40、28和32 ℃;在发酵温度为20和24 ℃的条件下,HZ15菌液的浓度较低,OD值分别为2.416和2.410。这表明HZ15菌株在温度较高的环境下生长较好,最适温度范围为28~40 ℃。

图8 温度对细菌生长的影响
2.9 转速对细菌生长的影响
从图9可以看出,不同转速对HZ15菌株生长的影响存在显著差异。当摇床转速为240 r/min时,HZ15菌株生长最快,菌液浓度最高,OD值为2.777;其次为转速220 r/min;在转速140、160、180、200 r/min间HZ15菌株的生长速度差异不明显,且菌液浓度都较低。
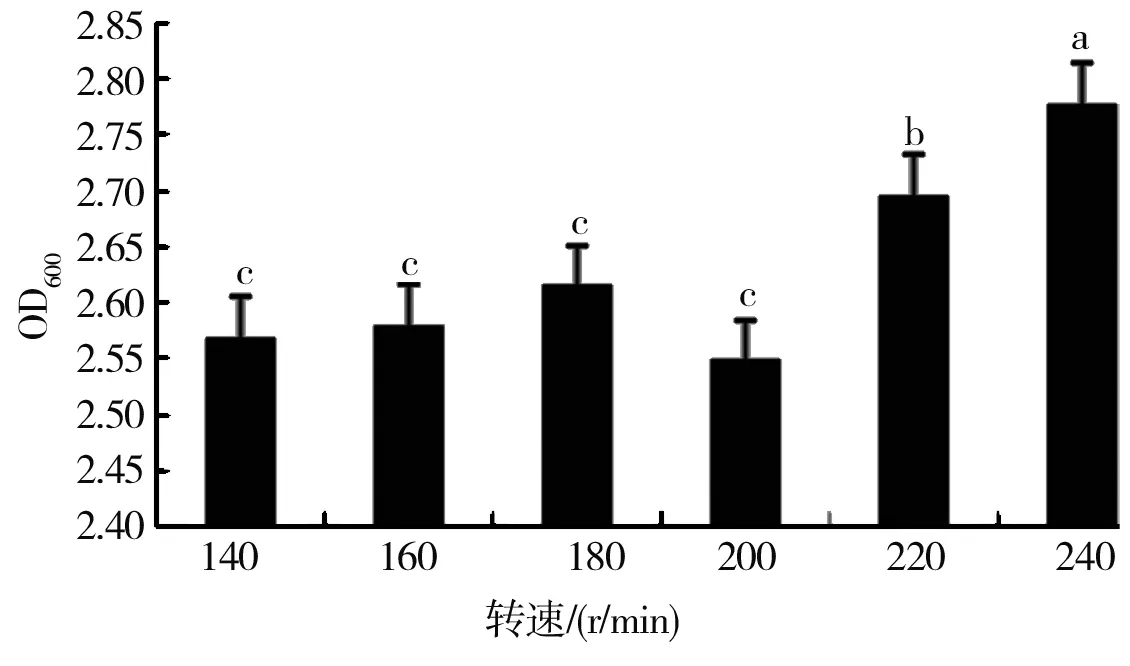
图9 转速对细菌生长的影响
2.10 光照时间对细菌生长的影响
由图10可以看出,HZ15菌株在有无光照的情况下均能生长。在光照时间为0、4、8、12、16、20 h/d的处理之间,HZ15菌株的生长速度差异不显著;但当光照时间为12 h/d时HZ15的菌液浓度最高,OD值为2.075;其次为光照时间16和20 h/d。由此可见,12 h/d光照对HZ15菌株的生长有促进作用,且效果最好。
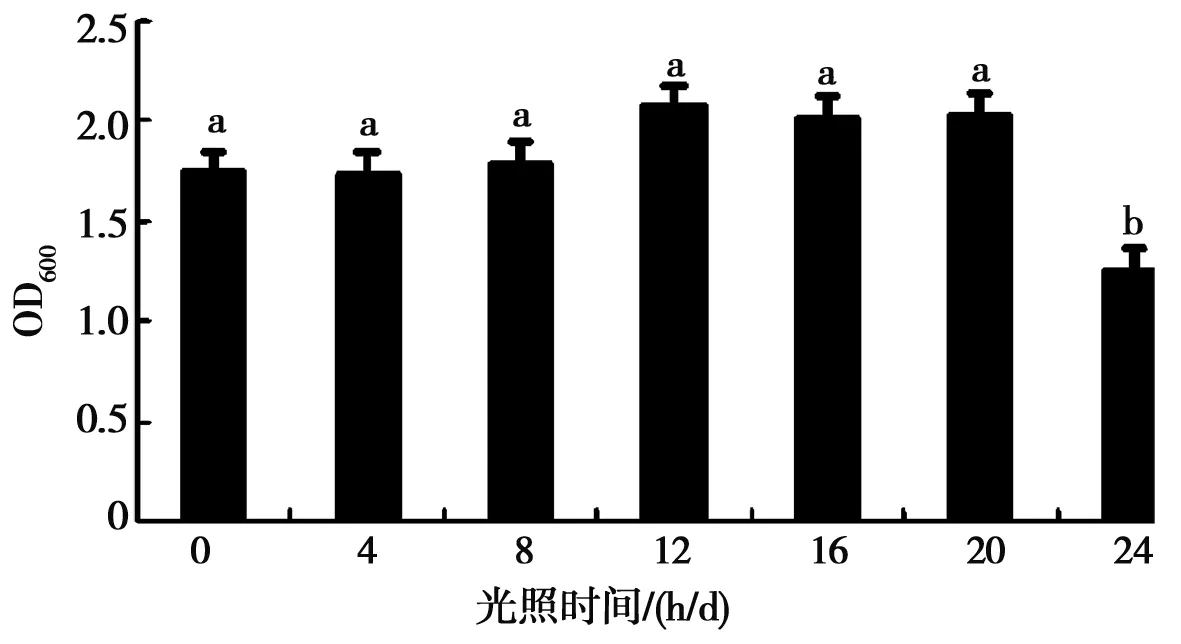
图10 光照时间对细菌生长的影响
2.11 发酵时间对细菌生长的影响
从图11可以看出,HZ15菌株的生长曲线基本上呈现“S”型。在发酵时间0~4 h期间,HZ15菌液的浓度较低,细菌数量呈缓慢增长趋势,该时段为细菌生长的迟缓期;从4 h开始,菌液浓度开始随培养时间的延长而逐渐增大,到20 h时菌液浓度增大逐渐变缓,该时段为细菌生长的对数期;在20~72 h期间,菌液浓度总体上呈先缓慢上升后缓慢下降的趋势,在48 h时HZ15菌液的浓度最大,OD值为2.900,该时段为细菌生长的稳定期;72 h后,随着培养时间的继续延长,HZ15菌液的浓度快速下降,该时段为细菌生长的衰亡期。

图11 HZ15菌株的生长曲线
2.12 发酵条件的正交试验结果
根据初始接菌量、装液量和转速的单因素试验结果,采用L9(33)正交表,设计3因素3水平的正交试验:初始接菌量选取1.0%、2.0%、2.5%;装液量选取20、40、80 mL;转速选取200、220、240 r/min。由表2数据可以看出,3个因素的极差R值从大到小依次为装液量、转速和初始接菌量,表明三者对HZ15发酵影响的强弱顺序为装液量>转速>初始接菌量。根据K值大小,可以得出3个因素的最佳组合为转速220 r/mim、装液量40 mL、初始接菌量2.5%,其OD600为3.052。
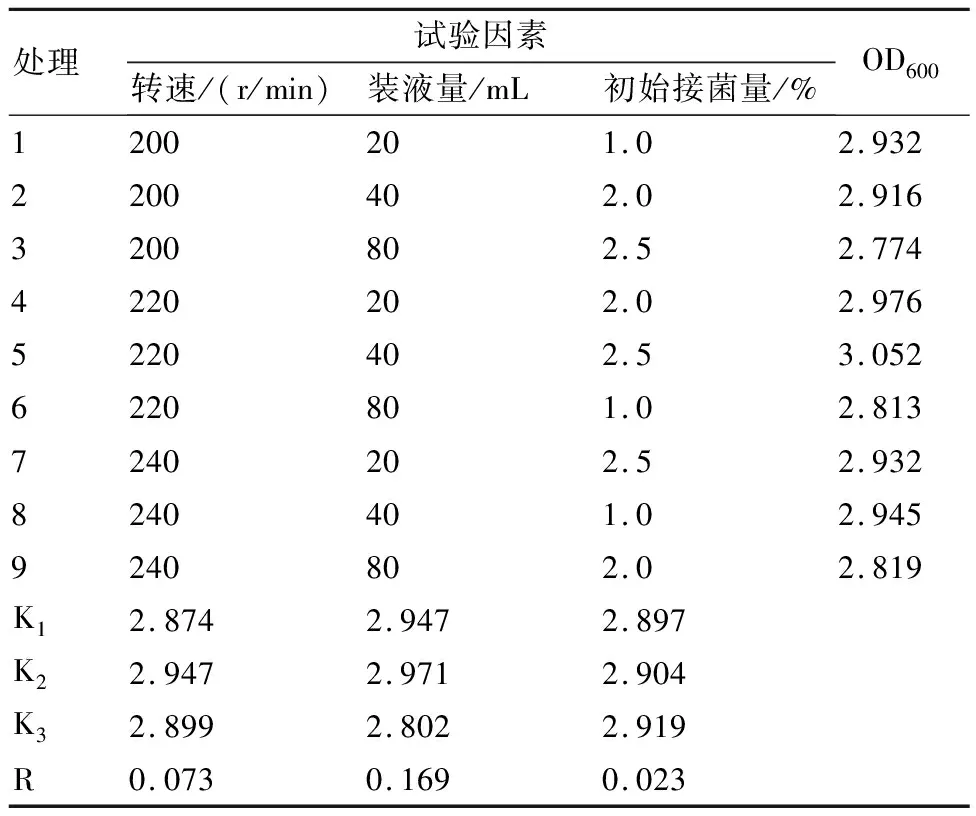
表2 发酵条件正交试验结果
3 讨论与结论
铜绿假单胞菌(P.aeruginosa)是一种常见的植物根际促生菌,其不仅能促进植物生长,还能够抑制诸多病原微生物的生长[22],其代谢产物例如嗜铁素类、吩嗪类、鼠李糖脂和胞外多糖类素等物质对卵菌和真菌等具有显著的抑制作用[23]。有研究发现,铜绿假单胞菌不仅是一种优良的植物病原生防细菌,还可以与生物肥料混合使用,某些铜绿假单胞菌株还同时具有除草的活性[22,24-26]。随着微生物发酵工程技术的不断提高,对有益微生物进行发酵,收集其代谢产物和菌体用于生物防治和提高作物产量的相关研究也越来越多,对有益微生物的发酵条件进行研究也变得越来越重要[27]。铜绿假单胞菌能够产生丰富且抑菌的代谢产物[23],因此对铜绿假单胞菌的发酵条件进行研究显得尤为重要。已有的研究表明,来源于土壤和植物的烟草黑胫病拮抗菌居多[15],其它来源的拮抗细菌几乎是空白。铜绿假单胞菌HZ15来自昆虫肠道内,具有一定新颖性,HZ15菌株的应用同时也丰富了昆虫肠道细菌方面的研究。
目前国内对铜绿假单胞菌发酵条件的研究主要集中在对其产生鼠李糖脂和蛋白酶等代谢产物发酵上[28,29]。本试验从细菌生长的角度出发,对铜绿假单胞菌HZ15的发酵条件进行优化,更加丰富了铜绿假单胞菌作为植物病害拮抗菌的发酵条件研究。本试验结果表明:HZ15菌株对碳源的选择较广泛,容易分解利用蔗糖、葡萄糖、麦芽糖,但是对淀粉的利用率较低,这可能与铜绿假单胞菌对淀粉的水解能力较弱有关;HZ15对NH4Cl、NH4NO3和蛋白胨的利用较好,但对酪氨酸和谷氨酸的利用极低,这表明HZ15菌株可能对氨基酸的利用效果不佳,该结果与王波等[30]和吴志美等[31]关于细菌对氮源选择的研究结果类似。在最佳装液量和摇床转速的优化方面,可以发现HZ15菌株在氧气充足的情况下能够很好地生长,这证明HZ15菌株为好氧型细菌;在光照时间的优化方面,可以发现HZ15在12 h/d的光照情况下生长较好,这表明HZ15菌株可能为感光型细菌,但还需进一步的探究。
影响微生物生长和产生代谢产物的因素有很多,比如发酵培养基的组成、pH值、温度、装液量等。不同的微生物因为其不同的代谢方式和生活环境等,对培养基组成和发酵条件的要求也有所不同[31]。本试验获得的HZ15菌株的最佳发酵条件与已报道的其他铜绿假单胞菌菌株的发酵条件[28,32,33]存在差异。这表明由于遗传特性、生活环境、生理生化和菌株来源等诸多因素不同,同种微生物的不同株系对发酵条件亦具有不同的要求。当然,不同铜绿假单胞菌株系之间也有相似的选择性,例如发酵初始pH值都为微酸偏中性[19,29]。
本试验对烟草黑胫病菌拮抗菌HZ15菌株的发酵条件进行了优化,结果表明:HZ15菌株的最佳发酵培养基为蛋白胨酵母蔗糖培养基(YSP),其组分为蛋白胨10 g/L、酵母膏5 g/L、蔗糖20 g/L、蒸馏水1 L;最佳发酵条件为pH 7、温度36 ℃、光照时间12 h/d、发酵时间48 h、装液量40 mL/250 mL、转速220 r/min、接菌量2.5%。经优化后的发酵条件方案提升了HZ15菌株的培养效率,节约了发酵成本,可以为HZ15菌株菌悬液的大量发酵培养、生防菌剂的开发与应用,以及烟草黑胫病的绿色防控提供科学依据。对铜绿假单胞菌产生的如鼠李糖脂、蛋白酶和吩嗪类物质等代谢产物的分离、鉴定和发酵等今后拟开展进一步的试验研究。
