基于逆转录重组酶聚合酶扩增技术的苹果病毒新型快速检测方法
2022-01-21焦健夏炎武雪莉王苗苗宋春晖庞宏光白团辉宋尚伟黄松郑先波
焦健,夏炎,武雪莉,王苗苗,宋春晖,庞宏光,白团辉,宋尚伟,黄松,2,郑先波
(1.河南农业大学园艺学院,河南 郑州,450002; 2.信阳农林学院,河南 信阳,464006)
苹果(Malusdomestica)是中国种植面积最大,产量最高的果树树种之一,具有较高的经济价值[1-2],但苹果生长中很容易发生由病毒和类病毒引起的病害[3]。目前世界上报道的苹果病毒病有39种,包括非潜隐性病毒25种,潜隐性病毒14种[4-5],其中苹果坏死花叶病毒(apple mosaic virus,ApNMV)、苹果褪绿叶斑病毒(apple chlorotic leaf spot virus,ACLSV)、苹果茎痘病毒(apple stem pitting virus,ASPV)、苹果茎沟病毒(apple stem grooving virus,ASGV)、苹果锈果类病毒(apple scar skin viroid,ASSVd)在中国发生较为普遍[6]。苹果病毒病已成为制约苹果产业健康发展的重要生物因素,病毒侵入树体后会在树体内迅速增殖,使其终生带毒,不仅影响果树正常的生理代谢和生长,而且会导致果实品质和产量的下降[7]。
苹果树主要通过无性繁殖,树体一旦感病,将终生带毒[8],因此要想尽可能降低、避免病毒病造成的损失,只能通过繁殖无病毒种植材料以及在植物生长阶段的早期进行病毒检测并及时处理感病植株,以避免产量的损失,防止病毒病的进一步传播[9]。因此,特异性强、灵敏度高、准确快速的苹果病毒检测体系十分重要。随着分子病毒学和生物技术的进步,如今有许多方法已应用于植物病毒的检测:指示植物法、酶联免疫法、电镜观测法、核酸分子杂交法[10-13]、聚合酶链式反应(polymerase chain reaction,PCR)和新一代测序技术(next generation sequencing,NGS)[14-16],但大多数分子检测方法都存在操作复杂、设备要求高、检测时间过长等缺陷。
重组酶聚合酶扩增(recombinase polymerase amplification,RPA)是一种新型的等温核酸扩增和检测技术,由英国TwistDx Inc公司于2006年成功开发[17]。其主要依赖于重组酶(recombinase)、链置换DNA聚合酶(polymerase)和单链DNA结合蛋白(single-stranded DNA-binding protein)的酶促反应[18]:首先两条引物先与重组酶蛋白形成稳定的复合物;该复合物能够侵入靶标dsDNA,并将引物导向同源序列;随后在37~42 ℃的条件下通过DNA聚合酶催化链置换、合成、连续扩增[19]。与PCR热变性不同的是,RPA利用酶促混合物进行DNA变性,因此在等温条件下即可完成扩增反应。此外,在常规RPA体系中可加入逆转录酶,开发出逆转录重组酶聚合酶扩增技术(reverse transcription-recombinase polymerase amplification,RT-RPA)。RT-RPA以RNA为检测底物,逆转录为cDNA后再进行扩增,就可实现RNA的一步法扩增,从而能够更加方便快捷的进行RNA病毒检测。
RT-RPA操作简单、灵敏度高、扩增效率高、在相对较低的恒温(25~43 ℃)下持续5~20 min即可完成扩增反应[20],近两年备受关注。目前关于植物病毒的RPA检测方法在黄瓜绿斑驳花叶病毒、黄瓜花叶病毒、玉米褪绿斑驳病毒、山药花叶病毒、番茄斑驳病毒、马铃薯Y病毒、番茄黄叶卷曲病毒和玫瑰花环病毒等[21-26]已有报道。KIM等[27]也根据苹果茎沟病毒的CP基因高保守区域设计出了能够灵敏快速检测该病毒的RPA引物,但是,此引物是以梨中分离出ASGV病毒进行设计的。此外,苹果其他的病毒病如ASPV、ACLSV以及近年来最新报道的苹果花叶病的主要病原物ApNMV,还未建立其RT-RPA检测体系。
本研究以苹果病毒ASGV、ASPV、ACLSV和ApNMV为主要研究对象,利用逆转录重组酶聚合酶扩增技术,建立RT-RPA新型快速检测方法,为苹果病毒病的早期快速诊断提供技术支持。
1 材料与方法
1.1 试验材料
试验在河南农业大学园艺学院河南省果树瓜类分子生物学重点实验室完成。试验材料采集地点为河南农业大学毛庄科教园区果树实验站苹果资源圃,从不同品种的苹果树上采集20份叶片有明显病症的苹果叶片样品,采集时间为2020年8月。采集后的样品带回实验室后放于-80 ℃冰箱贮藏用于后续试验。
1.2 引物设计
下载NCBI数据库中病毒全长序列,利用MEGA-X软件[28]进行比对分析,找寻病毒保守区域。随后参照RPA等温扩增试剂盒TwistAmpbasic kit(Twist DX,United Kingdom)的要求,采用NCBI在线引物设计工具Primer-BLAST,设计检测ASGV、ASPV、ApNMV和ACLSV的引物(表1),并由生工生物(上海,中国)合成。RPA引物设计原则如下:(1)在保守区域设计引物,长度30~35 bp,GC含量20%~70%,单碱基重复序列<5;(2)RPA扩增产物长度为100~200 bp;(3)引物序列与NCBI数据库(nr/nt)进行Blast比对,确保其种内保守性和种间特异性。
1.3 RNA提取与RT-RPA反应
将采集的苹果叶片置于液氮中冷冻后研磨成粉末,使用植物总RNA提取试剂盒DP432(北京,天根)提取总RNA,随后使用琼脂糖凝胶电泳和紫外分光光度计Nanodrop 2000(Thermo,USA)分别检验RNA的完整性和质量浓度(ng·μL-1)。
RT-RPA反应体系参照TwistAmp®basic试剂盒(Twist DX,United Kingdom)说明书,按照上下游引物各2.5 μL、2.5 μL HiScript III reverse Transcriptase(200 U·μL-1),2.5 μL RNase inhibitor(40 U·μL-1),rehydration buffer 29.5 μL、RNase-free水7 μL、总RNA 1.0 μL配置RT-RPA反应预混液,将47.5 μL预混液转移至反应沉淀中。通过上下移液混合,直到整个颗粒重新悬浮,37 ℃孵育5 min进行逆转录反应;随后在反应管盖子上加入2.5 μL醋酸镁,涡旋后离心;42 ℃温育20~30 min。反应产物使用质量浓度为1%的琼脂糖凝胶电泳分析。
1.4 反应体系优化
以10 ng·μL-1植物总RNA为模板,反应体系及步骤参照1.3中RT-RPA反应体系,反应温度分别设定为20、25、30、35、37、39、42、45及50 ℃进行RT-RPA扩增以确定RT-RPA最佳反应温度,在最佳温度下将反应时间分别设定为1、5、10、15、20、25及30 min进行RT-RPA扩增以确定RT-RPA最佳反应时间。反应结束后将5 μL扩增产物加入10 μL SDS loading buffer(5%甘油,10 mmol·μL-1EDTA,0.01%溴酚蓝和0.25% SDS)中,在质量分数为2%琼脂糖凝胶上进行电泳并观察结果。
1.5 RNA转录本制备与灵敏度检测
以感病苹果叶片的cDNA为模板,利用表1中的RPA特异性引物,进行PCR扩增。将4种苹果病毒的扩增产物纯化后,克隆到pGEM-T质粒(Promega)并进行测序验证。随后使用pUC/M13通用引物(M13pUC-Fwd,5′-CCCAGTCACGACGTTGTAAAACG-3′;M13pUC-Rev,5′-AGCGGATAACAATTTCACACAGG-3′)扩增出包含T7启动子序列的病毒dsDNA片段。将上述PCR产物稀释至100 ng·μL-1,使用HiScribe T7 Quick High Yield RNA Synthesis kit(New England Biolabs),分别合成4种病毒的RNA片段。随后采用RNA纯化试剂盒(北京,天根)对体外转录的RNA进行纯化,使用NanoDrop 2000分光光度计测量其浓度,并转化为拷贝数。拷贝数的计算方法[29]:
拷贝数(copies·μL-1)=
以4种病毒片段的RNA转录本为模板,以9.63×109copies·μL-1为初始浓度,以10为倍数依次进行稀释,同时设置阴性对照,分别进行RT-RPA和RT-PCR扩增反应,RT-PCR反应体系为2×Taq酶25 μL,RPA-F、R引物(10 μmol·L-1)各2.5 μL,cDNA 2 μL,模板2 μL,灭菌双蒸水补足至50 μL,RT-RPA扩增方法及体系参照1.3。RT-RPA和RT-PCR扩增产物在质量分数为2 %的琼脂糖凝胶上进行电泳,观察结果。
1.6 RPA引物特异性分析
分别挑选ASGV、ASPV、ApNMV和ACLSV复合侵染不同类型的苹果叶片为材料,使用RT-PCR法和特异性引物(表1)对4对RPA引物进行特异性分析,反应体系参照1.5中RT-PCR反应体系。此外,其他几种苹果中常见病毒病,如ASSVd(NCBI登录号EU031466),ApMV(RNAs 1-3,NCBI登录号NC003464,NC003465和NC003480)以及李坏死环斑病毒(prunus necrotic ring spot virus,PNRSV;RNAs 1-3,NCBI登录号NC004362,NC004363和NC004364),人工合成后(南京,金斯瑞)作为底物,进行RPA扩增特异性分析,‘嘎啦’苹果脱毒苗的cDNA(CK)作为阴性对照。
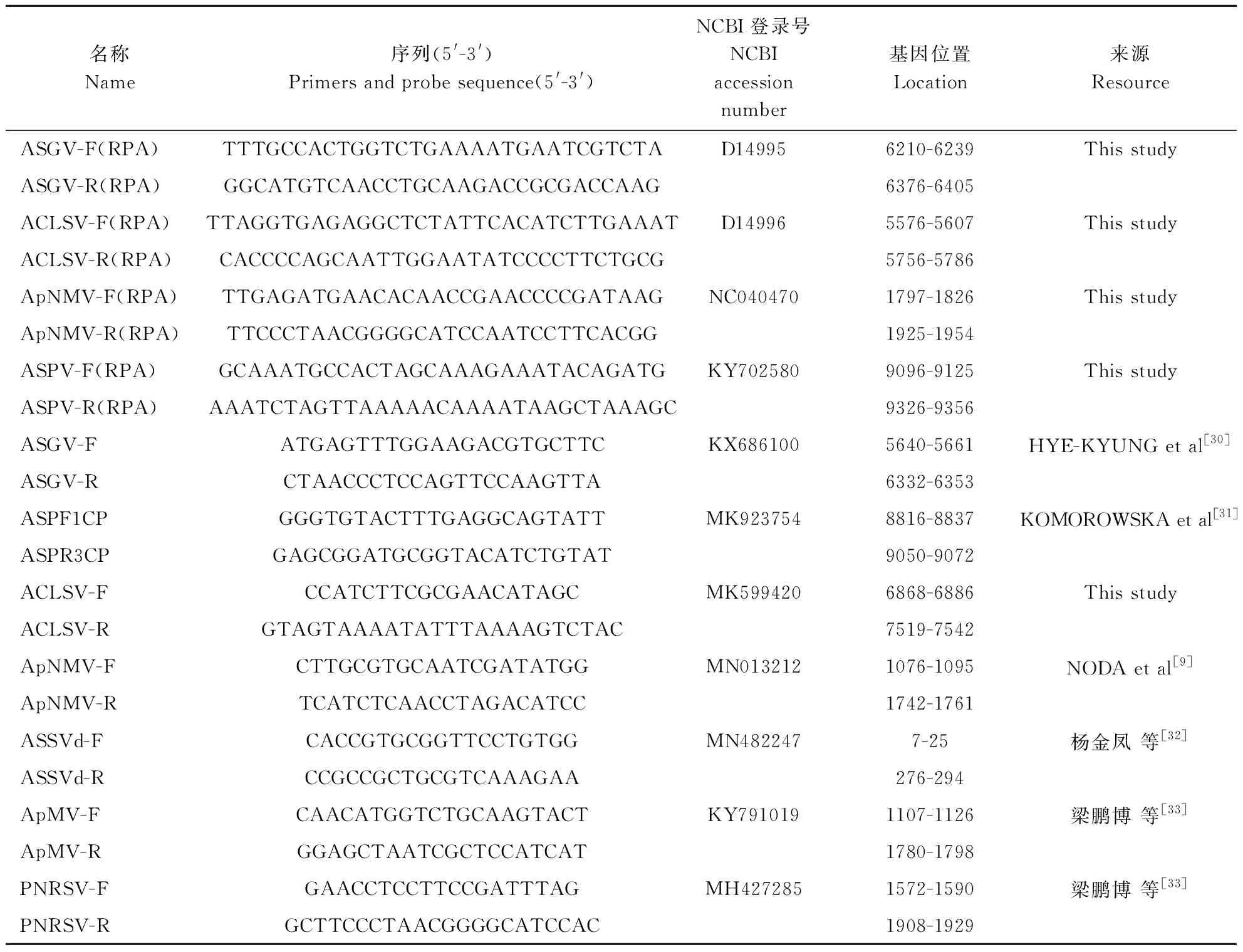
表1 苹果病毒检测所用引物Table 1 Primers used to detect apple viruses
2 结果与分析
2.1 RT-RPA反应体系优化
首先对RT-RPA反应的时间和温度进行优化。相同反应时间,在15~50 ℃区间进行RT-RPA反应,扩增产物经琼脂糖凝胶电泳,结果如图1所示。当RPA反应温度高于25 ℃时,开始有少量扩增;35~43 ℃时,扩增效果无明显差异;25 ℃以下以及50 ℃以上,无扩增。由于要兼顾逆转录反应时所推荐的最佳温度(37 ℃),综合考虑,本试验选择37 ℃为RT-RPA最适反应温度。
M:DNA marker(bp);A:苹果茎沟病毒;B:苹果坏死花叶病毒;C:苹果褪绿叶斑病毒;D:苹果茎痘病毒;N:阴性对照。M:DNA marker(bp);A:ASGV;B:ApNMV;C:ACLSV;D:ASPV;N:Negative control.图1 不同反应温度对4种苹果病毒RPA扩增的影响Fig.1 Effect of different reaction temperatures on RPA amplification of four apple viruses
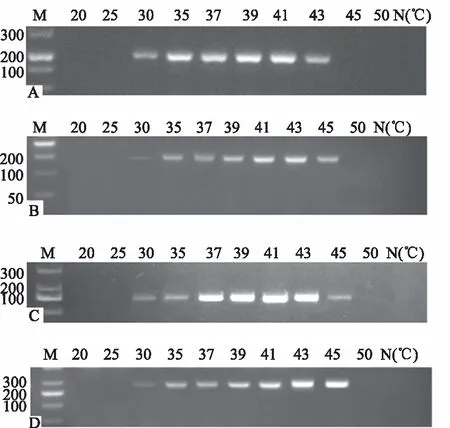
随后在37 ℃条件下,优化RT-RPA反应时间,扩增产物经琼脂糖凝胶电泳,结果如图2所示。反应在10 min后,开始有可观测到的扩增条带;反应时间在20~30 min时,扩增效果较好。因此,本试验将30 min作为最适宜反应时间。综上,最终确定在37 ℃条件下,反应时间为30 min时,RT-RPA反应可达到有效的目标病毒片段扩增。
M:DNA marker(bp);A:苹果茎沟病毒;B:苹果坏死花叶病毒;C:苹果褪绿叶斑病毒;D:苹果茎痘病毒;N:阴性对照。M:DNA marker(bp);A:ASGV;B:ApNMV;C:ACLSV;D:ASPV;N:Negative control.图2 不同反应时间对4种苹果病毒RPA扩增的影响Fig.2 Effect of different reaction time on RPA amplification of four apple viruses
2.2 RT-RPA灵敏度检测
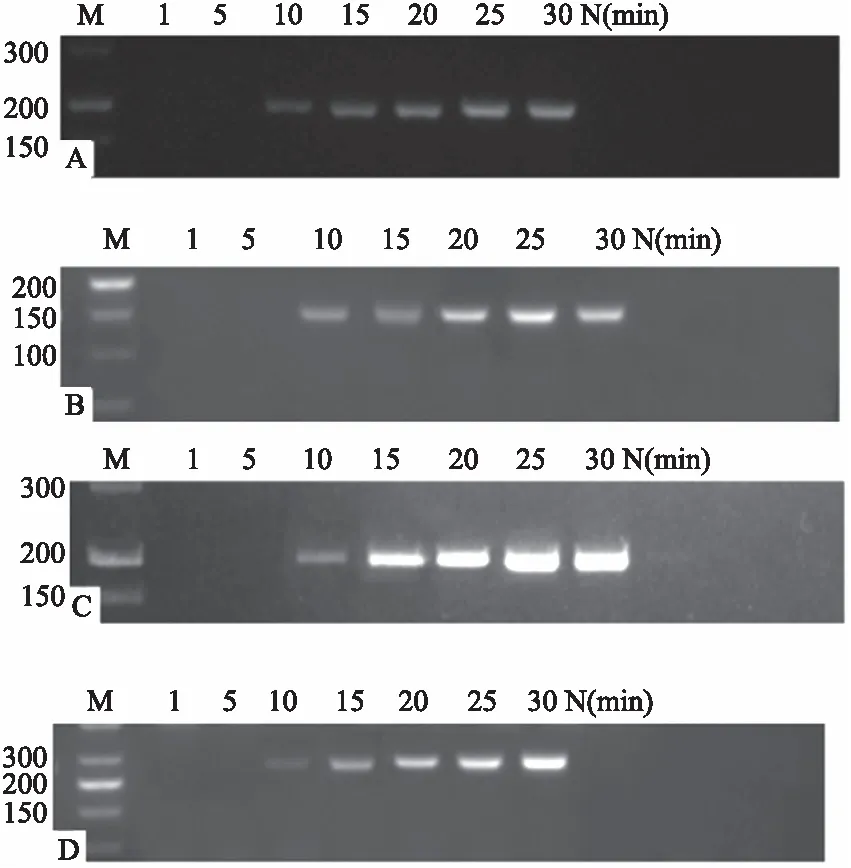
灵敏度检测结果如图3所示,4种苹果病毒的RT-RPA检测灵敏度下限均为9.63×101copies,远高于RT-PCR检测灵敏度,其中ACLSV和ASPV的RT-RPA检测灵敏度比RT-PCR检测灵敏度高100倍,而ASGV、ApNMV的RT-RPA检测灵敏度比RT-PCR检测灵敏度高1 000倍。
M:DNA marker(bp);N:阴性对照。M:DNA marker(bp);N:Negative control.图3 4种苹果病毒的RT-PCR(A)与RT-RPA(B)检测灵敏度比对Fig.3 Comparison of detection sensitivity for four apple viruses between RT-PCR(A)and RT-RPA(B)
2.3 RT-RPA引物特异性分析
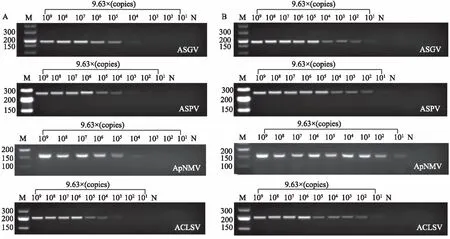
由于自然样本中,苹果病毒多为复合侵染,在使用RT-RPA检测病毒之前,事先采用RT-PCR技术对田间样本的病毒进行检测,挑选出不同的病毒复合感染类型叶片。随后以不同病毒感染类型的苹果叶片cDNA以及人工合成的ASSVd、ApMV和PNRSV病毒为模板,对ASGV、ASPV、ApNMV和ACLSV 4种苹果病毒的RT-RPA引物特异性进行检测。结果显示,4对苹果病毒的RPA引物均能够准确检测出该病毒,与RT-PCR检测结果一致,未出现非特异性扩增(图4)。证明所设计的RPA引物特异性良好,能够对专一病毒进行检测。

M:DNA marker(bp);A:ASPV检测;B:ASGV检测;C:ACLSV检测;D:ApNMV检测;CK:空白对照;√:阳性;×:阴性。M:DNA marker(bp);A:Detection of ASPV;B:Detection of ASGV;C:Detection of ACLSV;D:Detection of ApNMV;√:Positive;×:Negative.图4 4种苹果病毒RPA引物特异性检测Fig.4 Specific detection of RPA primers of four apple viruses
3 结论与讨论
目前,植物病毒诊断大多基于PCR法,这就需要将样品运送到专业机构通过大型、昂贵的仪器进行检测,并且PCR技术往往依赖高质量的核酸提取,这就使得整个检测流程过于复杂。RPA技术不需要高质量的模板,其反应条件简单,不需要复杂的变温仪器,通过合理的特异性引物设计,即可在常温下进行靶标病毒检测[34-36]。本研究针对ASGV、ASPV、ApNMV和ACLSV 这4种病毒,设计了特异性的RPA扩增引物,通过对温度、反应时间以及检测灵敏度等方面的系统优化,建立了特异性强,灵敏度高的RT-RPA新型快速检测方法,能够适用于在条件简陋的情况下快速检测苹果病毒。
在反应时间上,本研究采用的RT-RPA技术比常规RT-PCR在检测时间上缩短了1 h;在灵敏度上,RT-RPA比RT-PCR高102~103倍;在反应温度上,37 ℃条件下即可很好地进行扩增。这表明RPA扩增技术可以很好检测低浓度病毒载量,在病毒感染初期或者苗木病毒检测中,具有明显的优势,随着该技术的广泛应用可以完美替代RT-PCR检测。此外,RPA反应组分以冻干粉末的形式提供,这提高了检测试剂的稳定性,使得该过程易于遵循,并防止检测被污染。
目前,采用RPA技术检测苹果病毒病的研究相对较少,KIM等[27]根据梨树中ASGV病毒分离物的CP区域设计出了能够检测ASGV的RPA引物,但经过序列比对分析后发现,该引物设计区域保守性较差,可能无法满足变异ASGV病毒的检测。本研究针对ASGV、ASPV、ApNMV和ACLSV 4种病毒,通过不同病毒分离物的序列比对,设计出了特异性RPA引物,可以满足这4种病毒的特异性检测,效果显著。虽然本研究采用的是琼脂糖电泳检测阳性结果,但设计的引物也可以结合侧向流动试纸条或者荧光检测技术进行应用。
综上所述,RT-RPA有可能在田间直接进行病毒检测,有助于及时根除感病植株,从而最大限度地降低病毒传播相关的风险。鉴于RT-RPA检测技术的准确性和实用性,建议进一步加大RT-RPA技术在苹果病毒检测方面的研发。
