锌指蛋白703在卵巢上皮性浆液性肿瘤中的表达及临床意义
2022-01-20王爽汪彩霞李潇刘鸥萱胡悦欣勾睿聂鑫郭骞朱连成林蓓
王爽,汪彩霞,李潇,刘鸥萱,胡悦欣,勾睿,聂鑫,郭骞,朱连成,林蓓
(1.中国医科大学附属盛京医院妇产科,沈阳 110004;2.辽宁省母胎医学重点实验室,辽宁省妇产科学重点实验室,沈阳 110004;3.四川大学华西第二医院妇产科,成都 610041)
卵巢癌是死亡率最高的妇科恶性肿瘤,其发病隐匿,早期缺乏特异的诊断方法,大部分患者被确诊时已处于肿瘤晚期,并且在世界范围内,卵巢癌发病率仍呈上升趋势[1-2]。上皮性浆液性肿瘤是卵巢恶性肿瘤中最常见的类型之一。锌指蛋白703(zinc finger protein,ZNF703)属于NET/Nlz家族成员,是一种具有“指状”结构域的转录因子[3]。在生理情况下,ZNF703调控胚胎发育过程,如脊椎动物后脑分化为菱脑节及非洲爪蟾神经嵴等[4-5]。目前的研究证实,ZNF703在乳腺癌[6]、肺癌[7]、胃癌[8]中的表达异常升高,有促进肿瘤进展的作用。
1 材料与方法
1.1 标本来源
卵巢组织样本共81例,包括其中卵巢上皮性浆液性肿瘤45例(浆液性癌组),卵巢上皮性浆液性交界肿瘤12例(交界组),卵巢上皮性浆液性良性肿瘤13例(良性组)和正常卵巢组织11例(正常组)。样本取自中国医科大学附属盛京医院妇科2008年至2014年间住院患者手术标本存档蜡块,所有病例术前均未经过化疗、放疗或激素治疗,且具有完整的临床信息。正常的卵巢组织来自非育龄患者,因宫颈部病变而接受了全子宫切除术。结果由2位不知情的高年资病理医师独立判断,如有异议由第3位病理医师判定。各组年龄比较,差异无统计学意义。本研究获得中国医科大学附属盛京医院伦理委员会批准,伦理批号:2019PS450K。
1.2 主要试剂
鼠抗人ZNF703抗体(sc-271896购自美国SantaCruz公司),鼠兔通用型免疫组织化学试剂盒及DAB显色试剂盒购自福州迈新生物公司,苏木素购自上海碧云天生物技术公司。
1.3 检测方法
石蜡切片为5 μm厚度连续切片。其中,以ZNF703阳性表达的肾上腺组织切片为阳性对照,以磷酸盐缓冲液(phosphate buffered saline,PBS)代替一抗作阴性对照片,ZNF703单克隆抗体作用浓度为1∶50。脱蜡后,采用免疫染色通透液(Triton X-100,P0096,Beyotime)通透,染色方法按链霉菌抗生物素蛋白-过氧化物酶连接法试剂盒说明书进行。
1.4 染色结果判定标准
结果以细胞核、细胞质有棕黄色颗粒着为阳性。按着色强度分为不着色、浅黄色、棕黄色及棕褐色,并分别记分为0、1、2及3分;着色细胞所占视野的百分比为<5%,5%~<25%,25%~<50%,50%~75%及>75%分别记为0、1、2、3及4分。2项相乘得到最终评分,0~2分为(-),3~4分为(+),5~8分为(++),9~12分为(+++)。由2位观察者分别阅片控制误差。
1.5 统计学分析
采用SPSS 22.0软件系统进行统计分析,计数资料采用χ2检验及 Fisher确切概率法,计量资料采用单因素方差分析。2组之间的统计差异通过t检验进行比较,2组以上比较采用单因素方差分析。Kaplan-Meier曲线用于生存分析。P< 0.05为差异有统计学意义。
2 结果
2.1 ZNF703在各组卵巢组织中的表达
为了评估卵巢浆液性肿瘤患者中ZNF703的表达,本研究对临床标本的石蜡切片进行了免疫组织化学染色。结果显示,ZNF703主要表达于卵巢组织的细胞核中,在细胞质中也有表达(图1)。卵巢浆液性癌组阳性表达率和高表达率分别为86.7%(39/45)和62.2%(28/45),高于交界组[66.7%(8/12)和33.3%(4/12),P均>0.05],显著高于良性组[46.2%(6/13)和7.7%(1/13),均P< 0.05]和正常[27.3%(3/11)和0%(0/11),P均<0.001]组。在卵巢交界性浆液性肿瘤组中,ZNF703阳性表达率为66.7%(8/12),高表达率为33.3%(4/12),高于良性组[46.2%(6/13)和7.7%(1/13)]和正常组[27.3%(3/11)和0%(0/11)](P均>0.05),见表1。

表1 ZNF703在各组卵巢组织中的表达Tab.1 ZNF703 expression in various ovarian tissue types
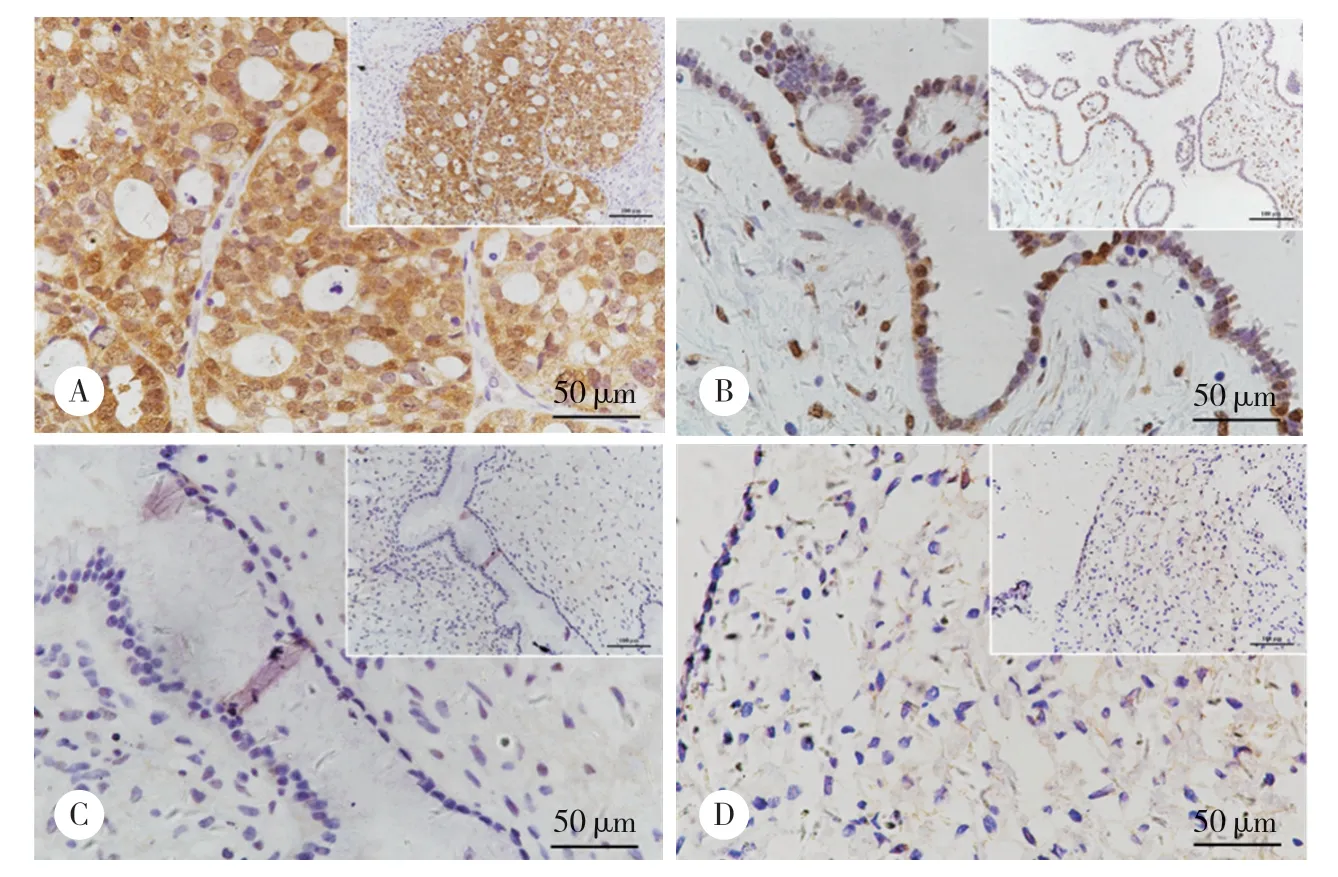
图1 ZNF703在各组卵巢组织中的表达情况Fig.1 ZNF703 expression in ovarian tissues samples
2.2 ZNF703表达与卵巢浆液性恶性肿瘤临床病理参数的关系
将45例卵巢浆液性癌分为ZNF703高表达组(++/+++)和ZNF703低表达组(-/+),ZNF703的表达与临床病理病理参数的关系如表2所示,ZNF703的表达与临床病理分期相关(P< 0.05)。但ZNF703表达水平与淋巴结转移及分化程度均无明显相关性,差异无统计学意义(P> 0.05)。

表2 ZNF703表达与卵巢浆液性恶性肿瘤临床病理参数的关系Tab.2 Relationship between ZNF703 expression and clinicopathological parameters of ovarian serous malignant tumors
2.3 ZNF703的表达与卵巢浆液性恶性肿瘤患者预后的关系
对45例卵巢恶性肿瘤患者进行随访,Kaplan-Meier生存分析结果显示,高表达ZNF703的卵巢浆液性癌患者总生存期较ZNF703低表达的患者短(P=0.011)(图2A)。免疫组化评分如图2B所示。同时,查阅Oncomine数据库,发现ZNF703在多种肿瘤中均为高表达,在卵巢癌中尚无研究(图2C)。进一步采用Cox回归分析探讨不同临床病理参数及指标与预后的关系,单因素分析结果显示,ZNF703的高表达、临床分期及淋巴结转移是影响卵巢癌患者预后的危险因素,ZNF703的表达越高,其预后越差(P< 0.05),将三者纳入多因素分析后发现临床FIGO分期是患者预后的独立危险因素。这些结果表明ZNF703表达水平在卵巢癌组织中表达上调且与不良预后相关。见表3。
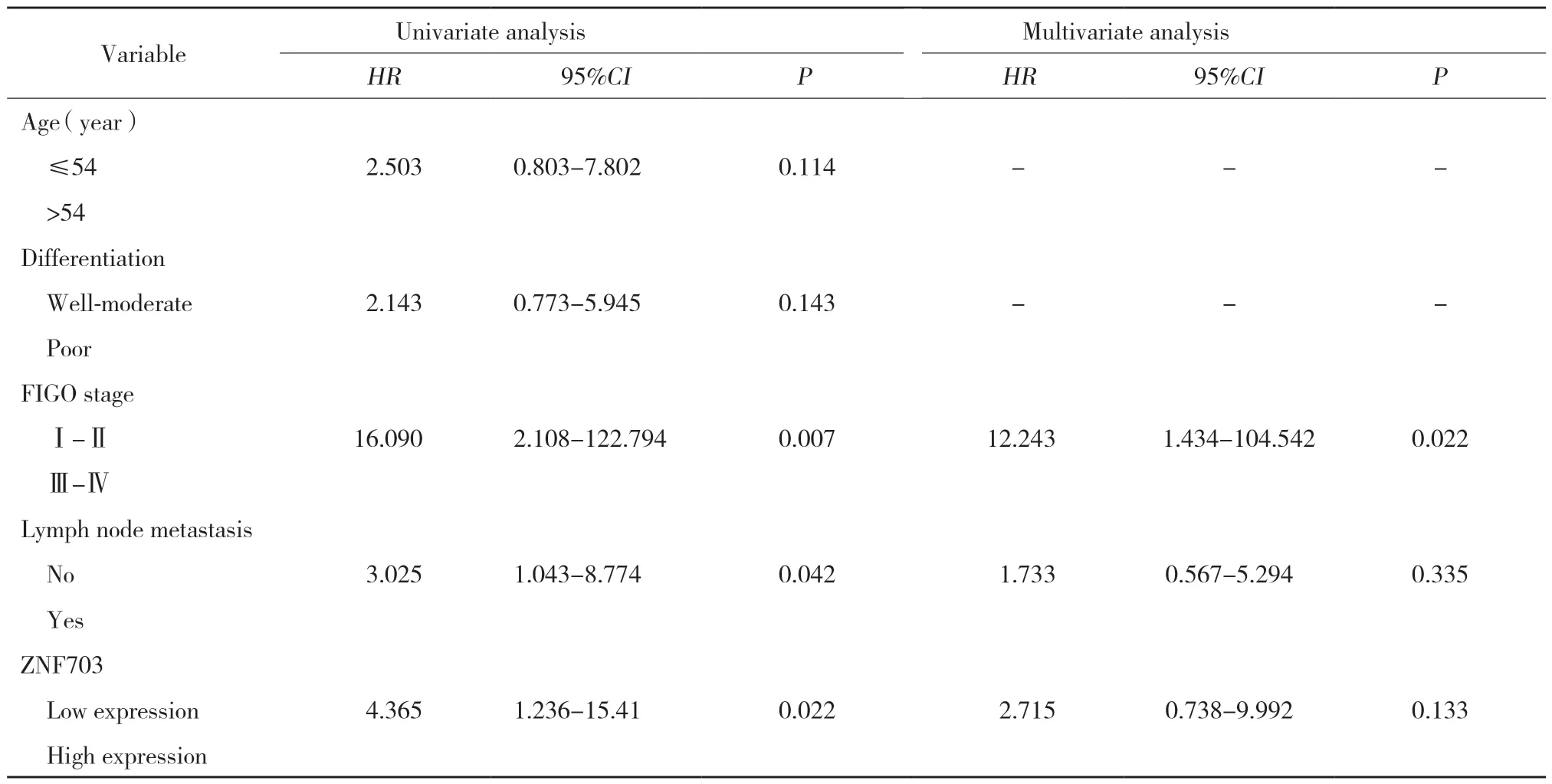
表3 卵巢浆液性癌不同临床病理参数的单因素和多因素Cox分析Tab.3 Univariate and multivariate Cox analyses of different clinicopathological parameters in ovarian serous cancer
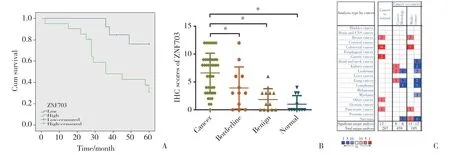
图2 ZNF703免疫组化统计及数据库结果Fig.2 Immunohistochemistry statistical analyses and database results for ZNF703
3 讨论
卵巢癌是恶性程度最高的妇科肿瘤,发现时往往处于晚期,患者生存时间短、预后差。转录因子在基因表达调控中起到核心作用,主要表现在通过影响转录复合物的形成及活性来控制染色质的基因转录和空间结构,进而调节如细胞分化、发育、细胞代谢、细胞凋亡与自噬、血管生成及干性维持等许多生物学过程,在基因表达调控中起着核心作用,其发挥作用的主要机制是通过锌指结构与基因中启动子或增强子的特异性结合域序列进行结合,并形成转录复合物激活或抑制转录[9]。
ZNF703是一种转录因子,属于NET/NlZ家族成员,定位于8p11.23,主要分布于细胞核。ZNF703及其同系物有6个进化保守域,这些特定结构域对于 NET/NlZ蛋白正确的亚细胞分布和转录抑制作用是必需的。ZNF703在早期中胚层与神经嵴和基板发育中具有不同且可分离的功能。其作为转录因子Pax3和Zic1的靶标,促进非洲爪蟾神经嵴的形成。SIRCOLOMB等[10]发现ZNF703抑制转化生长因子-β受体的活性及E钙黏蛋白的表达,从而促进细胞的增殖及迁移,减少细胞间黏附。在结直肠癌中,体外细胞研究[11]表明ZNF703促进肿瘤细胞侵袭。ZNF703在胃癌浸润组织中高表达并与浸润深度和淋巴结转移相关。在甲状腺癌中的研究也得到了相同的结论。
ZNF703对肿瘤的恶性进展发挥着重要且机制多样化的作用。1项关于乳腺癌的研究[12]揭示了上游分子lncRNA SPRY4-IT1通过调节ZNF703促进乳腺癌细胞增殖。不仅如此,同样的机制也在食管鳞状细胞癌中得到验证。另一方面,在肺腺癌中发现了ZNF703的上游调节通路。同样的,在胃癌中,miR-491-5p调节ZNF703,LBX2-AS1被认为上游调节分子。在头颈部鳞状细胞癌中,ZNF703过度表达可能与PI3K/AKT通路的激活或者拷贝数变异有关[13-14]。同样的,在甲状腺髓样癌中ZNF703通过AKT/mTOR通路促进癌细胞在体内外的增殖[15]。ZNF703可以通过激活AKT-mTOR通路参与非小细胞肺癌的发生发展过程[7]。
也有体内外研究[16]发现ZNF703可以通过PI3K/AKT/GSK-3信号通路促进口腔鳞状癌细胞的生长和转移。已有研究[17]证明卵巢癌组织中ZNF703mRNA高表达,但是研究样本仅限于正常卵巢组织及卵巢癌组织,且没有蛋白水平的验证。本研究应用临床标本发现ZNF703蛋白在卵巢浆液性癌组织中过表达,表达水平明显高于交界组、良性组及正常组,并且ZNF703高表达的患者生存时间明显缩短。
本研究结果显示,ZNF703是卵巢癌的预后因素,但并非独立,可能受到很多其他临床因素共同影响,说明ZNF703可以作为临床标志物,与其他标志物一起用于卵巢癌的诊断、治疗及监测。
