ABA-PAM 协同处理对冷胁迫条件下牧草及根际土壤的影响
2022-01-19费雪婷邵欢欢陶灵琳何欣怡倪维敏
费雪婷,邵欢欢,陶灵琳,杨 雯,陶 向,何欣怡,倪维敏,雍 彬
(四川师范大学 生命科学学院,四川 成都 610101)
草地生态系统是最重要的陆地生态系统之一,近年来草原大面积盐渍化、沙化、退化,使我国草原生产力急剧下降,其中又以青藏和川西北等高纬度、高海拔地区草地退化现象尤为严重,对我国生态环境构成严重威胁,并制约了社会经济的持续、稳定、健康发展[1-4].高寒地区植被通常较低矮,生物量低,生物群落结构简单,抗干扰和自我恢复能力低.有研究发现,高寒草地植被生长的限制因子是温度[5].
多年来“人口增长—牲畜数量增加—草地过载—草地退化—生态失衡”的恶性循环导致西部草地盐渍化、沙化、退化迅速,加之极端气候的影响,草原荒漠化不断蔓延.四川省西北部的高原区作为我国5大牧区之一,地处青藏高原东南缘,草地面积达8.2×106hm2,占四川可利用草地面积的65%[2],是长江水系金沙江、雅砻江、大渡河,以及黄河支流白河和黑河的源头.近30 年来,该区草地沙化面积已达8.7×105hm2,严重影响河流的来水量及水质[3].
聚丙烯酰胺(polyacrylamide,PAM)是一种具有超强吸水和保水能力的保水剂,它可以抑制土壤水分的蒸发,增强土壤的持水功能,因此对沙质土壤水分的调控具有重要作用[6-7].利用保水剂可以提高退化土地的土壤含水量,促进植被生长[8].
植物激素脱落酸(abscisic acid,ABA)最早因其可促使植物叶片脱落而得名,且长时间被认为是一种生长抑制物质.随着研究的不断深入,人们发现ABA在植物的整个生长发育过程中发挥着重要的调控作用,是植物非生物胁迫相应的调控中心[9-11].遭受环境胁迫后,植物通过调节ABA 生物合成与降解的动态平衡,提升体内ABA含量[12-13].大量的研究表明外施ABA 抑制种子萌发,能提升植株的胁迫敏感性[14-15].同时,也有研究报道外施低浓度ABA可有效降低植物的抗逆性与病害发生率[16-19],其中施加外源ABA 可以显著提高植株的抗寒性[20-21].祝长龙等[18]研究发现,外施ABA 提升植物胁迫敏感性的前提是ABA 浓度高于阀值,当浓度低于阀值时并不会导致胁迫敏感性的提升.因此,近年来ABA 也被称为“逆境胁迫激素”、“抗逆诱导信使”.然而,因为植物体内浓度低、分离纯化成本高等原因,长期以来ABA 价格高昂,难以应用于生产实践中.谭红等[22]从灰葡萄孢霉菌中分离鉴定到诱抗活性产物脱落酸,通过发酵ABA 产量>1 g/L,大大降低了ABA 的市场价格,基于此研发的生物农药“S-诱抗素”已实现了工业化生产及数百万公顷的大田推广.然而,目前针对脱落酸对植物抗逆性影响的研究以及保水剂对退化草地的修复的研究较多,但脱落酸-聚丙烯酰胺(ABAPAM)协同修复退化草地植被目前还没有相关研究.
本研究以青藏高原地方草种青海冷地早熟禾为材料,基于盆栽试验,研究了冷胁迫条件下ABAPAM协同处理对青海冷地早熟禾植株生长及根际土壤环境状况的影响.研究结果为ABA-PAM协同处理在高寒草地恢复中的应用奠定了理论基础.
1 材料与方法
1.1 实验材料实验所用沙化土壤取自四川省若尔盖县辖曼镇沙化草地,取样地海拔3 500 m,气候特点为冬春季长且严寒多风,夏秋季短而多雨潮湿.实验所用牧草为青藏高原地方草种冷地早熟禾.
1.2 方法
1.2.1牧草盆栽 将采集的沙土用40 目筛子筛除植物残根、落叶等杂质,装入口径13 cm ×13 cm的方形花盆,每盆沙土2.5 kg,并均匀分成2 组(每组12 盆),其中一组沙土按照8 g/m2的用量均匀拌入PAM.按照0.3 g/盆的用量准确称取健康饱满的冷地早熟禾种子,与盆中上层土壤混合均匀,浇水100 mL,在光照培养箱中以温度25 ℃、光周期16/8 h条件培养.播种后每5 d 浇水一次,浇水量为100 mL/次/盆.待牧草生长至约5 cm时,-10 ℃冷胁迫16 h.随后分别将施加PAM和未施加PAM的2 个实验组再均分为2 组(每组6 盆),对其中一组按450 L/hm2(30 L/亩)的用量喷施2 mg/L ABA,对照组喷施等体积蒸馏水,每12 d 喷施一次,共喷施3 次.
1.2.2牧草生长参数测定 牧草种子萌发后每隔7 d对牧草高度进行测量.实验结束后将冷地早熟禾整株拔出,洗净,去除多余沙土,用吸水纸吸干水分,于电子天平上称量冷地早熟禾苗的鲜质量、根质量,并测定其根部长度及株高.将冷地早熟禾的根系用清水洗净,剪刀剪下后放入装有清水的培养皿中,用尖头镊子将聚集的根系拨开,置于根系扫描仪(LA2400,Regent)中进行扫描,以RootAnalysis根系分析软件进行根系表面积分析.
1.2.3叶片生理生化测定 叶片洗净后液氮速冻备用.叶片的过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malonaldehyde,MDA)和过氧化氢(H2O2)、脯氨酸、叶绿素含量等的以南京建成科技有限公司的检测试剂盒进行测定,试剂盒对应货号分别为:A007-1-1、A084-3-1、A001-1-2、A003-1-2、A064-1、A107-1-1、A147-1-1,测定方法参照试剂盒使用说明书.
1.2.4土壤理化性质测定 土壤中碱性蛋白酶、脲酶、中性磷酸酶、酸性磷酸酶、多酚氧化酶、蔗糖酶等酶活性采用索莱宝土壤酶活试剂盒测定,试剂盒对应货号分别为:BC0885、BC0125、BC0465、BC0145、BC0115、BC0245,测定方法参照试剂盒使用说明书.
1.2.5土壤微生物测定 称取5 g 土壤,置于45 mL无菌水中,稀释后0.1 mL 涂布于不同培养基中,观察、统计细菌、真菌、放线菌数量.细菌培养采用LB固体培养基,真菌培养采用孟加拉红固体培养基,放线菌培养采用高氏固体培养基,计数方法采用稀释涂抹平板法.微生物数量以每克样品的菌数来表示:

2 结果与分析
2.1 ABA-PAM 协同处理对植株抗冻能力的初步分析冷地早熟禾种子萌发并生长至高度5 cm后,-10 ℃冷胁迫16 h,结果显示ABA-PAM 协同处理的试验组植株(图1D)生长效果优于对照组(图1A),添加了PAM 但是未喷施ABA 的试验组效果不明显(图1C),未添加PAM仅喷施了低浓度ABA的试验组效果不太理想.结果表明ABA-PAM协同处理可以在一定程度上提高植物的抗冻能力.

图1 冷胁迫下ABA-PAM协同处理后植株生长情况Fig.1 Plant growth after ABA-PAM synergistic treatment under the cold stress
2.2 ABA-PAM 协同处理对牧草植株生长的影响为分析ABA和PAM的施用对冷地早熟禾植株生长的影响,分别对植株株高、鲜质量、根长、根表面积进行检测(表1).结果表明:冷胁迫处理时,用PAM的实验组中ABA喷施株高可达(8.84±0.11)cm,而未喷施ABA的实验组株高为(7.74 ±0.21)cm,这说明相比单独的ABA处理,ABA-PAM协同处理可促进植株的生长.此外,ABA-PAM协同作用后植株叶片鲜质量、根系表面积分别为(0.92±0.19)g和(0.43±0.13)cm2,较对照组和单独施用ABA或PAM组均显著增加.ABA-PAM协同处理组的根长为(7.40 ±0.09)cm,显著高于ABA((6.78±0.11)cm)或PAM((5.72±0.34)cm)单独施用组,但略低于对照组((7.58 ±0.54)cm).
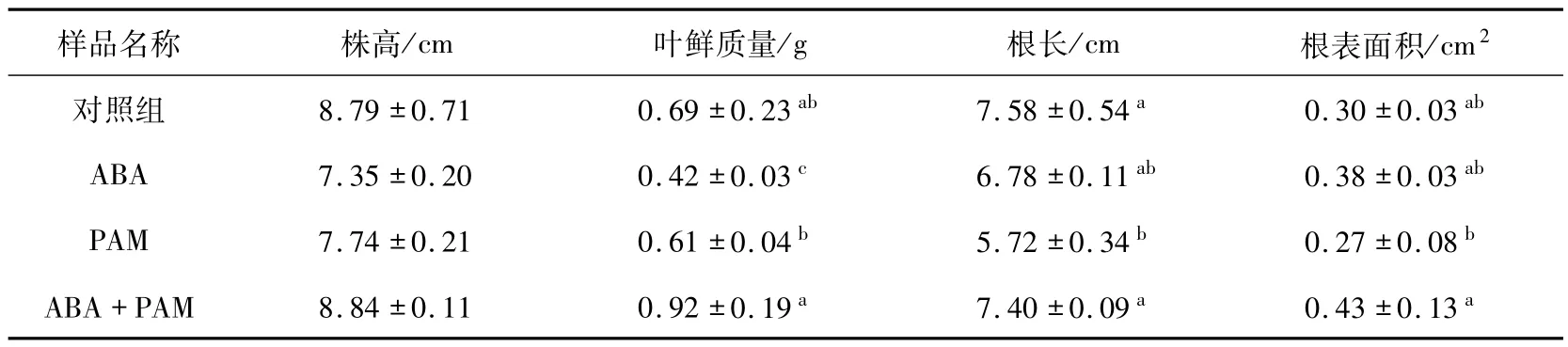
表1 ABA-PAM协同处理对株高、鲜质量及根系的影响Tab.1 Effects of ABA-PAM treatment on the plant height,the fresh weight and the root system
2.3 ABA-PAM 协同处理对叶片生理生化指标的影响植物组织中CAT、SOD、POD酶活性及MDA、脯氨酸含量是影响植物抗逆和抗氧化等能力的重要指标.冷地早熟禾经冷胁迫处理,喷施ABA 后CAT、POD 和SOD 酶活分别为(7.20 ± 0.68)、(51.97 ±0.26)、(108.33 ±1.98)U/mg prot,较对照有显著增加((4.24 ±1.36)、(45.87 ±0.68)、(86.57 ±0.82)U/mg prot),如图2 所示.
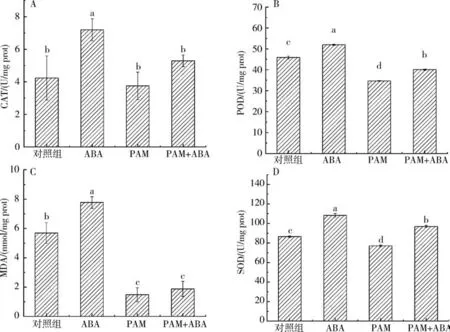
图2 ABA-PAM协同处理对叶片生理生化指标的影响Fig.2 The effect of ABA-PAM cotreatment on physiology and biochemistry of the leaf
土壤中单独施用PAM 可能对叶片CAT、POD和SOD酶活无促进作用,但ABA-PAM协同处理组的CAT((5.29±0.36)U/mg prot)和SOD((96.96±1.00)U/mg prot)酶活均较对照组、PAM单独施用组高.可见在冷胁迫处理后喷施ABA 可提高植株叶片内CAT、POD、SOD活性,植株可以表现出更高的抗氧化保护酶活力.单独施用PAM及ABA-PAM协同处理后牧草叶片丙二醛质量分数分别为(1.48 ±0.48)和(1.87 ±0.52)nmol/g prot,其质量分数相比对照组((5.70 ±0.71)nmol/g prot)及ABA单独施用组((7.78 ±0.39)nmol/g prot)显著降低.脯氨酸作为蛋白质组成的基本氨基酸之一,其游离态广泛存在于植物体内,脯氨酸含量的高低可反映植物抗逆性的强弱.在冷胁迫处理后,ABA-PAM协同处理可促使脯氨酸的积累,其质量分数为(218.90 ±6.25)μg/g,高于对照组及ABA和PAM单独施用组(图3).叶绿素与植物生长存在密切的联系,ABA-PAM 协同处理的牧草叶片中叶绿素质量分数为(13.96 ±0.50)mg/g,与ABA((9.55 ± 0.71)mg/g)、PAM((11.97 ±1.76)mg/g)等单独施用组相比显著增加.
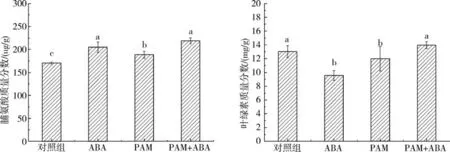
图3 ABA-PAM协同处理对脯氨酸、叶绿素的影响Fig.3 The effect of ABA-PAM cotreatment on the proline and the chlorophyll
2.4 ABA-PAM协同处理对土壤酶活的影响土壤中的蔗糖酶可将蔗糖分解为植物和微生物可利用的葡萄糖和果糖,因此可作为评价土壤肥力的重要指标.冷地早熟禾经冷胁迫后,单独施用ABA 或PAM均可增加蔗糖酶的活性,活性分别为(132.42 ±2.82)U/g、(108.70 ±8.56)U/g,而ABA-PAM 协同处理条件下蔗糖酶活力最高可以达到(133.63 ±6.27)U/g(图4A).多酚氧化酶可催化芳香族化合物转化为醌,醌与土壤中的蛋白质、氨基酸等物质可反应生成有机质和色素,因此多酚氧化酶可用于土壤环境修复.本研究发现单独施用PAM 可显著增加多酚氧化酶酶活,单独施用PAM及ABA-PAM协同处理后叶片的多酚氧化酶酶活性分别达到(842.62 ±4.52)U/g 和(850.45 ±9.04)U/g,较对照组((730.45 ±7.83)U/g)和ABA 单独施用组((722.63 ±20.71)U/g)有较为明显的提升(图4B).作为水解尿素过程中的关键酶,土壤脲酶的酶促作用产物为氨和碳酸,因此土壤脲酶活性可反应土壤无机氮供应能力.结果显示单独喷施ABA 后脲酶活性为(0.069 ±0.008)U/g,活性显著高于其余3个实验组((0.044 ±0.009)、(0.045 ±0.020)、(0.044 ±0.006)U/g)(图4C).磷酸酶的酶促作用可使土壤中有机磷化合物或无机磷酸盐转化成可供植物吸收的无机态磷,可作为表征土壤磷转化和植物磷吸收的重要指标.冷胁迫处理后,单独施用ABA、PAM或联合施用PAM和ABA对磷酸酶酶活无显著影响(图4D和图4E).土壤蛋白酶参与土壤中蛋白质的水解,其产物可作为植物氮源之一.研究结果显示,在冷胁迫处理后施用PAM 酶活为(0.86 ± 0.12)U/g,显著高于对照组((0.59 ±0.01)U/g)、ABA单独施用组((0.53±0.01)U/g),而ABA-PAM协同处理后叶片的土壤蛋白酶活性为(0.76 ±0.03)U/g,可见喷施ABA 对土壤蛋白酶活性无显著影响,但PAM 的施用可以提升土壤蛋白酶的酶活(图4F).
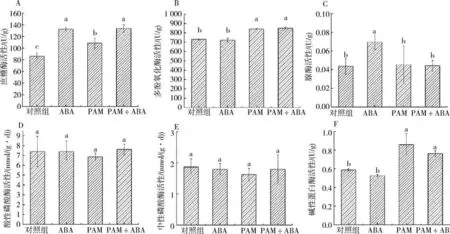
图4 ABA-PAM协同处理对土壤相关酶的影响Fig.4 Effects of ABA-PAM cotreatment on soil related enzymes
2.5 ABA-PAM 协同处理对土壤微生物的影响使用稀释涂布平板计数法对种植冷地早熟禾并经冷胁迫的土壤中的微生物数量进行测定,结果发现ABA单独施用组、PAM单独施用组和ABA-PAM协同处理的土壤中的真菌、放线菌、细菌数量均高于对照组.从真菌数量来看,ABA单独处理组的数量最高,达到(514.25±48.79),其次为ABA-PAM协同处理组(341.33±37.29)和PAM处理组(227.00 ±27.36);从放线菌数量来看,PAM单独处理组数量最高,达到(207.00±3.92),其次为ABA 单独处理组(182.75 ±20.17)和ABA-PAM协同处理组(152.00 ±13.34);从细菌数量来看,ABA单独处理组数量最高(450.25±7.89),其次为PAM 单独处理组(260.75 ±6.65)和ABA-PAM协同处理组(200.25±2.63).如表2所示.
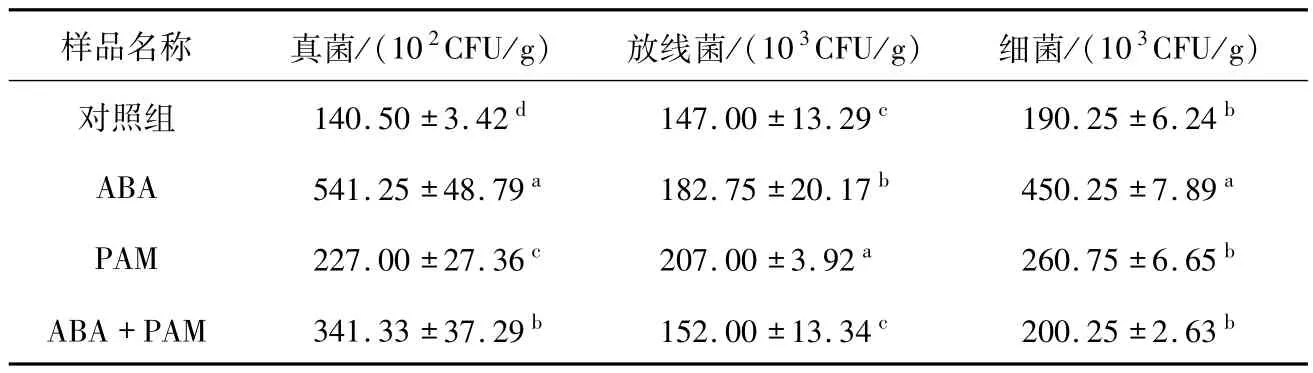
表2 ABA-PAM协同处理对土壤微生物的影响Tab.2 Effects of ABA-PAM cotreatment on soil microorganisms
3 讨论
川西北高寒草地是长江和黄河上游重要的生态屏障,在高原地区的水土保持、区域气候调节和生物多样性保护等方面发挥了重要的作用[2].但是近年来由于人类过度放牧、滥垦滥挖、鼠害加剧及自然条件的改变等因素综合作用下,川西北高寒草地生态系统出现了严重的水土流失、土壤沙化和草地退化等现象,使当地的自然灾害频发,生态平衡出现较为严重的失调现象,而草地的退化进一步制约了该地区畜牧产业的发展[23].除人为因素外,川西北高寒草地属高原寒温带湿润气候,虽然年均降雨量可达到600~700 mm,但是,一方面由于其常年平均气温在0~4 ℃,影响了牧草的生长;另一方面,降雨量很不均衡,主要集中在5—9 月,冬季降雨量最少,这导致冬季更加干旱,干旱作用会进一步加剧冷胁迫对植物造成的损伤,使牧草更易发生退化,也让草原生态更加脆弱[2].保水剂作为一种强力吸水的凝胶,可以吸收自身重量数百倍甚至上千倍的水分,并通过缓慢释放供给植物的利用与生长,因此可以增加土壤水分、提高土壤肥力、促进植物出苗率和成活率,在农业生产中多有应用[24].
此外,大量研究表明ABA 与植物所遭遇的干早、高盐、低温、损伤、低氧、光照以及病原体侵染等有关,是植物体响应逆境胁迫的重要信号,而外源ABA可能具有通过改变植物的代谢,提升其水分利用率等来提高植物的抗寒性.为了提升牧草对川西北高寒草地特殊的气候的适应能力,本研究通过外源低浓度ABA与保水剂结合使用,并对其生长状态和土壤性质进行了测定.结果发现PAM(8 g/m2)与低浓度ABA(2 mg/L)联合使用的情况下,冷地早熟禾的在冷胁迫时生长效果优于对照组、单独施用ABA或PAM 组,这表明PAM 与ABA 的联合使用可以降低低温胁迫对植物造成的影响作用,从而促进其生长.低浓度的外源ABA 可以提升植物的抗干旱能力,但是施用ABA 对不同的植株品种作用并不相同,有的植株干旱胁迫喷低浓度ABA 后会出现短暂的休眠作用,从而导致其生长速率减慢[25-26],而对有的植株则可以提升其生长作用(如株高、根长和生物量等)[27].此外,郭贵华[26]研究发现如果不进行干旱处理(水分充足),仅喷施低浓度ABA则可以明显促进水稻的生长.
从本研究结果来看,添加PAM 可以明显缓解土壤中的干旱胁迫,同样明显促进了冷地早熟禾的生长作用,而干旱胁迫下喷施ABA 则可能会使冷地早熟禾出现一定的休眠作用,导致冷地早熟禾的生长收到一定的抑制.从CAT、SOD、POD 酶活性测定来看,单独施用ABA的酶活力最高,这与ABA可以在低温胁迫条件下提高细胞内的保护酶系统(如SOD、POD、CAT等)的协同作用来降低活性氧对细胞的伤害有关,而PAM 的添加则可以增加土壤中的水分含量,也有研究发现,随着水分含量的增加,细胞内的保护酶系统的酶活力则会有所下降,因此PAM与ABA的联合使用可能会使其细胞内的保护酶的酶活力低于单独ABA 的使用[28].单独施用PAM及ABA-PAM协同处理后牧草叶片丙二醛含量显著低于对照组和ABA 单独施用组,这可能与土壤水分含量的增加可以降低植物体内的MDA含量有关[29],植物在受到冷胁迫时细胞内游离脯氨酸含量会出现明显的增加,而且耐寒性越好的植物中游离脯氨酸的含量相对更高[30],从脯氨酸含量来看,ABA-PAM 协同处理后牧草叶片中脯氨酸含量最高,对照中脯氨酸含量最低,这表明土壤中水分的含量增加和外源低浓度ABA 的喷施可以有助于提升植物细胞内的脯氨酸含量.有研究发现低浓度的外源ABA可以提升干旱胁迫下植物根际土壤中多种土壤的酶活力,如磷酸酶(中性和酸性)、蛋白酶、脲酶、多酚氧化酶等[27].而本研究也发现喷施了低浓度ABA、PAM单用和ABA-PAM协同处理的蛋白酶、脲酶、多酚氧化酶、蔗糖酶等多种土壤酶活力总体上相比对照相对较高,可见低浓度的外源ABA及PAM施用后对牧草生长的土壤环境中的蛋白酶、脲酶、蔗糖酶、多酚氧化酶等活性有促进作用,这可能与ABA 对植物的生理生化作用的影响对根系分泌改善有关.同时,施用PAM提升土壤的水分含量也有助于提升土壤酶活力,从促进了植物对营养的吸收作用.经施用ABA、PAM 以及ABAPAM协同处理后的土壤微生物的数量均高于对照组,也有研究发现低浓度的ABA 的使用可以一定程度上提升土壤中的细菌、真菌和放线菌的数量[27],但是某些保水剂的使用有可能会降低土壤中微生物的数量[31],这可能与ABA-PAM协同处理后土壤微生物的数量低于ABA 单独处理组有一定的关系.
致谢成都市科技局科技惠民项目(2016-HM01-00046-SF)和四川师范大学“大学生创新性实验计划”项目(S201910636417)对本文给予了资助,谨致谢意.
