一株高效羽毛降解菌株Bacillus aryabhattaiS-2的分离鉴定及酶活力特性研究
2022-01-19倪维敏胡又文陶灵琳费雪婷陈美菊肖秋菊何欣怡邵欢欢
倪维敏,胡又文,陶灵琳,费雪婷,陈美菊,肖秋菊,何欣怡,陶 向,邵欢欢,雍 彬
(四川师范大学 生命科学学院,四川 成都 610100)
近年来,我国的家禽业发展迅速,每年产生的废弃羽毛高达上百万吨[1].大量羽毛废弃物不仅造成了资源的巨大浪费,还污染环境.传统的填埋、焚烧处理不仅生产成本高,还容易造成家禽业各种疾病的相互传染[2-4].
羽毛是一种蛋白质含量高达90%以上的重要蛋白质资源[5],其中角蛋白是广泛存在于羽毛中的一种硬性蛋白,因其含有紧密交联的氢键、二硫键和疏水作用力,因此,在自然条件下降解速度较慢[6-7].目前常采用的处理羽毛废弃物的物理、化学方法,如高温蒸煮、强压处理和酸碱水解等传统的技术手段,不仅存在着能耗高、降解效率低的问题,还会破坏角蛋白中一些必需氨基酸,造成不必要的资源浪费[3,8-9].生物降解羽毛废弃物的方法更为绿色环保,反应过程温和,且效果显著;在保证羽毛饲料的营养价值不受损耗,节约生产能源的同时,还可得到更为优质的饲料产品[10],对彻底降解角蛋白和对产物进行有效的资源化利用具有极大的现实意义[11].
自然界广泛存在能够降解角蛋白的微生物,如短小芽孢杆菌[12]、枯草芽孢杆菌[13]和苏云金芽孢杆菌[14]等,多个研究表明,它们单独或协同进行固体发酵,均能使羽毛降解率达到80%以上[15].但是这些菌株也存在缺点(如羽毛降解速度慢、培养条件复杂等问题),通常难以进行工业化应用.因此,进一步改造或筛选能够高效降解羽毛的菌株具有重要的研究价值.本研究从成都市的家禽养殖场羽毛堆积处的土壤中筛选分离出了一株具有羽毛降解能力的菌株,通过测序、生理生化检测以及酶活力测定等实验对其进行了鉴定,旨在为羽毛的规模化降解处理,及饲料中添加低成本蛋白质和氨基酸等提供新的思路[16].
1 实验材料与方法
1.1 实验材料
1.1.1样品采集 从成都市的家禽市场附近收集已经出现腐烂的鸡毛及其周围土壤,加入10 mL无菌超纯水震荡,沉淀后取上清液用于后期菌株分离实验.
1.1.2 培养基LB 液体培养基(g/L):0.1 g/mL NaCl、0.05 g/mL酵母浸提膏、0.1 g/mL蛋白胨,调pH介于7.0~7.5 之间.牛奶平板:质量分数1.5%脱脂奶粉、质量分数2%琼脂.发酵培养基:质量分数 0.15% K2HPO4、0.002 5% MgSO4·7H2O、0.001 5%FeSO4·7H2O、0.000 5%ZnSO4·7H2O、0.002 5%CaCl2、羽毛碎片10 mL/0.1 g,pH =7.4.
1.2 实验方法
1.2.1菌株分离、筛选及观察 取1 g 土样,加10 mL超纯水振荡混合后静置沉淀,取上清液1 mL,涂布在以羽毛为唯一碳源的发酵培养基平板上,37 ℃下培养48 h,挑取3 个直径较大的菌落划线接种于LB培养基的平板中,在37 ℃下进行培养24 h,得到单菌落,分别再次接种于仅含有羽毛的发酵培养基中进行筛选,选出生长效果最好的一个菌株,然后将该菌株保存备用.
将筛选出的菌株分离纯化后,划线于固体LB培养基平板中,放在37 ℃的培养箱内,20 h 后,直接用肉眼观察菌落的颜色、形态、大小、表面质地和边缘形态等外部形态特征.取单菌落涂片,革兰氏染色后,用光学显微镜观察菌体形状及大小.
1.2.2生化特征检测 根据杭州滨和微生物试剂有限公司生产的细菌微量生化反应管的使用说明,分别测定菌株对赖氨酸、鸟氨酸、枸橼酸盐、尿素、硫化氢、磷酶、ONPG、棉子糖、戊糖、山梨醇、侧金盏花醇、二磷酶、靛基质、V-P 和苯丙氨酸等的作用,参照《发酵型革兰氏阴性杆菌生化编码鉴定手册》进行初步鉴定.
1.2.3菌株DNA的提取及鉴定 将菌株接种于50 mL LB培养基的锥形瓶中,37 ℃培养一夜,按照Omega Bio-Tek 公司生产的试剂盒Bacterial DNA Kit提取DNA.采用的引物为:
27F:5’-GAGAGTTTGATCCTGGCTCAG-3’/1492R:5’-TACGGCTACCTTGTTACGAG-3’,预计扩增长度为1 500 bp.引物由北京擎科新业生物技术有限公司合成.
序列的测定由北京擎科新业生物技术有限公司完成,测序完毕后,将该DNA序列复制至Blast中进行序列比对,以确定菌株的类别.利用MEGA 6.0软件邻接法[17]构建该菌的进化树,同时将该菌的序列用Ex-Taxon进行在线菌株鉴定.
1.2.4碱性蛋白酶酶活力测定 本实验使用改进的Folin 酚试剂显色法来检测酶活力:1 mL发酵液7 000 r/min,4 ℃离心1 min,取0.2 mL上清液与0.2 mL 质量百分数2%水解酪蛋白标准溶液混合,50 ℃加热10 min,加入0.4 mL质量百分数10%三氯乙酸溶液室温放置20 min,4 ℃12 000 r/min离心5 min,取0.25 mL上清液加到1.25 mL的0.4 mol/L Na2CO4中,50℃加热2 min,0.25 mL福林酚试剂继续加热20 min,使用酶标仪测其680 nm的OD值.
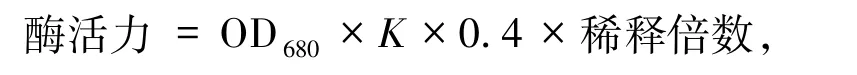
其中k为吸光常数,取值100.
1.2.5羽毛降解率测定 记录初始羽毛的质量,实验组与对照组分别记为m1初和m2初,培养后用细胞过滤器滤下残渣,用烘箱烘至恒质量,记为m1残和m2残,两者的质量之差就是降解部分的质量.
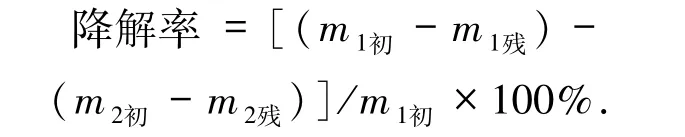
1.2.6牛奶平板水解圈实验 在牛奶平板中均匀地点3 个样,置于37 ℃恒温培养箱内,毎隔24 h观察一次降解情况,用游标卡尺测量菌落直径以及水解圈直径,水解圈直径/菌落直径的比值越大,说明降解效果越好.
1.2.7生长曲线测定 将OD600为1.0 的菌液接种0.2~50 mL的LB培养基中,于37 ℃、180 r/min的摇床中培养76 h,每隔4 h 取样,测波长为600 nm处的OD值,根据OD600值的变化趋势推测菌株的生长状况.
1.2.8发酵条件对酶活力的影响 1)不同的接种量对产酶活力的影响.将OD600为1.0 的菌液以体积分数2%、4%、6%、8%、10%的接种量分别接种于含有0.5 g 羽毛/瓶,且初始pH 为7.0 的50 mL LB培养基中,37 ℃、180 r/min 培养48 h,进行酶活力测定.
2)不同的蛋白底物对产酶活力的影响.取1 mL菌液分别接种于以0.5 g 鸡毛、头发、脱脂牛奶和酪蛋白作为蛋白质底物配制的培养基中,37℃、180 r/min培养48 h,进行酶活力测定.
3)不同的羽毛含量对产酶活力的影响.分别称取0.05、0.25、0.5、0.75 和1 g 的鸡毛用于配制50 mL的LB培养基,接种1 mL 菌液于初始pH 为7.0 的50 mL的培养基中,37 ℃、180 r/min培养48 h,进行酶活力测定.
4)不同的初始pH 对产酶活力的影响.分别调节配制好的50 mL 培养基的初始pH 为6.5、7.0、7.5、8.0、8.5,接种1 mL 的菌液于37 ℃、180 r/min培养48 h,进行酶活力测定.
5)不同的培养温度对产酶活力的影响.接种1 mL菌液到初始pH为7.0,羽毛含量0.5 g/瓶的50 mL培养基中,分别将各个培养基放置在培养温度为20、25、30、35、37 和40 ℃的180 r/min的培养箱内培养48 h,进行酶活力测定.
6)不同发酵培养时间对产酶活力的影响.接种1 mL到初始pH为7.0,羽毛0.5 g/瓶,于37 ℃、180 r/min 的培养箱内分别培养24、48、72、96 和120 h后,进行酶活力测定.
2 结果
2.1 菌落形态该菌株经革兰氏染色后呈现紫红色,为革兰氏阳性细菌.其菌落形态为圆形,颜色淡黄色,表面略微向上凸起,表面湿润,边缘略有缺刻,颜色一致,菌落形态如图1 所示.

图1 菌落形态Fig.1 The colony morphology
2.2 生化特性根据细菌微量生化反应管使用说明书对S-2 菌株的生化特性进行测定,结果发现S-2 菌株能水解赖氨酸、鸟氨酸、尿素和Opng,且V-P反应如表1 所示呈阳性,牛奶平板水解实验也表明其可以有效水解牛奶,菌落形态如图2 所示.
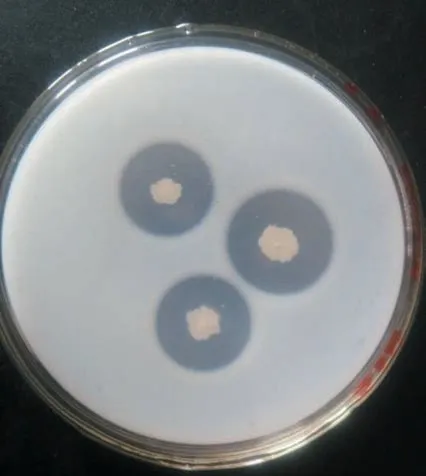
图2 牛奶平板降解圈Fig.2 Degradation rings on the milk plate

表1 分离菌株S-2 的生理生化特征Tab.1 Physiological and biochemical characteristics of isolated strain S-2
2.3 菌株DNA 序列测定及进化树的构建将测序得到S-2 菌株的16S序列进行BLAST比对分析,并利用MEGA 6.0 软件邻接法构建该菌的进化树(图3),发现该菌株与Bacillus aryabhattai QK2 的同源度最高,且亲缘关系最近.同时,通过EzTaxon(www.ezbiocloud.net)进行菌种鉴定,也发现该菌株与Bacillus aryabhattai 菌株的相似度最高,两者相似度高达99.72%.结合该菌株的生化特性和16S序列比对结果,判定该菌株为Bacillus aryabhattai菌株,因此,命名为Bacillus aryabhattai S-2.
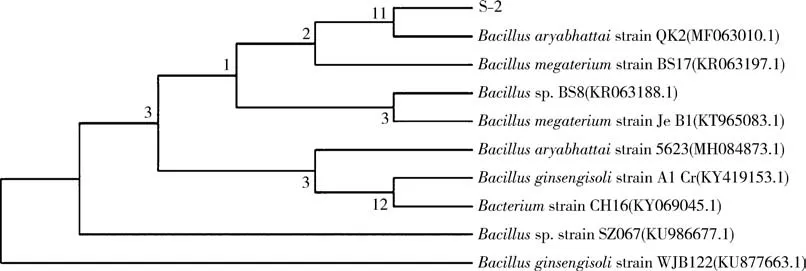
图3 B.aryabhattai S-2 的16S RNA进化树分析Fig.3 The analysis of 16S RNA evolutionary tree of B.aryabhattai S-2
2.4 生长曲线及酶活力测定每隔4 h 对发酵液进行菌液OD600值测定,结果发现B.aryabhattai S-2经过4 h后开始进入指数生长期,并在52 h时达到最大值.同时,对其胞外碱性蛋白酶活力进行测定,结果表明,在生长初期,胞外碱性蛋白酶活力随菌体数的增加而增加,并在48 h 时达到最高值20.1 U/mL,但是在48 h后酶活力快速下降(图4).
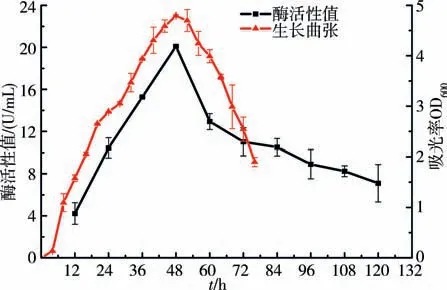
图4 生长曲线及酶活力值Fig.4 The growth curve and enzyme activity values
2.5 羽毛降解率测定使用B.aryabhattai S-2 分别在发酵培养基和LB培养基中对羽毛进行降解处理,相比LB 培养基,B.aryabhattai S-2 在发酵培养基中对羽毛的降解效果更好,在发酵培养基中培养96 h降解率可高达97.2%,而在LB 培养基中则需培养312 h,羽毛降解率才能达到96.6%.这表明B.aryabhattai S-2 可以对羽毛进行高效降解,见图5和图6.

图5 B.aryabhattai S-2 对羽毛的降解作用Fig.5 Feather degradation by B.aryabhattai S-2
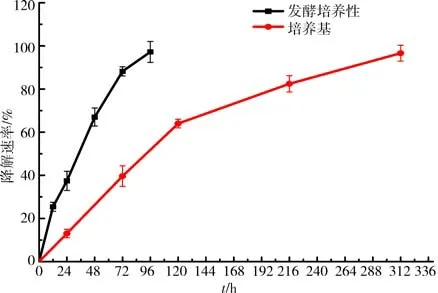
图6 在发酵培养基和LB培养基中的降解率变化Fig.6 Changes of the degradation rate in the fermentation medium and LB medium
2.6 发酵培养条件对产酶活力的影响
2.6.1接种量对产酶活力的影响 将不同体积的菌液接种至培养基中进行酶活力测定,结果发现,接种不同量的B.aryabhattai S-2 酶,活力有较大的差别(图7).当接种量为2%时,该菌株的产酶活力达到最大值23.93 U/mL,并且随着接种量的增加,产酶活力呈现下降趋势.表明相对较低的B.aryabhattai S-2 接种量有助于增加蛋白酶活力.
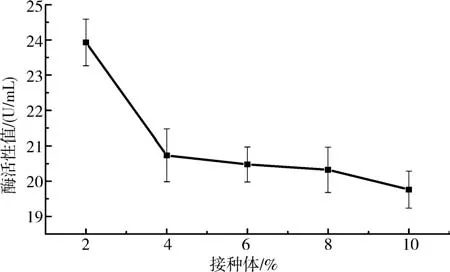
图7 接种量对酶活力的影响Fig.7 The effect of the inoculum size on the enzyme activity
2.6.2 不同初始pH 对产酶活力的影响由图8可知,B.aryabhattai S-2 的产酶活力随初始pH值的变化呈现不同数值,开始随着初始pH 的增加而增加,在初始pH =7 时达到最大值23.44 U/mL;然后呈现减少趋势,在初始pH =8.5 时降低至最小值12.10 U/mL.可见,不同的pH 值对B.aryabhattai S-2菌株的酶活力有一定的影响作用,且该菌株的蛋白酶在偏碱性的环境中具有较高的酶活力.
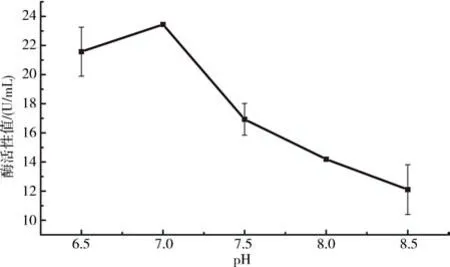
图8 pH对产酶活力的影响Fig.8 The effect of PH on the enzyme production
2.6.3不同发酵时间对产酶活力的影响 将B.aryabhattai S-2 接种至培养基中,每隔24 h 取样,并对酶活力进行测定(图9),结果发现,S-2 菌株的蛋白酶活力在生长初期不断增加,并在48 h时达到最高(20.44 U/mL),随后酶活力开始不断下降,在120 h 时最低为12.40 U/mL.表明该菌株的胞外蛋白酶活力最佳培养时间为48 h.
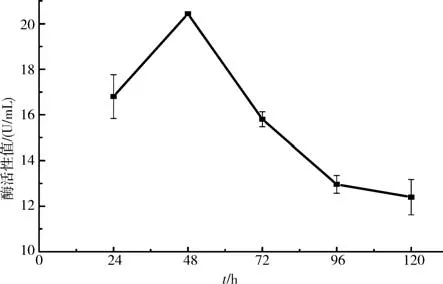
图9 培养时间对产酶活力的影响Fig.9 The effect of the culture time on the enzyme production
2.6.4不同羽毛含量对产酶活力的影响 以不同重量的羽毛(0.250 5 g)作为底物,加入含有S-2 菌株的培养基(50 mL)中进行酶活力测定.结果表明(见图10),在较低羽毛含量培养基中S-2 菌株酶活力会随羽毛含量增加而增加,并在0.5 g/50 mL 时达到最高值21.56 U/mL;随后,酶活力随底物浓度增加而降低.表明该菌株的产酶活力易受到底物浓度的影响.
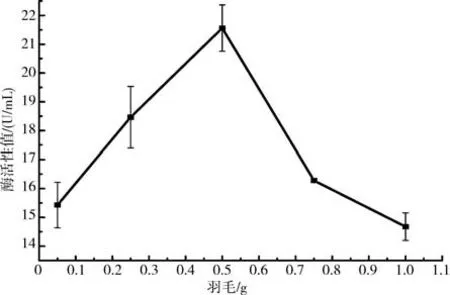
图10 羽毛含量对产酶活力的影响Fig.10 The effect of the feather content on the enzyme production
2.6.5不同蛋白底物对产酶活力的影响 将B.aryabhattai S-2接种至不同蛋白底物中培养48 h,测定酶活力,如图11所示.当蛋白底物为脱脂牛奶或干酪素时,该菌的产酶活力较大,分别为44.53和41.86 U/mL;其次是羽毛做蛋白底物时,该菌的产酶活力为23.26 U/mL;当蛋白底物为头发时,该菌的产酶活力最低,仅有21.59 U/mL.表明B.aryabhattai S-2不仅对羽毛有一定的降解能力,对脱脂牛奶和酪蛋白也均有较高的降解能力,当培养基中蛋白底物不同时,B.aryabhattai S-2的产酶活力也存在着较大差异.
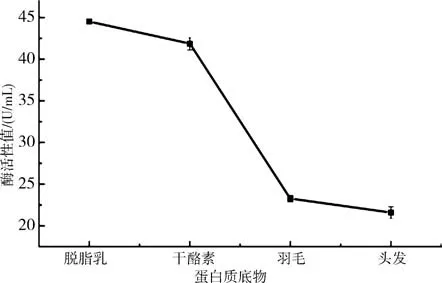
图11 蛋白底物对产酶活力的影响Fig.11 The effect of the protein substrate on the enzyme production
2.6.6不同培养温度对产酶活力的影响 将B.aryabhattai S-2 接种至培养基中,在不同温度条件下培养48 h,结果发现,随着温度的增加,该菌的产酶活力呈现出先升高、再降低的趋势(图12),当温度为37 ℃时,产酶活力最大(22.67 U/mL).可见温度较低时该菌株的活性会受抑制,导致产酶活力较低;而当温度较高时,部分菌株可能因为温度过高而失活,进而导致产酶活力有所下降.这表明,该菌株的产酶活力易受温度影响.
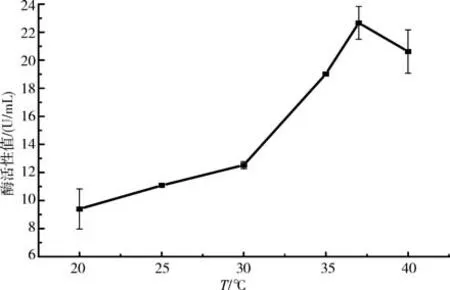
图12 培养温度对产酶活力的影响Fig.12 The effect of the culture temperature on the enzyme production
3 讨论与结论
废弃羽毛的不合理处置对环境危害极大,生物降解法高效且温和的特性是它逐渐发展为近年来热点研究方向的重要因素.早期有关角蛋白降解的研究主要来自真菌及放线菌,如真菌中的白假丝酵母(Candida albicans)和皮肤癣菌,放线菌中的链霉菌(Streptomyces)和高温单胞菌属(Thermomona)都是降解角蛋白的优势菌群[18-19].但是,这部分菌群往往具有致病性或培养条件苛刻,能用于解决废弃羽毛问题的真菌或放线菌并不多[20].
目前,细菌是被研究最多的羽毛降解菌,主要以芽孢杆菌为主.熊乙等[21]将来自地衣芽胞杆菌(Bacillus licheniformis BBE11-1)的角蛋白酶N 端进行替换改造,实现了热稳定性的提高,但是却降低了该酶70%的酶活力.
本研究从土壤中分离得到一株能够高效降解羽毛的菌株,经鉴定为B.aryabhatta S-2.阿氏芽孢杆菌(Bacillus aryabhattai)是土壤中常见的一种芽孢杆菌,对大分子化合物的降解作用较强,而且还可以促进植物对金属离子、干旱与病害等逆境的耐受性,因此,在工业、食品和农业等方面应用较为广泛[22].酶活力测定结果发现,B.aryabhatta S-2 能在20~40 ℃的温度范围内发挥作用,并在35~40 ℃内均具有较高的酶活力.
周童娜等[20]分离筛选到的Arthrobacter aurescens N01,也是一种新型羽毛降解菌,经72 h 发酵后,对羽毛角蛋白的降解率为75%.本研究筛选得到的菌S-2 在培养72 h 后降解率高达88.2%,且酶活力也高于A.aurescens N01.部分降解羽毛菌株的发酵条件较为苛刻,杨连[16]筛选得到的B.amyloliquefaciens K11,最适温度高达50 ℃,且最适pH 为11,偏碱性.B.aryabhattai S-2 的培养条件则较为温和,在温度37 ℃,pH =7.0 时即可达到最大酶活力,且对羽毛的降解率较高.因此,B.aryabhattai S-2 可以在羽毛降解的应用中发挥重要的作用.
综上所述,本研究分离得到了一株能够高效降解羽毛的阿氏芽孢杆菌B.aryabhattai S-2,并对降解能力及最适温度和pH 值等多个方面进行了初步探究.迄今为止,国内外还未见该菌用于降解羽毛角蛋白的相关报道,为未来深入研究降解机制及其工业化应用奠定了基础.
