热水处理对近冰温贮藏鲜枣品质提高与膜脂代谢的相关性分析
2022-01-19李君兰刘志芳
李君兰,刘志芳,南 勇
(1.河西学院乡村振兴研究院, 甘肃张掖734000;2.甘肃省河西走廊特色资源利用重点实验室, 甘肃张掖734000;3.河西学院农业与生态工程学院, 甘肃张掖734000)
低温贮藏是采后果蔬保鲜最有效且应用最广泛的技术之一,近冰点温度是生物过冷点和生物凝固点之间的非凝固点温度范围。当果蔬在接近冰点的温度下贮藏时能最大程度地保持低呼吸速率和降低其它生化反应速率,从而能够较长时间地保持果蔬品质新鲜,是一种安全的非冻结保鲜技术[1]。然而在近冰点温度贮藏和运输时果蔬极易诱发冷害,导致果蔬及早发生生理代谢失调与细胞伤害,它是植物果实对低温胁迫的不良反应[2],但冷害症状因果蔬种类或品种不同表现症状及程度也不同。以往的研究表明热激处理能够诱导采后果蔬提高抗冷性,如橄榄[3]、葡萄柚[4]、青椒[5]、石榴[6]、黄瓜[7]、枇杷[8-9]等,然而不同的果蔬种类其耐热与耐寒能力都不同。此外,热处理作为采后果蔬贮藏预处理的方式不仅能够提高果蔬的耐冷性,而且能够杀死果实表面附着的大量微生物,起到物理杀菌作用,减轻果蔬贮藏过程中因侵染性病菌危害造成的腐烂[10~12]。热处理方法防腐与化学杀菌防腐比较,它无任何化学药剂在果实表面附着残留,对环境无污染,毒性极小,逐渐被国内外果蔬采后保鲜研究者青睐。
鲜枣果实采摘后极不耐贮藏,在室温下果肉易软化褐变、腐烂、失水皱缩,鲜食货架期非常短。为了保持采后鲜食果蔬产品的质量,在保证果实不遭受冻害的前提下,尽最大可能地降低贮藏及运输温度,减缓果实许多生理代谢速率,以延长贮藏寿命[11]。笔者前期的研究认为,鲜枣虽然对低温不敏感,但在-1~-3 ℃的近冰点温度贮藏2~4周时也会出现冷害现象。其冷害特征是表面出现浅红色凹陷斑点、果肉呈絮状、褐变、组织纤维化、风味变淡或者失去风味,不能正常后熟。冷害也会导致果实抗病性和耐贮性下降,所以探求采后鲜枣的近冰温冷藏及控制冷害发生的新方法具有重要的实践意义。短时高温热处理方法对鲜枣采后贮藏品质的影响也有极少量的报道[13-14],但对其采后果实在近冰温贮藏时冷害的发生及生理生化变化机理缺乏深入讨论。冷害首先损伤的是植物细胞膜,之后会诱导一系列的连锁反应发生,如膜脂相变,膜流动性降低,膜脂脂肪酸组分改变,细胞膜透性增大,使植物组织出现各种生理失调和代谢紊乱,严重时导致细胞死亡[3,15]。所以膜脂脂肪酸的组成成分及其相对含量与植物的抗冷性密切相关,一般抗冷性强的植物不饱和脂肪酸含量高于抗冷性弱的植物[15-16],如枇杷[8-9]、桃[17]等果实,目前对采后鲜枣膜脂脂肪酸变化未见相关文献报道。
因此本研究的目的是分析采后鲜枣在近冰温冷藏期间果实冷害发生和膜脂构成成分及比例变化的相关性,并探讨热水处理对近冰温冷藏鲜枣果实抗冷性的影响机理,为近冰温贮藏鲜枣耐冷性提高、保鲜寿命延长提供科学理论依据。
1 材料与方法
1.1 材料与仪器
实验材料 为新鲜临泽小枣(Zizyphus jujubaMill. cv. Linzexiaozao),果实于2020年9月中下旬采自甘肃省张掖市西城驿林场。采摘枣树的田间施肥、修剪、灌溉和病虫害实施统一管理方法。树龄均为6年以上盛果期果树。枣果实达到生理成熟期,着色面积达到50%~70%时人工采收,并挑选出无病虫、无损伤、大小均匀的健康果实作为实验材料。所用化学试剂均为国产分析纯(AR)级。
DDJ-308A型电导率仪 上海精科仪器有限公司;RC-4HC温度记录仪 江苏省精创电气股份有限公司;Lambda 35紫外分光光度计 美国珀金埃尔默公司;TGL-18M高速冷冻离心机 湖南赛特湘仪离心机仪器有限公司;HH-8型水浴锅 金坛市科析仪器有限公司;Trace GC2000 DSQ气质联用仪分析Thermo Finnigan制造。
1.2 实验方法
1.2.1 鲜枣果实冰点温度确定 参照 Fan[18]和崔宽波等[19]果实冰点测定方法,用RC-4HC温度记录仪检测果实内部冻结温度的波动情况,设置温度记录数值间隔时间为10 s。将外置金属探头刺入果实内部距离果核最近的中心部位,并将二者同时置于-20 ℃的冰箱中直至果实完全冻结,即果肉内部组织温度与冰箱环境温度一致。利用记录仪记录冻结时间与温度变化数值情况。
1.2.2 样品处理和贮藏 鲜枣果实样品用1%次氯酸钠浸果10 min,取出晾干并进行下列2种方法处理:对照:不做处理;热处理:其参数依照陈加利等[13]的方法并略作修改。果实浸入60 ℃热水处理1 min后取出晾干水分。将对照组果实与热水处理组果实分别装入带有若干小孔(孔径为0.2 cm)的聚乙烯泡沫饭盒内,每盒重量约为300 g,置于-1.5~-2 ℃的冷库中贮藏,以后每10 d取样一次并进行下述各项指标的测定。
1.3 指标测定
1.3.1 果实冷害指数 通过视觉对鲜枣果实外表面浅红色斑点和凹陷面积来判断果实的冷害程度,因果实种类、组织结构不同,冷害表现症状也各有不同。果实发生冷害的症状大多表现为外表出现凹陷斑,表皮组织坏死、变色、呈水渍状、有异味,内部组织成絮状、变褐和干缩,甚至不能后熟。每次随机取样30个鲜枣果实,按照果实表面所呈现的冷害斑分为6级,冷害指数具体统计方法参照孔家祥等[3]的方法进行。计算公式为:
果实冷害指数=Σ(冷害级数×该级果数)/总果数。
1.3.2 果实细胞膜透性和丙二醛(MDA)测定 用相对电导率表示果实细胞膜透性大小。参照李君兰等[20]的方法。取10个鲜枣果实,在靠近果核处,切取果实厚度为2~3 mm的圆片,重量为1.0 g,加重蒸馏水25 mL,于20 ℃下放置3 h后搅拌均匀,测定果肉外渗液的电导值。然后再将果实圆片及浸出液回流煮沸30 min,冷却后加重蒸馏水至25 mL,搅拌均匀并测定果实煮沸后外渗液的电导值。
相对电导率(%)=(果肉煮沸前外渗液电导值/果肉煮沸后外渗液电导值)×100。
丙二醛(MDA)含量测定采用硫代巴比妥酸法[8]。称取3 g果肉,加入5 mL 50 g/L的三氯乙酸溶液作为缓冲液冰浴研磨。然后在4 ℃ 12000 r/min的条件下冷冻离心10 min,取0.2 mL上清液加入2 mL硫代巴比妥酸溶液,混合煮沸后冷却,再次在2000 r/min条件下离心10 min,取上清液分别在450、532、600 nm波长处测定吸光度值并用下列公式计算MDA,结果以μmol/g·FW表示。
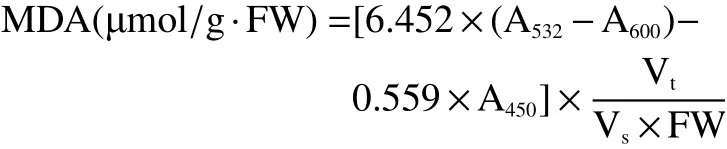
式中:Vt—提取液体积 (mL);Vs—测定用提取液体积 (mL);FW—样品鲜重 (g)。
1.3.3 脂氧合酶(LOX)活性测定 LOX酶活性测定依据Daglia等[21]的方法。从10个鲜枣果实中取果肉1.0 g,加入5.0 mL经过4 ℃预冷pH为6.8的Tris-HCl缓冲液,在冰浴条件下研磨匀浆,于12000 r/min、4 ℃离心30 min,取上清液作为粗酶液。LOX反应体系组成为0.1 mol/L pH为6.8的Tris-HCl缓冲溶液2.65 mL,0.5%亚油酸0.15 mL,0.2 mL粗酶液,反应温度为25 ℃,测定紫外波长234 nm。以不加酶液作为空白。OD234值在每分钟内变化0.001为1个活力单位U,结果以酶的比活力单位U/g·FW(鲜重)表示。
1.3.4 膜脂脂肪酸组分GC-MS分析 参照陈莲[22]和李莉莉等[23]的方法并略做修改。随机取20个鲜枣在100 ℃的沸水中煮10 min,取出冷却沥干水分,去核研磨并称取果泥0.25 g,置于2 mL苯-石油醚(1:1, v/v)溶液中,振摇16 h,离心取澄清液后,加2 mL 0.1mol/L KOH-甲醇溶液(1:1, v/v),振摇10 min后加饱和NaCl并定容至10 mL,萃取有机相用无水硫酸钠除水后于气质联用仪分析。色谱条件:色谱柱:DB-5石英毛细管柱;进样口温度:250 ℃,进样量:2 μL;载气为He气,柱流速1 mL/min;质谱条件:EI离子源温度230 ℃,电子轰击能70 eV,扫描范围29~550 m/z,辅助温度230 ℃;升温程序为初温140 ℃保持4 min,终温至230 ℃保持15 min结束,升温速度4 ℃/min。用NIST谱库检索方法定性分析膜脂脂肪酸组成成分,并用归一化法计算各组分的百分含量,各种类的脂肪酸含量用相对百分含量表示。膜脂脂肪酸不饱和指数(IUFA)和膜脂脂肪酸不饱和度(UFA/FA)的计算公式如下:
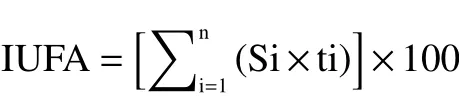
式中:Si—膜脂不饱和脂肪酸相对含量;ti—该不饱和脂肪酸所含不饱和键的个数。
膜脂脂肪酸不饱和度UFA/FA=不饱和脂肪酸相对含量(UFA)/饱和脂肪酸相对含量(FA)。
1.4 数据处理
以上各指标测定均重复3次,运用SPSS 19.0软件对测定结果进行统计,差异显著性采用Ducan多重比较分析,P<0.05表示差异显著,结果用平均值±标准偏差(±SD)表示。用 Origin 8.5分析软件作图。
2 结果与分析
2.1 鲜枣果实冰点温度
冰点温度的测量是近冻结温度贮藏的关键步骤。果蔬固形物含量的多少决定了果实冰点温度的大小。根据冻结时间与温度变化数值制作鲜枣果实冰点曲线如图1所示。鲜枣果实的过冷点为-3.1 ℃,生物结冰点为-2.4 ℃,所以生理成熟期临泽小枣的近冰点温度为-3.1~-2.4 ℃。因临泽小枣果实的可溶性固形物含量为34%~38%[24],果实实际冰点温度低于0 ℃。为了防止机械冷库库体温度的波动,避免果实冻害,所以本实验以-1.5~-2 ℃为鲜枣果实近冰点贮藏温度。
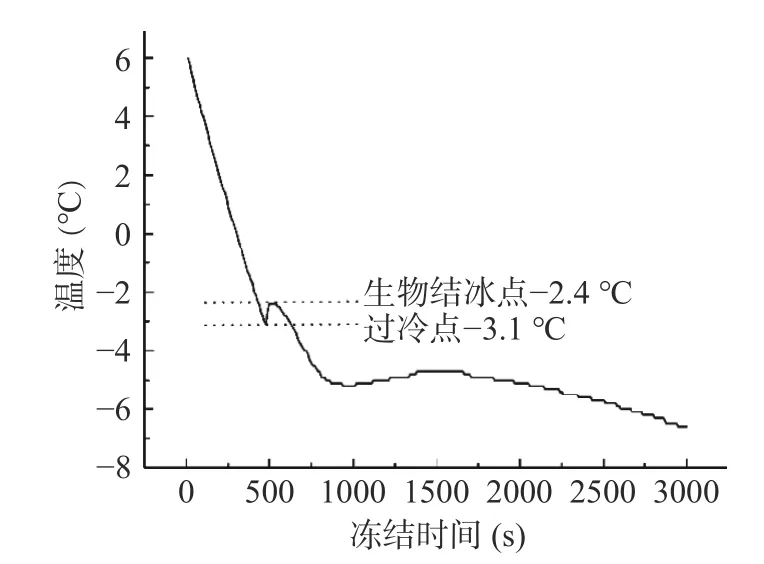
图1 鲜枣果实冰点曲线Fig.1 Freezing curves of fresh jujube fruit
2.2 热水处理对鲜枣果实冷害指数的影响
鲜枣属于低冷敏型水果,但是近冰温贮藏也会发生冷害而失去商品性。由图2A可知,鲜枣在近冰点温度贮藏时,对照组和热水处理组的冷害指数都随着冷藏时间的延长而增加。在0~10 d内,热水处理和对照果实的冷害指数变化不显著。10 d以后,对照组鲜枣果实冷害指数快速增加,50 d时高达14.78,是热水处理组的2.05倍。图2B的冷害视觉效果图显示,随冷藏时间延长果实表面出现浅红色凹陷斑点,其颜色深浅与果实表面的着色程度和成熟度有关。同时果肉内部组织呈絮状败坏、褐变、组织纤维化、风味变淡或者失去风味。热水处理组果实表面着红色面积在同一贮藏时间显著高于对照组,浅红色凹陷斑的数量及面积低于对照组,说明果实成熟度越低,冷害发生越明显,正常后熟越不易。同时发现热水处理有加速鲜枣果实后熟的作用(图2B)。上述结果表明,60 ℃热水处理1 min能减轻近冰温冷藏鲜枣果实冷害的发生,与石榴[6]、草莓[25]经过热处理贮藏的结果相似。
2.3 热水处理对鲜枣果实细胞膜透性、丙二醛(MDA)和脂氧合酶(LOX)的影响
冷害发生的根本原因普遍认为是果实长时间置于不适宜的低温环境导致细胞膜结构损伤,细胞膜脂从液晶状态变为固态凝胶状态,使膜的渗透性和离子泄漏增加[26-27]。相对电导率可用来衡量细胞膜结构的完整性和果实衰老的程度。丙二醛(MDA)则是用来衡量膜脂过氧化程度的指标[8]。由图3A、3B可知,在贮藏0 d时,60 ℃热水处理组的相对电导率和MDA显著高于对照组,可能与短时间热水处理导致细胞膜透性增加相关,与临泽小枣热空气处理的结果一致[11]。但是在后期的整个近冰温贮藏过程中,鲜枣果实细胞膜相对电导率和MDA随着冷藏时间的延长而增加,而经热水处理的鲜枣果实细胞膜相对电导率和MDA始终低于对照组。表明热水处理可有效延缓鲜枣果实细胞膜的伤害,降低膜脂过氧化程度,提高了果实抗冷性。LOX变化如图3C所示,对照组和热水处理组鲜枣果实LOX 活性在冷藏期内随存放时间延长而快速上升,经热水处理的鲜枣果实LOX活性显著低于对照。另外,冷害指数(图2A)与LOX活性(图3C)都是随冷藏时间延长而增加,二者呈正相关状态,说明冷害发生的同时也启动了LOX酶的活性。
通过本研究分析发现,与对照相比,贮藏50 d时,60 ℃热水处理1 min果实的相对电导率、MDA和LOX活性分别降低了17.93%、17.93 μmol/g·FW和15.84 U/g·FW。对照组鲜枣在-1.5~-2 ℃近冰点温度贮藏的第10 d时冷害症状就略有显现(图2A、2B),以后随贮藏时间的延长冷害症状越明显,同时相对电导率、MDA含量也上升(图3A、3B),表明鲜枣冷害程度与细胞膜渗透液增加具有高度的相关性[3,7-8]。由此理由认为,鲜枣果实表面出现浅红色不规则凹陷斑、内部组织呈絮状、褐变、不能正常后熟等特征是由近冰温冷藏引起的冷害症状,冷害程度也导致膜脂氧化程度随之加剧。
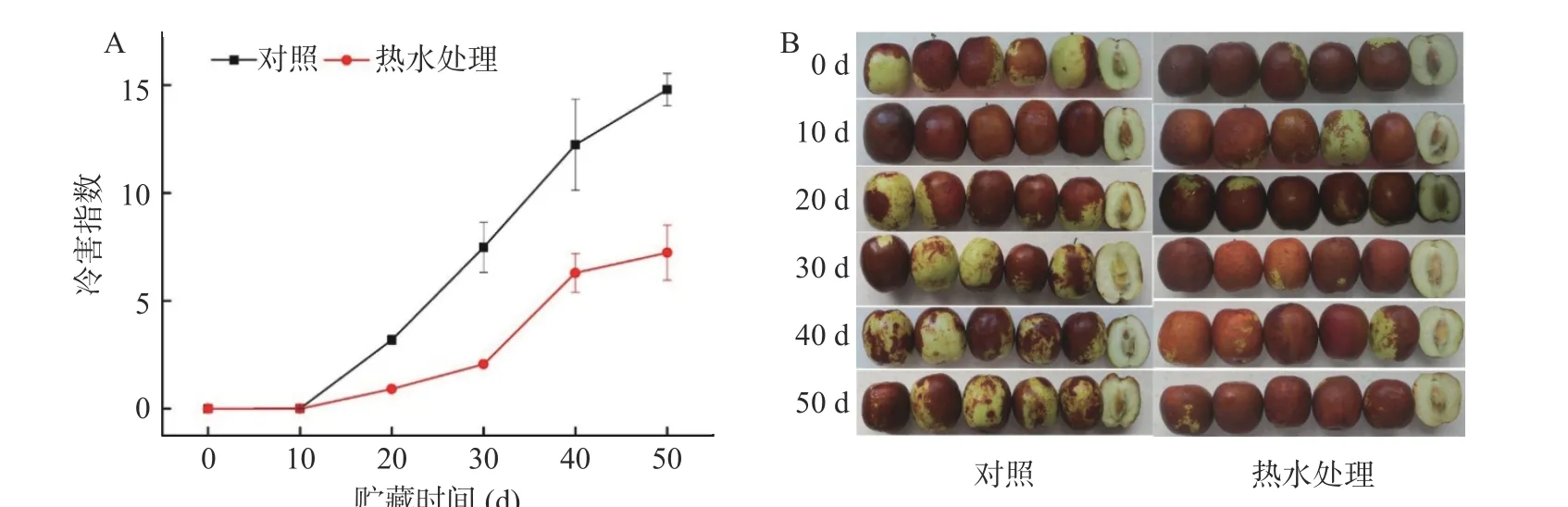
图2 热水处理对近冰温贮藏鲜枣冷害感官指标的影响Fig.2 Effects of hot water treatment on sensory index of chilling injury of fresh jujube fruits during near freezing point temperature storage
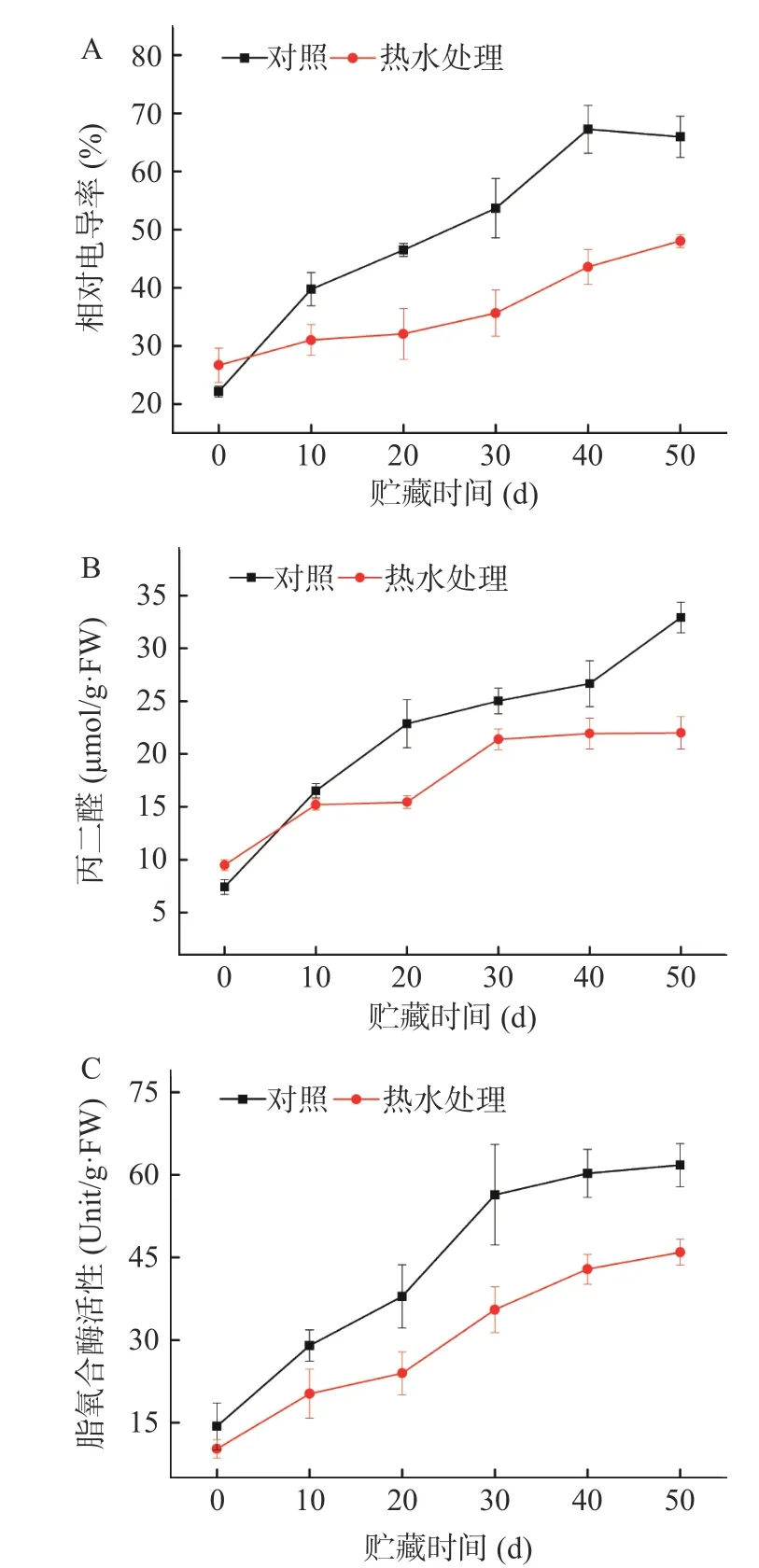
图3 热水处理对近冰温贮藏鲜枣相对电导率(A)、丙二醛(B)和脂氧合酶(C)的影响Fig.3 Effects of hot water treatment on electrolyte leakage(A),malondialdehyde(B) and lipoxygenase (C) of fresh jujube fruits during near freezing point temperature storage
2.4 热水处理对鲜枣果实膜脂脂肪酸组分的影响
细胞膜是发生冷害的最初部位,脂肪酸是构成细胞膜脂的重要组分,膜脂构成成分及构成比例在低温下的变化被认为是冷害发生的主要事件[28-30]。运用气相色谱质谱联用(GC-MS)技术对本实验采收当天未经热水处理的采后鲜枣进行膜脂组成成分分析。如图4所示为GC-MS所得总离子流图,色谱显示共分离出12个峰,表明鲜枣膜脂主要是由12种化合物组成,对总离子流图的各峰进行质谱扫描后得到质谱图,利用质谱数据库进行计算机检索、人工谱图解析,最终确定采收当天未经热水处理和未冷藏的鲜枣膜脂脂肪酸中有12种成分存在,相对百分含量如表1所示。其中主要脂肪酸有7种,相对百分含量由高到低的顺序为棕榈酸(28.61%)>油酸(26.13%)>亚油酸(16.27%)>亚麻酸(12.06%)>肉豆蔻酸(9.39%)>硬脂酸(3.92%)>花生酸(3.37%)。进一步分析发现,刚采收鲜枣膜脂主要构成成分中饱和脂肪酸有4种(棕榈酸、肉豆蔻酸、硬脂酸和花生酸),相对百分含量为45.29%,棕榈酸占28.61%,而不饱和脂肪酸有3种(油酸、亚油酸和亚麻酸),相对百分含量为54.46%,油酸占26.13%。
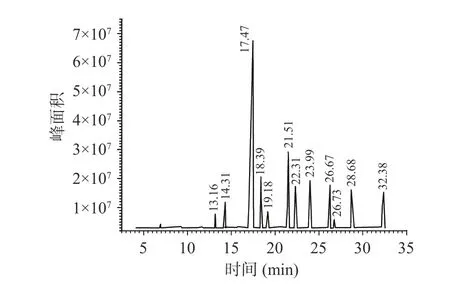
图4 鲜枣膜脂脂肪酸甲酯的 GC-MS 总离子流色谱图Fig.4 GC-MS total ion chromatogram of membrane fatty acids methyl ester from fresh jujube fruits
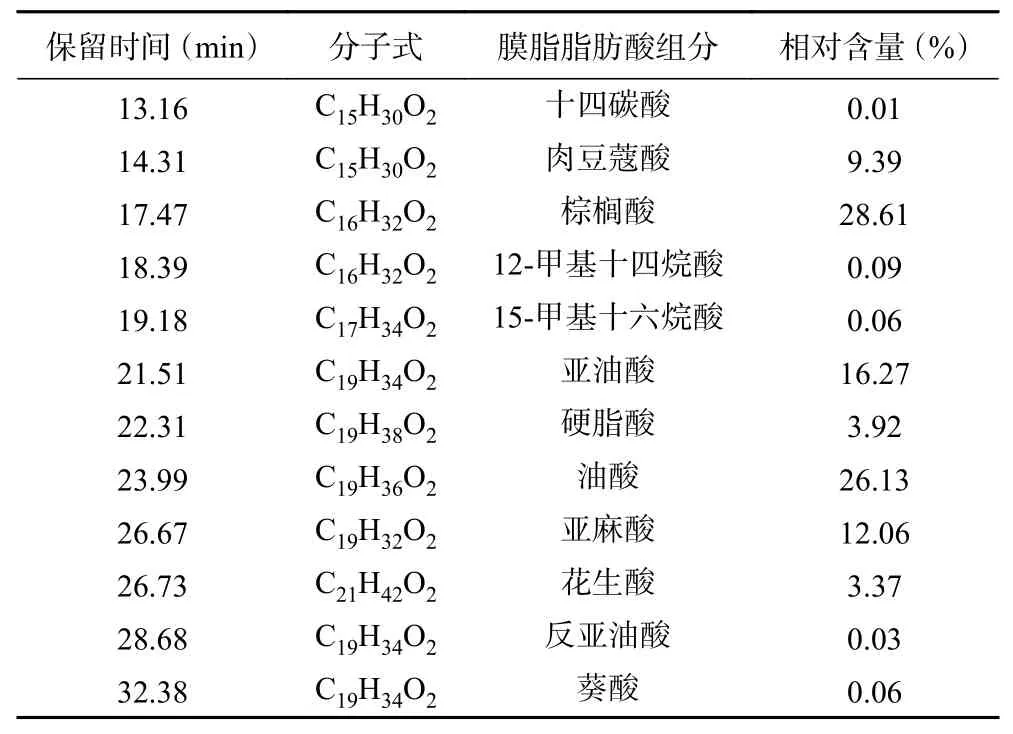
表1 采收当天鲜枣果实膜脂脂肪酸组分和相对含量Table 1 Constituents and relative contents of fatty acid of membrane lipids in pulp of fresh jujube fruits at the day of harvesting
由图5A可知,经热水处理的鲜枣果实棕榈酸(C16:0)相对含量在冷藏0~10 d和30~40 d内略有下降,10~30 d和40~50 d内快速上升,冷藏至50 d时达到最大值,对照组棕榈酸相对含量在0~50 d贮藏期内一直处于上升趋势;由图5B可知,热水处理组鲜枣果实肉豆蔻酸(C14:0)相对含量在冷藏0~50 d内缓慢上升,对照组上升速度比热水处理组更快;由图5C可知,热水处理组鲜枣果实硬脂酸(C18:0)相对含量在冷藏0 d时高于对照组,10~20 d和30~50 d内快速升高,冷藏至20 d时达到最大值,而在10 d以后显著低于对照组;由图5D可知,热水处理组和对照组花生酸(C20:0)相对含量变化在冷藏0~30 d内逐渐升高,随后逐渐降低,且热水处理组始终显著低于对照组。从图5A、5B、5C和5D进一步分析发现,饱和脂肪酸棕榈酸、肉豆蔻酸、硬脂酸和花生酸在10~50 d内的同一冷藏时间,它们的相对含量热水处理组都显著低于对照组,但除花生酸外,其余3种的相对含量在整个贮藏过程中均呈上升的趋势。
由图5E可知,经热水处理的鲜枣果实油酸(C18:1)相对含量在冷藏0~10和30~50 d内逐渐上升,10~30 d内快速下降,50 d时果实的油酸相对含量是对照果实的2.12倍;由图5F可知,热水处理组鲜枣果实亚油酸(C18:2)的相对含量在整个冷藏过程中曲线变化平缓并略有下降趋势。对照在0~30 d内快速下降,30~50 d又逐渐上升,亚油酸的相对含量从0 d至50 d的变化相差了2.67%;由图5G可知,热水处理鲜枣果实亚麻酸(C18:3)的相对含量在冷藏0~10 d内缓慢升高,10~50 d内快速下降,而对照组则在整个冷藏期间均呈现缓慢下降的趋势。从图5E、5F和5G进一步分析发现,不饱和脂肪酸油酸、亚油酸和亚麻酸在贮藏过程中均呈下降趋势,在同一冷藏时间中,它们的相对含量热水处理组都高于对照组,且二者差异显著。
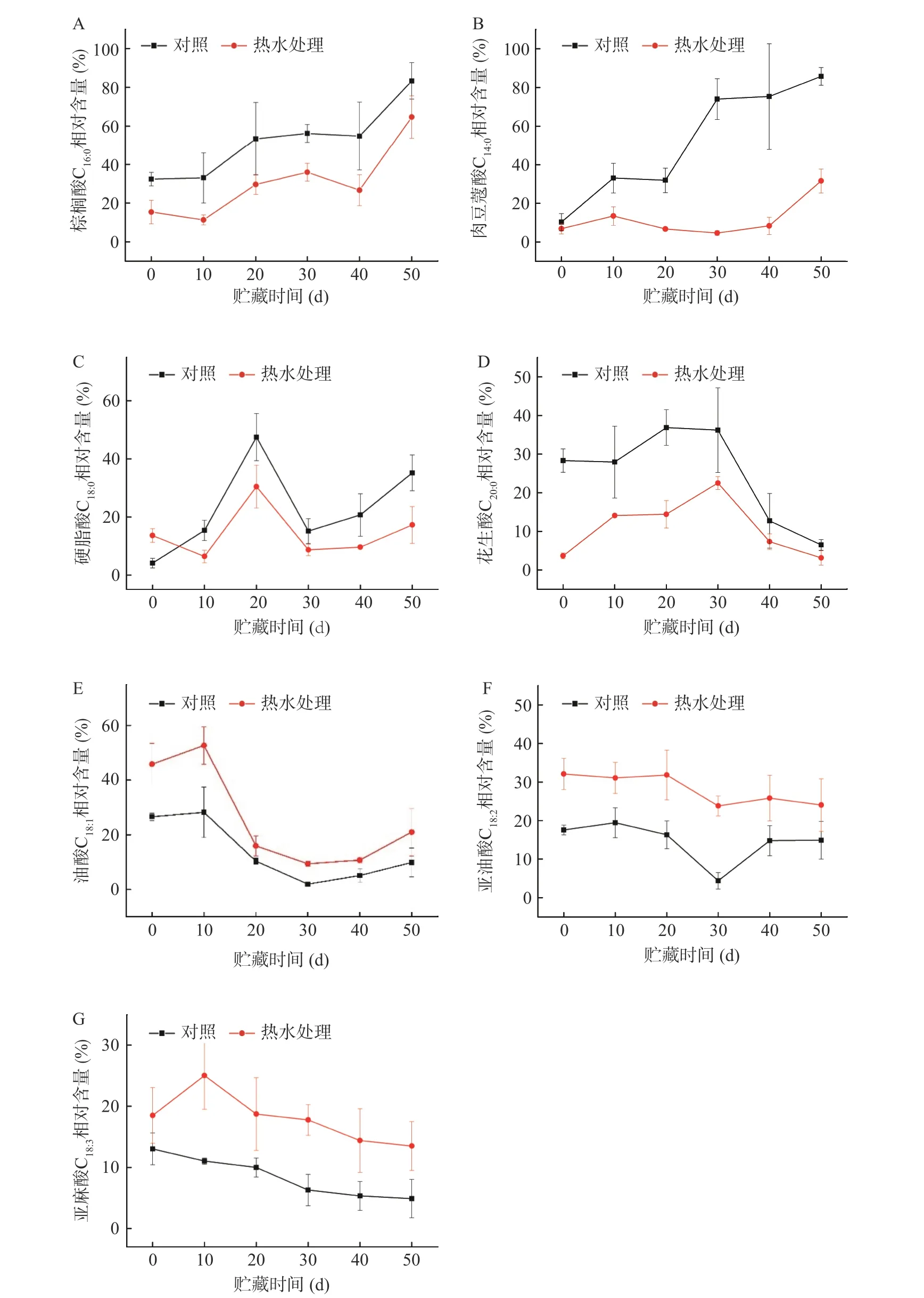
图5 热水处理对近冰温贮藏鲜枣棕榈酸(A)、肉豆蔻酸(B)、硬脂酸(C)、花生酸(D)、油酸(E)、亚油酸(F)和亚麻酸(G)的影响Fig.5 Effects of hot water treatment on palmitic acid (A), nutmeg acid (B), stearic acid (C), peanut acid (D), oleic acid (E), linoleic acid (F) and linolenic acid (G) of fresh jujube fruits during near freezing point temperature storage
LOX的主要反应底物是C18的多不和脂肪酸,经LOX催化加氧转变成氢过氧化物,再经一系列后续酶的催化反应最终生成具有一定生理功能的化合物[30],如茉莉酸、愈创酸、乙烯等,加速了果实冷藏后期的衰老进程。在本研究中,对照鲜枣果实LOX活性(图3C)与亚麻酸(C18:3)的相对百分含量(图5G)呈极显著(P<0.01)负相关(相关系数r=-0.931),说明采后鲜枣果实在近冰温冷藏下发生冷害的程度与膜脂中亚麻酸(C18:3)相对含量变化存在相关性。而与其它2种不饱和脂肪酸的相对百分含量没有明显的相关性(P>0.05),这与橄榄[3]、柿果[31]的研究结果相似。研究结果进一步证明了鲜枣果实亚麻酸仍是LOX的主要作用底物,近冰温贮藏诱导鲜枣发生冷害的同时,也激发了LOX活性增加,导致细胞膜的结构完整性受损,从而改变了膜脂脂肪酸组分及相对含量,除花生酸外,其它饱和脂肪酸相对含量增加、不饱和脂肪酸相对含量下降。
2.5 热水处理对鲜枣果实膜脂脂肪酸不饱和指数(IUFA)与不饱和度(UFA/FA)的影响
细胞膜的结构及其稳定性与果蔬的耐冷性密切相关,其耐冷性强弱主要体现在细胞膜的特性上,如膜脂的流动性和膜脂不饱和度[32-33]。脂肪酸不饱和指数(IUFA)是衡量膜脂不饱和程度的重要指标之一。由图6A可知,对照组和热水处理组采后鲜枣果实的IUFA值在冷藏开始0~10 d内略有升高,10 d以后缓慢下降,且热水处理组的IUFA值在冷藏的同一时间都是极显著(P<0.01)高于对照组。膜脂不饱和度(UFA/FA)是衡量膜脂构成成分及比例变化的另一个重要指标。由图6B可知,热水处理组鲜枣膜脂不饱和度在冷藏0~10 d和30~40 d内迅速上升,此后随贮藏时间延长逐渐下降。对照组在整个冷藏期间膜脂脂肪酸不饱和度均呈现缓慢的下降趋势,贮藏50 d时,热水处理组的膜脂不饱和度为对照组的3.48倍,热水处理组鲜枣的膜脂不饱和度在冷藏的同一时间都是极显著(P<0.01)高于对照组。结果表明60 ℃热水处理1 min能够抑制采后鲜枣在近冰温冷藏过程中膜脂不饱和指数和膜脂不饱和度的降低。

图6 热水处理对近冰温贮藏鲜枣膜脂肪酸不饱和指数(A)和脂肪酸不饱和度(B)的影响Fig.6 Effects of hot water treatment on index of unsaturated fatty acids (A) and unsaturated degree of fatty acids (B) of fresh jujube fruits during near freezing point temperature storage
本研究同时发现,鲜枣果实在-1.5~-2 ℃冷藏期间果肉LOX活性上升(图3C),3种不饱和脂肪酸相对含量下降(图5E、5F、5G),除花生酸外,其余3种饱和脂肪酸相对含量增加(图5A、5B、5C和5D),致使膜脂脂肪酸不饱和指数(IUFA)(图6A)和膜脂脂肪酸不饱和度(图6B)也随冷藏时间延长逐渐下降,LOX酶活性的增加同时也加速这一过程。表明鲜枣在近冰温贮藏过程中膜脂脂肪酸的构成比例发生了变化,对照组比热水处理组的枣果中不饱和脂肪酸有明显损耗(图5E、5F和5G),进一步证明了随近冰温贮藏时间延长,膜脂脂肪酸的不饱和程度和膜脂流动性也逐渐降低,与膜的完整性丧失(图3A、3B)和冷害发生结果(图2A)一致。
3 结论
生理成熟期鲜食临泽小枣的近冰点贮藏温度范围在-1.5~-2 ℃。近冰温贮藏前用60 ℃热水预处理浸泡1 min,能显著减轻鲜枣冷害的发生。实验研究结果表明热水处理能够抑制枣果实脂氧合酶LOX的活性,减缓膜脂脂肪酸组分中不饱和脂肪酸油酸(C18:1)、亚油酸(C18:2)和亚麻酸(C18:3)的下降速率,稳定了细胞膜膜脂的构成成分变化及比例,降低细胞膜渗透率、脂质氧化速率,维持了膜脂的流动性。因此,热水处理能够延缓膜脂脂肪酸不饱和程度的降低是采后鲜枣对近冰温冷藏过程中的一种适应性机制。与之相反,对照组鲜枣不能适应这种机制。
