季节及制曲工艺对麸醋曲微生物群落结构及代谢组分的影响
2022-01-19刘记堂周荣清
周 楠,黄 钧,文 平,何 培,刘记堂,周荣清,
(1.四川大学轻工科学与工程学院, 四川成都 610065;2.四川阆州醋业有限公司, 四川南充 637455)
四川麸醋曲以大麦、次粉、麸皮、玉米等为原料,其生产工艺类似中国清香型白酒大曲[1]。作为粗酶制剂和菌剂,醋曲是发酵的源动力,促进大分子水解和各级代谢产物生成,这些物质将直接或间接地影响食醋的风味特征和功能特性。因此,优质醋曲对酿造高品质食醋具有重要意义。除原料和工艺外,大曲质量与微生态环境密切相关,而季节是影响其品质的主要因素之一[2-5]。FU等[6]对特香型大曲的研究结果表明,夏、秋季生产的大曲不仅理化性质差异显著,而且后者的真菌多样性比前者更高。类似地,朱文优等[7]对夏秋两季生产的高温大曲进行研究,结果同样揭示了季节对群落变迁的规律是其显著影响了真菌群落的多样性。姚霞等[8]以可培法跟踪冬夏两季酒曲主要微生物的交替,得到了相似的规律。HAN等[9]研究桃花曲(春曲)和伏曲(夏曲)的微生物结构、酶活性和风味成分差异的结果表明,春曲的质量高于夏曲,经复配用于酿酒可提高基酒的产率和质量。对大曲质量的相关研究主要以酒曲为对象,然而迄今关于醋曲的研究还鲜见报道。
醋曲通常由未灭菌的谷物生料在开放环境下生产,其微生物组成复杂而难以分离培养,应用Illumina MiSeq测序技术能更全面且高效地获得生物学信息。高效液相色谱和气相色谱-质谱联用分别是研究非挥发组分和挥发性组分的理想手段,二者具有进样量小、灵敏度高、分离效率好、操作简单等优点。因此,Illumina MiSeq测序和色谱技术被广泛结合应用于研究传统发酵食品的微生物群落多样性及风味物质,如白酒、食醋、酱油等[10-13]。
本文描述了以阆州醋曲为对象,应用Illumina MiSeq测序平台和色谱等现代技术研究其理化参数、代谢组分、微生物群落结构及多样性的季节特征,以及两种不同工艺生产的春曲的主要差异。通过多变量统计方法揭示优势种属与代谢组分的相关性,旨在为醋曲的生产及管理技术的优化奠定重要的基础。
1 材料与方法
1.1 材料与仪器
醋曲 春、夏、秋、冬4个季节的醋曲(分别于2019年3、6、9和12月生产),由四川阆州醋业有限公司提供;千禾春曲(2019年3月生产) 由四川千禾味业食品股份有限公司提供,接种黑曲霉强化所得;草酸(≥99.99%)、柠檬酸(≥99.50%)、酒石酸(≥99.50%)、L-苹果酸(≥99.00%)、L-焦谷氨酸(≥99.50%)、琥珀酸(≥99.50%)、乙酸(≥99.70%)、乳酸(≥98.00%)及辛酸甲酯(≥99%)等 标准品,Sigma公司;Fast DNA SPIN提取试剂盒 美国MP Biomedicals公司;Agencourt AMPure Beads核酸纯化试剂盒 美国Beckman Coulter公司;C18E小柱Swell科学仪器有限公司;内标物 准确配制浓度为0.0079 g/100 mL的辛酸甲酯溶液;其它化学试剂均为分析纯,购于本地化学试剂公司。
Trace 1300-TSQ 9000气相色谱-质谱联用仪美国Thermo Fisher Electron公司,配备VF-WAXMS毛细管色谱柱(30 m×0.25 mm×0.25 μm) 美国Bellefonte公司;Agilent 1260 infinity高效液相色谱仪 美国Agilent technologies公司,配备Alltech OA-1000有 机 酸 柱(300 mm×7.8 mm) 美 国Alltech公司;50/30 μm DVB/CAR/PDMS萃取头美国Supelco公司。
1.2 实验方法
1.2.1 样品取样 在曲房常温贮存3个月后,分别从曲堆上、中、下各层随机取样三块醋曲。粉碎并混合均匀,四分法取样500 g,分为2份。其中一份置于<10 ℃的冰箱保存,用于常规及代谢组分分析检测,另一份置于-80 ℃用于微生物群落多样性等检测。阆州春曲、夏曲、秋曲、冬曲及千禾春曲分别简写为L1、L2、L3、L4和Q曲。
1.2.2 Illumina MiSeq高通量测序
1.2.2.1 DNA提取 用Fast DNA SPIN提取试剂盒,按照供应商提供的操作步骤提取醋曲的DNA后,用1%琼脂糖凝胶电泳测定纯度,取3 μL经NanoDropDN-1000分光光度计测定A260和A280吸光值,根据比值确定是否有RNA和蛋白质污染。
1.2.2.2 PCR扩增及测序 用引物338F和806R扩增细菌16S rRNA基因高变区V3~V4区域,使用引物ITS5F和ITS1R扩增真菌ITS5和ITS1区域。PCR扩增体系及扩增操作程序按照HE等[14]所述步骤。扩增的PCR经Agencourt AMPure Beads纯化后,送上海派森诺有限公司测序(2x300 Illumina Miseq)。
1.2.2.3 生物信息学分析 使用QIME pipeline处理原始数据,经DATA2完成质控、去噪、拼接和去嵌合体后,用UCLUST把相似长度≥150 bp及相似度大于97%的序列聚类成可操作性单元(OTU)。通过Greengenes数据库(Release13.8, http://greengenes.secondgenome.com/)及UNITE数据库(Release 8.0,https://unite.ut.ee/)搜寻比对完成真菌和细菌不同水平的分类。应用PICRUSt2 (Phylogenetic Investigation of Communities by Reconstruction of Unobserved States)软件结合KEGG数据库,预测代谢通路及组间功能差异分析。
1.2.3 水分 参照QB/T 4257-2011所述方法。用分析天平称取5 g醋曲,置于105 ℃下烘干至恒重,计算其水分含量。
1.2.4 酸度 参照方法同上。采用电位滴定法,以pH8.2为终点,用0.1 mol/L的氢氧化钠标准溶液滴定。
1.2.5 液化力及糖化力 参照方法同上。分别表示1 g绝干曲在乙酸-乙酸钠缓冲溶液(35 ℃,pH4.6)中每小时液化淀粉和生成葡萄糖的含量,前者利用淀粉与碘的特征反应,后者采用菲林法滴定。
1.2.6 酯化力 参照方法同上。指在35 ℃下,25 g绝干曲在7 d内将一定量的乙醇和己酸催化成己酸乙酯的能力。
1.2.7 发酵力 参照方法同上。在30 ℃下,0.5 g醋曲中微生物利用糖发酵生成CO2和酒精,以72 h内产生CO2的质量衡量发酵力的强弱。
1.2.8 有机酸分析 参考ZHANG等[1]所述方法进行测定。
1.2.8.1 样品的预处理 准确称取5.00 g样品,加入4倍体积流动相超声萃取1 h后,离心(4 ℃,12000 r/min,10 min)收集上清液。以活化后的C18E小柱纯化滤清液,再经0.22 μm滤膜过滤,取10 μL滤液进行分析检测。
1.2.8.2 高效液相色谱条件 用9 mmol/L的H2SO4溶液作为流动相,等梯度洗脱30 min,流速为0.60 mL/min,柱温箱温度为75 ℃,紫外检测器波长设置为215 nm。
1.2.8.3 建立标准曲线及计算方法 将草酸、酒石酸、L-苹果酸、L-焦谷氨酸、琥珀酸、乙酸及乳酸标准试剂分别配制成不同浓度的溶液,建立标准曲线,以确定样品中有机酸种类,并通过外标法计算有机酸含量。
1.2.9 挥发性组分分析 按照ZHANG等[15]所述方法进行测定。
1.2.9.1 预处理步骤 称取0.50 g样品置于15 mL顶空瓶中,加10 μL内标,在(60±1)℃下平衡15 min,将萃取头插入并吸附45 min,于气相色谱-质谱联用仪的进样口解析5 min,按下述操作条件测定其挥发性组分。
1.2.9.2 色谱条件 进样口温度为270 ℃,升温程序:40 ℃,保持5 min,以4 ℃/min升至100 ℃,随后以6 ℃/min升至230 ℃,保持10 min。载气为高纯氦气(纯度≥99.99%),流速为1 mL/min,不分流模式。
1.2.9.3 质谱条件 离子源温度300 ℃,传输线温度250 ℃;电离方式为电子电离,电子能量70 eV,质量扫描范围35~400 amu。
1.2.9.4 定性及定量方法 将质谱数据与NIST2017数据库通过比对鉴定挥发性组分,对于匹配度大于800的物质予以分析。采用峰面积归一化确定挥发性组分的相对定量。
1.3 数据处理
本研究使用SPSS 24.0软件的单因素方差分析(One-way ANOVA)中Duncan检验法分析其显著性(P<0.05, n=3)。使用Simca 14.1软件对醋曲挥发性组分进行偏最小二乘法判别分析(Partial Least Squares Discriminant Analysis,PLS-DA)。采用Origin 2018软件作图。应用R语言Vegan和ggplot2软件完成非度量多维尺度分析(Non-metric multidimensional scaling,NMDS)。
2 结果与分析
2.1 微生物群落结构差异
2.1.1α-多样性差异 样品细菌和真菌的有效序列分别为67290~98632条和55336~66381条,其高质量序列分别为45116~80332条和45244~62129条,其高质量序列与有效序列的比例分别为67.05%~89.76%和81.76%~94.57%。样品的稀疏曲线随着测序深度的增加而趋于平缓,表明该测序结果可足够反映其群落组成的范围。
微生物群落的α-多样性指数如表1所示。L1曲真菌、细菌的Chao1和Observed species指数均高于Q曲,这表明前者微生物种类更丰富。L2曲细菌的Shannon和Simpson指数最高,真菌的Simpson指数也最高,说明夏曲微生物物种分布最均匀。不同季节L曲间,L4曲的细菌和真菌的Chao1和Observed species指数均为最低,表明冬曲微生物的丰富度最低。细菌和真菌的Chao1和Observed species指数最高的醋曲分别为L2和L1曲,这表明夏曲细菌类群最多,而春曲真菌类群最多。相关的研究表明,季节引起的气候变化中,温度是决定微生物组成和功能的关键季节性因素[16-18]。夏季温度较高,曲块进入曲房时初温较高,细菌生长快,夏曲细菌类群最多。而春季气温较低,湿度较大,有利于真菌富集、生长和繁殖,从而春曲真菌类群最多。
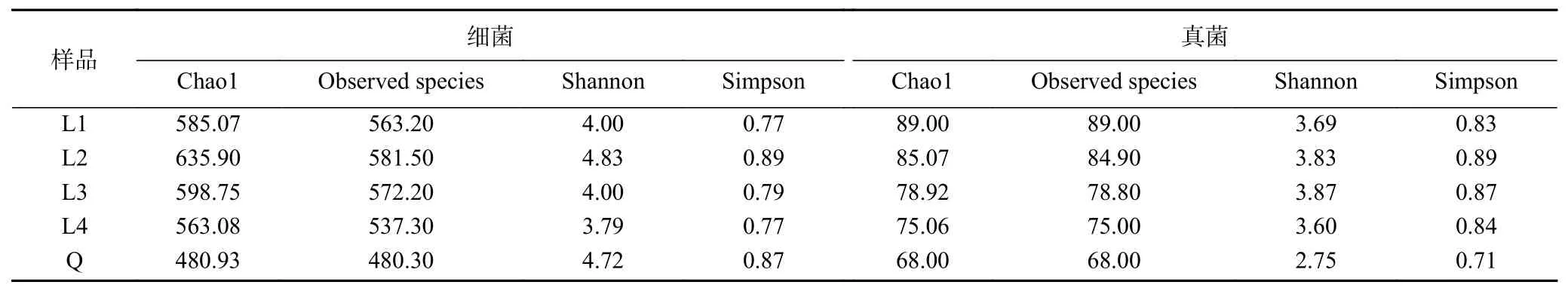
表1 微生物群落的α-多样性指数Table 1 α-diversity indexes of microbial community
2.1.2β-多样性分析 样品微生物群落组成的NMDS分析结果如图1所示。L2、L3及L4三种醋曲的细菌群落均在第一象限,三者间存在一定距离,与L1曲的距离均较远,表明季节显著影响醋曲细菌的群落结构。L1及L2曲真菌群落距离较近,L3和L4曲间的距离较近,则前两者真菌结构类似,后两者也类似,而春夏曲与秋冬曲两个组间的真菌结构差异较大。NMDS排序结果显示,无论是真菌还是细菌群落,L1与Q曲的距离均较远,因而不同生产工艺导致同一季节的醋曲微生物群落结构差异显著。
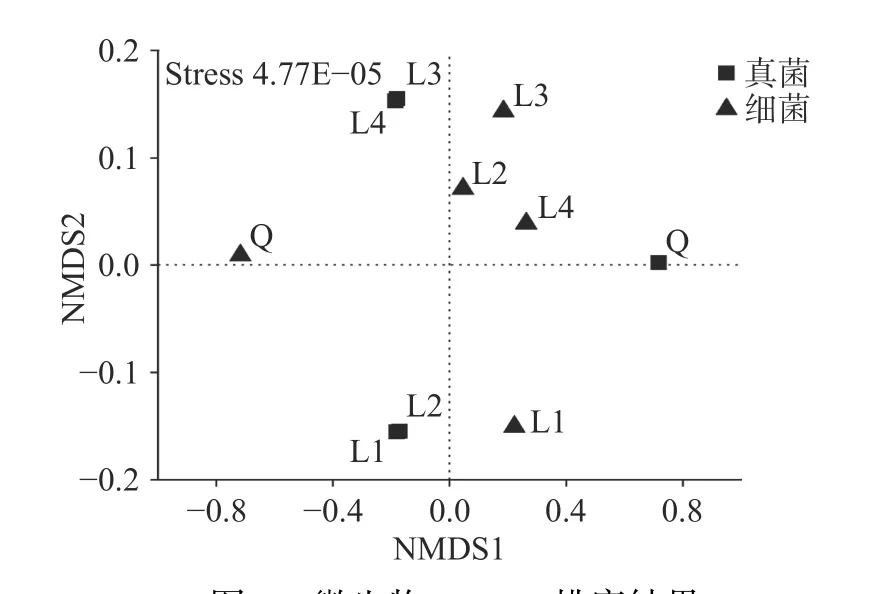
图1 微生物NMDS排序结果Fig.1 Non-metric multidimensional ordination results of microbiota
2.1.3 优势微生物群落组成轮廓的差异 各样品优势真菌属组成轮廓如图2(a)所示。这些样品中共检出了13种真菌属(OTU>0.5%)。L曲的主要优势真菌属是曲霉属(Aspergillus)、根毛霉属(Rhizomucor)、毛霉属(Mucor)和生丝毕赤酵母属(Hyphopichia),其丰 度 分 别 是36.11%~70.74%、10.81%~36.93%、1.12%~8.03%和2.38%~7.36%。而Q曲的主要优势真菌属是嗜热子囊菌属(Thermoascus)、曲霉属(Aspergillus)及嗜热真菌属(Thermomyces),其丰度分别是51.83%、34.43%和5.36%。如图2(a)所示,Q和L1曲真菌属组成间存在明显差异,L1曲检出的根毛霉属(Rhizomucor)、毛霉属(Mucor)、青霉属(Penicillium)及生丝毕赤酵母属(Hyphopichia)等真菌属均未在Q曲中检出,而嗜热子囊菌属(Thermoascus)、嗜热真菌属(Thermomyces)、毕赤酵母属(Pichia)、节菌属(Wallemia)及Rasamsonia仅在Q曲检出。曲霉属(Aspergillus)在L1曲的丰度最高,为70.74%。作为重要的功能种属,该属可分泌多种水解酶,尤其是大量的糖化酶[19-20]。在L1、L3和L4曲中均检出的生丝毕赤酵母属(Hyphopichia)则丰度不同,分别是2.38%、7.36%及5.53%,在秋冬曲的丰度较高。在所有醋曲中,根霉属(Rhizopus)仅在L1和Q曲中检出,丰度分别为2.91%和3.72%,该属分泌多种水解酶,可促进原料淀粉的分解利用[21]。
各样品优势细菌属组成的轮廓如图2(b)所示。这些样品共检出了17种优势细菌属(OTU>0.5%)。L曲的主要优势细菌属包括葡萄状球菌属(Staphylococcus)、糖多孢菌属(Saccharopolyspora)和链霉菌属(Streptomyces),其丰度分别是11.02%~74.91%、20.14%~28.61%及4.90%~38.76%。Q曲的主要优势细菌属为魏斯氏菌属(Weissella)、高温放线菌属(Thermoactinomyces)和乳杆菌属(Lactobacillus),丰度分别是43.31%、22.25%和21.81%。由此可见,Q曲和L1曲的优势细菌属组成具有显著差异。葡萄状球菌属(Staphylococcus)是L3和L4曲最主要的优势细菌,丰度分别是56.41%和74.91%。糖多孢菌属(Saccharopolyspora)是L1和L2曲的主要优势细菌,丰度分别是28.60%和20.14%,在其余醋曲中未检出。该属可分泌水解酶,尤其产维生素和纤维素降解促进因子等[22]。芽孢杆菌属(Bacillus)仅在L2曲中检出,丰度是2.71%。乳杆菌属(Lactobacillus)和乳球菌属(Lactococcus)仅分别在Q和L1曲检出,对酸和乙醇的耐受能力强,其主要代谢产物为乳酸[23-24]。

图2 属水平真菌(a)和细菌(b)的相对丰度(OTU>0.5%)Fig.2 Relative abundance of fungal (a) and bacterial (b)community at genus level (OTU>0.5%)
2.2 理化性质的差异
如表2所示,这些样品的主要理化参数除水分外,其余的差异都较大。样品水分间的差异可能与其发酵过程的温度和湿度变化密切相关。醋曲酸度的差异可能与肠杆菌属(Enterobacter)、乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)以及魏斯氏菌属(Weissella)等产酸细菌属的丰度及产酸能力有关。L1和L2曲的糖化力均略高于L3和L4曲,并且前两者的液化力显著高于后两者(P<0.05)。其中,L1曲的糖化力和液化力均为最高,可能是L1曲中曲霉属(Aspergillus)和根霉属(Rhizopus)的丰度高,其分泌的水解酶活力高所致[22]。L3和L4曲生丝毕赤酵母(Hyphopichia)的丰度较高,从而发酵力显著高于其余醋曲(P<0.05)。样品酯化力在(578.08±1.63)~(692.05±3.27)U之间,L曲间酯化力差异较小。L1与Q曲的理化性质差异显著,前者的酸度、糖化力、液化力和酯化力均明显高于后者,而发酵力略低于后者。

表2 不同醋曲理化性质差异Table 2 Differences on physicochemical properties of different Cuqus
2.3 有机酸组成及含量差异
这些醋曲所含有机酸的种类及含量如表3所示。L曲的有机酸总量在(138.66±0.67)~(180.76±0.47)mg/g间,而Q曲的仅有(71.49±0.36)mg/g。L1曲的有机酸总量为Q曲的2.46倍,前者乙酸、琥珀酸及酒石酸含量均显著高于后者(P<0.05)。所有醋曲的优势有机酸组分均为乙酸、琥珀酸、酒石酸和乳酸,其中乙酸和乳酸是四川麸醋重要的呈味组分[25]。L4曲中酒石酸含量高达(34.24±0.41)mg/g,其乳酸的含量也是L曲中最高的(8.31±0.09)mg/g)。L1曲中则琥珀酸含量高达(25.99±0.04)mg/g,乳酸的含量仅(1.03±0.00)mg/g。琥珀酸可增强食醋的鲜味,与乳酸均可缓冲乙酸带来的刺激感,赋予食醋更加绵柔的口感,而酒石酸稍有涩感、酸味强烈[26]。由此可见,生产工艺显著影响了醋曲有机酸的组成,而不同季节醋曲间乳酸含量差异最为显著。
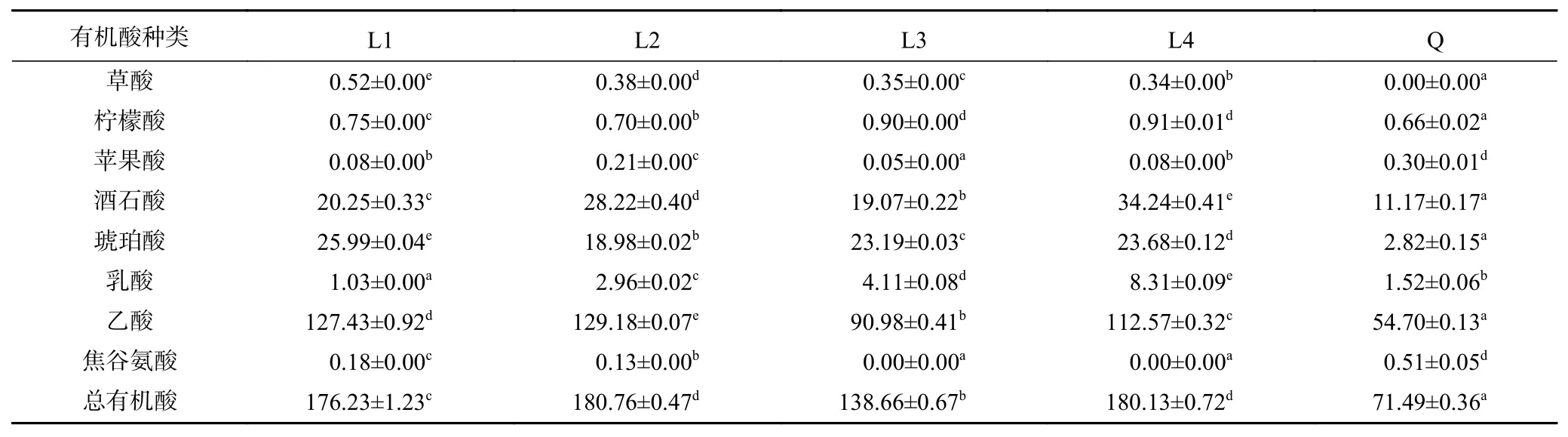
表3 不同醋曲有机酸含量(mg/g)Table 3 Contents of organic acids in different Cuqus(mg/g)
2.4 挥发性组分种类及含量差异
各醋曲挥发性组分总含量如图3(a)所示。L1~L4曲 及Q曲 中 分 别 检 出 了44种、35种、41种、35种及29种挥发性组分,其总含量的高低顺序分别是Q曲(6885.46 ng/g)>L1曲(6419.37 ng/g)>L2曲(3996.85 ng/g)>L3曲(3733.67 ng/g)>L4曲(2981.57 ng/g)。如图3(b)所示,酯类是优势组分,其比例在66.74%~88.38%间。Q曲的酯类组分比例最高,为88.38%,L1曲次之,为83.12%。优势酯类组分均为棕榈酸甲酯(918.57~2632.42 ng/g)、亚油酸甲酯(609.87~1801.62 ng/g)和(Z)-油酸甲酯(401.78~1176.32 ng/g),以上三种酯类在Q曲的含量均略高于L1曲的。醇类物质的相对含量在6.67%~11.30%间,L2、L3及L4曲中醇类含量最高的组分均为鲸蜡醇(114.34~332.77 ng/g),而L1和Q曲中醇类含量最高的组分分别为十五醇(452.94 ng/g)和苯乙醇(270.99 ng/g)。

图3 不同醋曲挥发性组分总含量(a)及相对含量(b)Fig.3 Total (a) and relative (b) contents of volatile compositions in different Cuqus
基于各样品挥发性组分的PLS-DA如图4(a)所示。前2个主成分共解释了63.8%的总变量,Q2值为0.951,证明该关系模型可实现对样品的预测。由PLS-DA载荷图可知,Q与L1曲间离散程度大,可推测因制曲工艺、小生境等因素,二者的挥发性组分差异显著。不同季节L曲的挥发性组分间存在差异,春、夏两季醋曲与秋、冬曲间差异较明显。而春夏曲间挥发性组分较类似,与其微生物群落结构相似的结果是一致的。
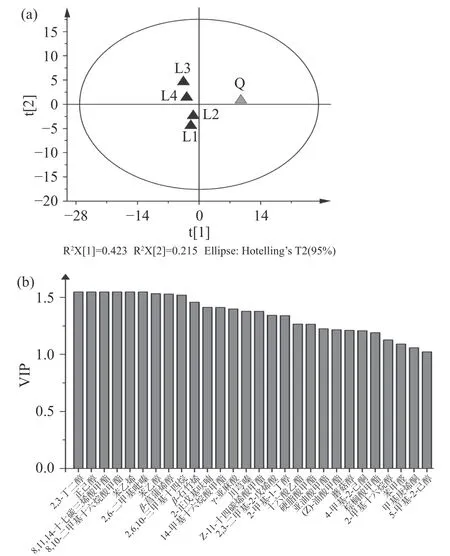
图4 基于醋曲挥发性组分含量的PLS-DA分析(a)和VIP值(b)Fig.4 PLS-DA analysis (a) and VIP (b) based on volatiles contents of different Cuqus
VIP值(Variable Importance in the Projection)源于变量对两组差异的贡献值,VIP值>1表明对模型的总体贡献较大。如图4(b)所示,VIP值>1的挥发性组分有28种,主要是酯类和醇类组分。酯类组分中,棕榈酸甲酯、亚油酸甲酯和8,11,14-十七碳三烯酸甲酯等9种组分的贡献相对较大。苯乙醇、正己醇、2,3-丁二醇等8种醇类成分的VIP值>1,其中2,3-丁二醇和正己醇仅在Q曲中检出。Q曲中苯乙醇的含量高达(270.99±65.18)ng/g,而在L1曲中其含量仅为(37.08±3.53)ng/g。吡嗪类是食醋中重要的成分,曾报道是发酵过程中由生物转化和美拉德反应产生的生物活性物质[27-29]。2,6-二甲基吡嗪及川芎嗪在Q曲中检出,而未在L1曲中检出。
2.5 核心微生物代谢途径分析
图5 为醋曲中优势微生物的代谢途径及其与风味成分的关系。与淀粉水解相关的酶,五种醋曲中仅注释到α-淀粉酶(EC 3.2.1.1),该酶在L1和Q曲的真菌类群中注释到较高的相对丰度,这与醋曲中曲霉属(Aspergillus)、根霉属(Rhizopus)及芽孢杆菌属(Bacillus)可分泌大量的α-淀粉酶有关[21]。与纤维素水解相关的酶注释到葡萄糖内切酶(EC 3.2.1.4)及β-葡萄糖苷酶(EC 3.2.1.21),主要与曲霉属(Aspergillus)和芽孢杆菌属(Bacillus)相关。α-淀粉酶及纤维素酶与原料的分解关系密切,较高的淀粉分解率有利于微生物进行生长繁殖、能源利用和物质转化。在乳酸杆菌属(Lactobacillus)和乳酸球菌属(Lactococcus)等微生物分泌的L-乳酸脱氢酶(EC 1.1.1.27)和D-乳酸脱氢酶(EC 1.1.1.28)作用下,丙酮酸经还原反应可得到L-乳酸和D-乳酸[30]。芳香物质苯乙醇的合成与苯丙氨酸的代谢相关[31],L1曲在I和II途径中相关酶的表达程度相对较高,而Q曲在三种合成途径中相关酶的表达程度均较高。

图5 醋曲微生物的代谢途径及其与风味成分关系Fig.5 Relationship of microbial metabolic pathways and flavor compounds in Cuqu
3 结论
基于Illumina MiSeq高通量和色谱等现代分析检测技术研究季节对阆州醋曲品质的影响及不同工艺春曲的特点。结果表明,不同季节L曲细菌群落结构间存在显著差异,L1和L2曲的真菌群落结构和挥发性组分轮廓均类似,二者的微生物丰富度、糖化力和液化力均高于L3和L4曲的,但后两者发酵力显著高于前两者。L1和Q曲的理化参数、代谢组分及微生物群落结构间差异显著,尤其是优势细菌群落组成。前者的微生物种类更丰富,其中根霉属(Rhizopus)是两者具有特色的真菌。本研究结果为基于优质醋曲为模板,模拟和优化培养条件,改善醋曲的质量奠定了理论基础。
