淀粉纳米颗粒的醇沉法制备与同步包埋山奈酚的研究
2022-01-19史永桂林日辉焦思宇韦凯美陆晓娜杨麦秋林春燕
史永桂,林日辉,焦思宇,蒙 薇,韦凯美,陆晓娜,杨麦秋,林春燕
(广西民族大学化学化工学院,广西多糖材料与改性重点实验室,林产化学与工程国家民委重点实验室,广西林产化学与工程协同创新中心,广西林产化学与工程重点实验室,广西南宁 530006)
大多数天然黄酮化合物具有抗炎、抗氧化、抗病毒等功效,在医药和食品添加剂领域引起了众多研究者的关注[1]。山奈酚(Kaempferol)是一种天然的多羟基黄酮类化合物,具有良好的生理和药理作用,已应用于食品添加剂和医药方面[2]。Song等[3]研究了山奈酚对体外培养胃癌细胞影响,在山奈酚用量为60或120 μmol时可抑制胃癌细胞的增值,并且对正常的胃细胞没有显著的影响,这为山奈酚的体内供药提供了参考。但是山奈酚分子含有二苯基丙烷结构,该结构表现出较强的疏水性,导致山奈酚在水中难以溶解,生物利用度差,且药效作用也极易受到剂量、体内释放以及体内环境因素等影响[4−5]。为了充分发掘山奈酚的药用价值,需要开发新的制剂技术,包埋和缓释成为了山奈酚的研究方向,天然材料的生物相容性使其成为药物载体的研究热点。
淀粉作为一种天然的高分子材料,因其良好的生物相容性,在作为药物载体方面有广泛的应用[6]。由于原淀粉本身性质限制,淀粉多以在水相中对亲水性药物的物理吸附以此作为药物载体,在有机溶剂中受自身溶胀性等限制,对疏水性药物的负载效果并不理想[7]。由于纳米技术的兴起,纳米淀粉(Nanometer starch,SNPs)的研究成为热点,在药剂学领域方面,认为淀粉颗粒尺寸小于1 μm即为SNPs。SNPs作为药物载体与药物有效结合并在人体内有效释放吸收,有着广阔发展前景,因此纳米淀粉的研究成为了一种趋势[8]。
淀粉颗粒在完全糊化状态下,其中的淀粉链由双螺旋结构解旋成单螺旋结构,单螺旋淀粉链具有疏水性的空腔和亲水性外部螺旋结构,疏水性的空腔可与疏水性分子形成包合物,这为本文提供了理论的基础[9]。Tan等[10]在丙酮中制备了纳米淀粉,并通过荧光光谱法证明疏水性药物芘在纳米淀粉的极性较强介质表面转移向极性较小的介质内部,表明纳米微球内部存在极性较低的微质,该微质由直链淀粉有序排列构成,可用于对疏水性药物的包封。Arvisenet等[11]在糊化后的淀粉中添加芳香化合物,研究了直链淀粉对风味化合物的包合作用,结果表明直链淀粉可与芳香化合物形成包合物,对芳香化合物的保留有显著得影响。Zhu等[12]制备了不同的直链玉米淀粉,并研究了与小分子萘酚形成共沉淀的产率,结果表明相对络合的指数在27.5%~69.1%。可见,淀粉中的直链淀粉和SNPs内部极性较小区域对疏水性药物具有一定的包埋和负载作用。因此,本文尝试在淀粉纳米颗粒形成过程中同步包埋疏水性药物山奈酚,探索一种快捷、且在无任何有毒试剂参与下制备出形貌较好、尺寸较均一的纳米级别的SNPs-山奈酚颗粒,为纳米淀粉的制备及其在疏水性药物负载方面提供新的思路。
1 材料与方法
1.1 材料与仪器
木薯淀粉 纯度95%以上、直链淀粉含量10%,市售;无水乙醇 分析纯,成都市科隆化学品有限公司;Tween-80 AR,萨恩化学技术有限公司;山奈酚BR(纯度95%) ,上海源叶生物技术有限公司。
JY92-IIN型超声波细胞粉碎机 宁波新芝生物科技股份有限公司;FD-A10N-50型冷冻干燥机 上海皓庄仪器有限公司;UV23II型紫外可见分光光度计 上海天美科学仪器有限公司;Nicolet is10型傅里叶变换红外光谱仪 美国赛默飞世尔科技公司;MiniFlex600型X-射线衍射仪 日本理学公司;SUPRA 55 Sapphire型场发射扫描电子显微镜 德国卡尔蔡司公司;Nicomp380ZLS型纳米激光粒度及电位分析仪 美国PSS粒度仪公司。
1.2 实验方法
1.2.1 淀粉纳米颗粒的制备
1.2.1.1 木薯淀粉乳的制备 参考Hu等[13]配制浓度为5%(W/W)的淀粉溶液,置于恒温磁力搅拌器中以冷凝器进行回流,在90 ℃恒温1 h至淀粉完全糊化。糊化淀粉液在超声波细胞粉碎机下600 W超声处理10 min降低粘度。将低粘度淀粉液在8000 r/min下离心5 min,取上清液,即得淀粉乳。
1.2.1.2 不同乙醇浓度制备淀粉纳米颗粒 参考孙锦等[14]方法,并做出适当调整。在超声波运行条件下,将3、4、6 mL无水乙醇分别通入处于超声波细胞粉碎机下的7、6、4 mL淀粉乳中,制备乙醇含有量为30%、40%、60%的淀粉纳米颗粒混合液。在8000 r/min下离心5 min,取沉淀,冷水冲洗,置于−20 ℃冰箱冷冻10 h,最后置于−45 ℃冷冻干燥至恒重,制备得SNPs。
1.2.1.3 场发式扫描电镜观察(SEM) 用毛细管取少量的木薯淀粉和SNPs均匀的撒到双面导电胶上,轻轻吹去多余的浮样,置于真空镀膜仪下喷镀钯金,制成电镜观察样品,扫描电镜下用5000倍拍照观察。
1.2.1.4 样品颗粒的粒径检测 参考涂宗财等[15]方法并稍作改进,取适量样品溶于冷超纯水中制得混合悬浊液,并在冰浴条件下,将混合液在超声波细胞粉碎机下进行超声分散一段时间。取适量分散液放入比色皿中,设定仪器参数,温度25 ℃、水折射率1.33、淀粉折射率1.53,通过纳米激光粒度在此条件下测量粒度。
1.2.1.5 X-射线衍射(XRD) 用XRD测定纳米淀粉的结晶性。设置测试条件:电压大小为40 kV,电流大小为20 mA,使用单色Cu-kα射线和Ni片滤波,以0.02°为扫描步长,以4(°)/min为扫描速率,以4°~40°为2θ的扫描范围[16]。
1.2.2 纳米颗粒对山奈酚的包埋
1.2.2.1 山奈酚的吸收波长选择与标准曲线的建立称量山奈酚2.5 mg,于乙醇溶液中溶解,配制成0.05 mg/mL的山奈酚溶液。在全波长200~800 nm范围内用紫外可见分光光度计对其进行扫描。为避免淀粉中杂质干扰,将2.5 mg淀粉分散于无水乙醇溶液中,然后8000 r/min进行离心,取上清液全波长扫描作为对照组。结果山奈酚在367 nm处,有最大吸收波长,且淀粉醇的分散液在此波长无吸收,选择吸收波长为367 nm[17]。
精准称取山奈酚50.0 mg溶解于乙醇,定容至100 mL容量瓶中,得浓度为0.5 mg/mL的标准母液。移取母液1.0、2.0、3.0、4.0、5.0、6.0 mL定容至250 mL容量瓶中,得浓度为 0.002、0.004、0.006、0.008、0.01、0.012 mg/mL 的标准溶液,在367 nm下用紫外可见分光光度计测量吸光度,以乙醇作为对照液,平行测定两次,记录吸光度。以山奈酚浓度为横坐标X (mg/mL),吸光度为纵坐标Y,标准曲线为:Y=75.76X−0.012 (R2=0.9987)。
1.2.2.2 SNPs对山奈酚的包埋 以0.7 mg/mL的山奈酚醇溶液作为非溶剂相,按照1.2.1.2方法为基础并做改进,将山奈酚醇溶液3、4、6 mL,分别通入置于超声波加强搅拌下的5%淀粉乳溶液7、6、4 mL,得乙醇浓度为30%、40%、60%的山奈酚淀粉纳米混合溶液,离心后去除上清液,沉淀少量冷水分散,用冷冻干燥冻干恒重,制备得SNPs-山奈酚颗粒。分别取山奈酚淀粉纳米混合溶液1.5 mL用高速冷冻离心机离心,在12000 r/min下,离心5 min,取上清液。该上清液稀释100倍,用紫外分光光度计测量吸光度A,包埋率的计算公式(1)为:

式中:C0:山奈酚浓度(0.7 mg/mL);V0:山奈酚溶液体积,mL;C1:山奈酚淀粉纳米混合液浓度,mg/mL;V1:山奈酚淀粉溶液体积,mL。
包埋量计算公式(2)为:
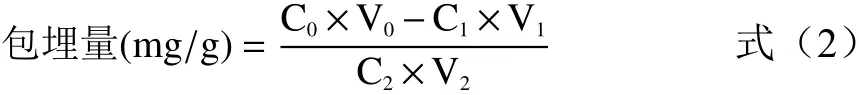
式中:C2:淀粉乳浓度,5%;V2:通入淀粉乳体积,mL。
1.2.3 SNPs-山奈酚在体外环境、模拟胃液和肠液中缓释性能和稳定性分析
1.2.3.1 山奈酚在模拟人体外环境中的释放情况以pH7.4的PBS缓冲液作为模拟人体外环境中的释放介质,由于山奈酚在水中溶解差,在释放介质中以质量浓度为1%的Tween-80作为表面活性剂[18]。称取0.5 g按1.2.2.2方法制得SNPs-山奈酚颗粒(载药量分别为3.78、2.2、1.96 mg/g),加入5 mL释放介质装入透析袋,于振荡培养箱中,转速100 r/min、37 ℃下悬浮释放。分别于0.25、0.5、1.0、2.0、4.0、6.0、10.0、15.0、20.0、24.0 h取释放介质1 mL(并补充等量的相应介质),以5 mL,0.08 mg/mL山奈酚原料药作为对照组,测量吸光度[19]。根据式(3)计算释放率:
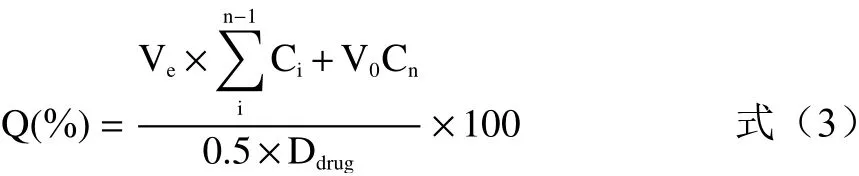
式中:Ve:释放介质置换体积,mL;Ci:第i次置换时山奈酚浓度;V0:起始释放体积,mL;n:置换液体次数;Ddrug:SNPs-山奈酚载药量。
1.2.3.2 在模拟人体胃肠消化液中山奈酚的释放情况 参考杨慧等[19]方法并做适当调整配制模拟体液,分别配制水溶液、30%、50%浓度的乙醇溶液(含1% Tween-80)各100 mL,并用稀盐酸(含有胃蛋白酶0.2 mg)调节pH为2作为模拟胃液;以磷酸缓冲液(含有胰蛋白酶0.2 g)配制水溶液、30%、50%浓度的乙醇溶液(含1% Tween-80)各100 mL,调节pH为7.0作为模拟肠液。按照1.2.3.1方法将SNPs-山奈酚颗粒在两组缓释介质中分别释放3 h,测量吸光度。
1.2.3.3 包埋后山奈酚在不同时间下的稳定性 将1.2.2.2制备的山奈酚淀粉纳米混合液放入血液混凝器上,室温下避光2、4、6、8、10、12、24 h,以山奈酚醇溶液和山奈酚水溶液(含1% Tween-80)作为对照,记录混合液的吸光值变化。
1.3 数据处理
实验均进行三次重复,采用Excel 2010对实验数据进行统计,并对平均值和标准差计算,采用Origin 2018对实验参数和结果绘图,Photoshop对图片进行排版。
2 结果与分析
2.1 不同乙醇浓度下淀粉纳米颗粒的表征
2.1.1 在SEM下对淀粉颗粒的表征 木薯淀粉和SNPs的SEM如图1所示。由图1a知木薯淀粉颗粒表面和边缘光滑,淀粉颗粒主要保持圆形和少许不规则形,颗粒的尺寸为微米级别。对比图1b、1c、1d,木薯淀粉经超声搅拌后,淀粉颗粒形貌改变较明显,60%乙醇制备的SNPs形貌较好,颗粒分布均匀;40%乙醇下沉降制备的SNPs主体形貌为纳米球,尺寸分布相对均匀,但颗粒之间有轻微的团聚产生,并有尺寸较大颗粒生成;30%乙醇下制备下的淀粉颗粒,形貌主体为不规则颗粒,疏松多孔。超声波搅拌过程中乙醇含量对SNPs的沉降有着重要影响,乙醇含量较低时,沉降形成的纳米微球的表面和内部的水不能被乙醇完全夺取。因此,淀粉纳米颗粒在去溶剂化作用时,随着乙醇首先的挥发,水的存留增加了淀粉链之间的氢键作用力,使淀粉颗粒之间出现粘结[20]。干燥后的SNPs会聚集在一起,形成微米级别的聚集颗粒形状,因SNPs颗粒粒径小,比表面积大,表面能大,颗粒之间通过聚集状态而达到稳定的结构。

图1 木薯淀粉和纳米淀粉电镜图Fig.1 Electron micrograph of tapioca starch and nano starch
2.1.2 淀粉颗粒的粒度表征 淀粉样品的粒径分布如图2所示。由图2(a)可以看出,木薯淀粉粒径主要分布在5~20 μm,经超声波波搅拌法处理后的SPNs的粒径明显下降,成为纳米级别淀粉颗粒。由图2(d)知,60%乙醇下制备的SPNs粒径主要分布在50~200 nm,颗粒分布较均匀,随乙醇浓度下降,制备的SPNs粒径开始增大,并且颗粒分布范围增加。

图2 木薯淀粉和纳米淀粉粒径分布图Fig.2 Particle size distribution of tapioca starch and nanostarch
2.1.3 在XRD下对淀粉颗粒的表征 由图3知,木薯淀粉在15°、17°、18°和23°处有较强的衍射峰,其晶型属于A型[21]。在30%乙醇中制备的SNPs在17°、18°处衍射峰消失,15°和23°处衍射峰的偏移至13°、21°并在8°处有新的衍射峰出现,表明沉降法制备的SPNs晶型发生明显改变,生成了新的结晶区。根据Shi[22]的研究报道,2θ衍射角在8°、13°、21°处的峰是V型淀粉的特征峰。V型淀粉晶体结构主要由直链淀粉和乙醇的复合物生成,表明木薯淀粉经超声搅拌后,双螺旋结构被破坏,导致原有晶型发生改变[23]。当乙醇浓度增加到40%时,SNPs仅在13°有微弱衍射峰产生,其他衍射峰消失,说明SNPs的结晶性随乙醇的浓度升高而下降。当乙醇浓度进一步提升至60%时,SNPs的衍射峰完全消失,形成大包峰,此时淀粉颗粒无结晶性。

图3 木薯淀粉和纳米淀粉的XRD图Fig.3 XRD patterns of tapioca starch and nano starch
2.1.4 SNPs对山奈酚的包埋 山奈酚的二苯基丙烷结构决定其疏水性较强,难溶于水,可溶于乙醇,因此SNPs对山奈酚的包埋受乙醇浓度的影响较大[2]。图4表明当乙醇浓度升高时,SNPs对山奈酚的包埋率和包埋量呈现下降趋势。乙醇的浓度为30%时,SNPs在沉降时对山奈酚的包埋率最高为62.49%,包埋量为3.78 mg/g。在SNPs在沉降时,淀粉乳进入乙醇非溶剂体系,淀粉分子周围的水溶剂被置换为乙醇非溶剂,淀粉分子间的羟基重新缔和形成氢键,形成淀粉纳米颗粒沉降。山奈酚在乙醇浓度为30%中的溶解度较低,山奈酚分子上的羟基更易与葡萄糖分子上羟基相互作用生成氢键,随淀粉分子的沉降被包埋进SNPs内;乙醇浓度升高时,山奈酚在乙醇中的溶解度增大,山奈酚上的羟基与醇羟基之间形成的氢键作用变强,与淀粉分子之间的作用力变弱,减少了包埋量。因此此过程中山奈酚在非溶剂乙醇中的浓度对包埋率影响较大,这与寇宗亮等[7]在木薯纳米淀粉对疏水性药物姜黄素负载的研究结果相似。
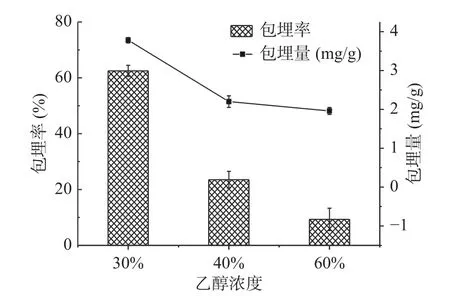
图4 SNPs对山奈酚包埋率Fig.4 Effect of SNPs on embedding rate of kaempferol
2.1.5 山奈酚在模拟人体外环境中的释放情况SNPs-山奈酚和山奈酚溶液的释放率结果如图5所示。可以明显看出,释放时间3 h下,山奈酚原料药基本完全释放,释放率为93.75%,释放速度较快;SNPs-山奈酚颗粒相对山奈酚原料药释放速度较为缓慢,可持续释放时长为20 h,SNPs-山奈酚对药物的缓释性能明显。结合侯敬申等[24]研究成果,山奈酚在50~175 μmol/L的浓度下,可明显抑制人胆囊癌细胞的增殖,30%乙醇制备下的SNPs-山奈酚释放率可达88.75%,释药量与其相近,为SNPs-山奈酚的实际应用提供了参考。此外释放率还与其山奈酚的包埋量呈现正相关,包埋量较高时,释药率较高。

图5 山奈酚在模拟人体外环境中的释放情况Fig.5 Release of kaempferol in a simulated human external environment
2.1.6 在模拟人体胃肠消化液中山奈酚的释放情况如图6所示,释放时间3 h下,SNPs-山奈酚的释放率受乙醇浓度影响较大,缓释介质中乙醇浓度的升高使得释放速率加快,这与山奈酚易溶于乙醇,对乙醇的相亲性更高有关。SNPs-山奈酚在模拟胃液中释放速率高于模拟肠液的释放速率,pH较低,缓释的速率较快,这可能归结于在较低的pH下,淀粉发生溶蚀相关,加快了山奈酚的溶出速率。这与候晓苹等[25]在微孔淀粉对维生素C、茶碱和BSA缓释的研究相似。
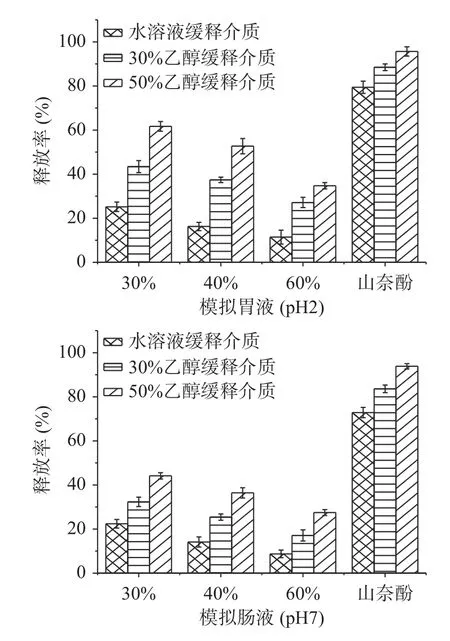
图6 在模拟人体胃肠消化液中山奈酚的释放情况Fig.6 Release of kaempferol in simulated human gastrointestinal digestive juice
2.1.7 山奈酚的稳定性 黄酮类化合物由于不饱和结构,水溶液中易于氧化和降解,颜色会逐渐变浅,吸光值降低,记录吸光值的变化可以计算山奈酚的保留率[26−27]。由图7知,在5 h内,SNPs-山奈酚的溶液中山奈酚的保存率都在75%以上,高于山奈酚水溶液的保留率,且保留率和乙醇的浓度呈现正相关性,可能是因为山奈酚在醇溶液中充分溶解,山奈酚上的羟基与醇羟基形成氢键作用,不易被氧化;而在水溶液中,山奈酚不溶解,羟基与氧气接触较多,易被氧化。保留率测试数据表明,经过纳米淀粉包埋后溶液具有一定的稳定性,SNPs-山奈酚包埋后的溶液在5 h内对山奈酚具有较好的保存作用,为纳米淀粉在负载药物方面提供参考。这与Sedef等[5]利用天然纳米壳聚糖对山奈酚进行负载,其结果表明可在30 d内显著抑制细菌的生长,山奈酚具有良好的稳定性的研究结果相似。
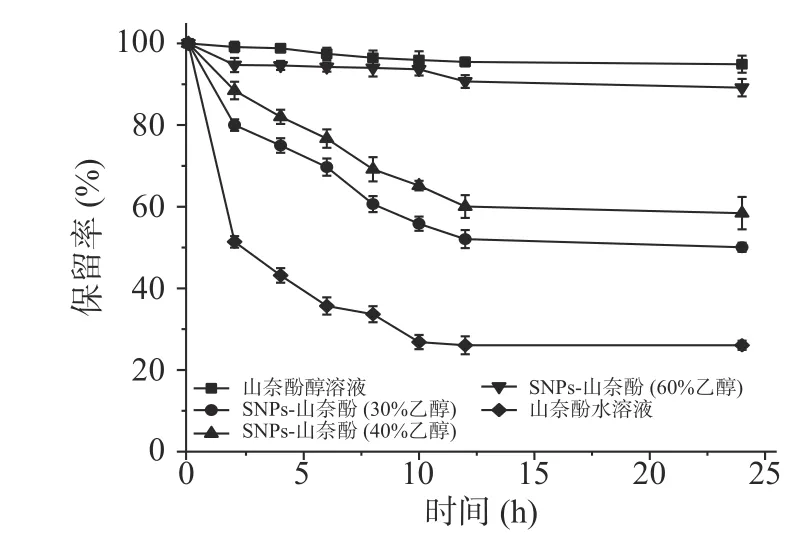
图7 山奈酚在不同时间下的保留率Fig.7 Retention rate of kaempferol at different time
3 结论
本文在无任何稳定剂和有毒溶剂参与采用超声波搅拌法下制备出形貌较好,颗粒尺寸分布均匀的纳米淀粉颗粒。利用淀粉直链分子单螺旋空腔内的疏水性和纳米淀粉颗粒内部的疏水性微质,在纳米沉降过程中通过淀粉分子与山奈酚之间的氢键的缔合和直链淀粉的疏水空腔,以此完成对疏水性药物山奈酚的包埋,制备出纳米级别的SNPs-山奈酚颗粒。SNPs-山奈酚的包埋率受乙醇浓度影响,在30%乙醇下包埋率最高,为62.94%,60%乙醇下包埋率最低,为9.31%。SNPs-山奈酚在模拟体液条件下的药物缓释性能明显,可持续在体外释放在20 h,30%制备SNPs-山奈酚释药量可达88.75%,且释药量与包埋量呈现正相关,且释放率受缓释介质中乙醇浓度的影响,乙醇浓度增大,释放速率加快。包埋后的SNPs-山奈酚溶液在5 h内的保留率在75%以上,淀粉纳米颗粒具有稳定的包埋作用。综上所述,本文在纳米淀粉制备的沉降过程中,研究了一种新的纳米淀粉对疏水性药物包埋负载的方法,为纳米淀粉在医药方面的应用提供参考。
