盐胁迫下不同水稻品种苗期植物内源激素含量的变化特征
2022-01-19姚栋萍贺荣华
沈 泓,张 樱,张 轩,姚栋萍,2,3,贺荣华,陈 哲,张 柳,柏 斌,3
(1. 湖南杂交水稻研究中心,杂交水稻国家重点实验室,湖南 长沙 410125;2. 湖南农业大学农学院,湖南 长沙 410128;3. 国家耐盐碱水稻技术创新中心,湖南 长沙 410125;4. 湖南省永州市宁远县农业农村局,湖南 永州 425699)
土壤盐渍化是一个全球性生态问题,也是当今世界耕地退化和土地荒漠化的主要原因之一。我国土壤盐渍化具有面积大、分布广、类型多的特点。据统计,我国盐碱土壤面积达1亿hm2,且呈不断加重趋势[1]。在不同的生长发育时期,水稻对土壤盐碱的耐受程度不同,其中幼苗期对盐胁迫最为敏感[2]。盐碱地种稻是一项“寓改良于利用”的技术,不仅能有效利用盐碱地提高粮食产量,而且可以通过水稻根系所分泌的有机酸减轻土壤的盐碱化程度,起到土壤改良作用[3]。虽然目前已有海水稻等耐盐水稻品种的相关报道,也有许多关于盐胁迫对水稻种子萌发与幼苗根系生长影响及其作用机理的研究,但是植物激素对水稻耐盐调控的相关研究尚不多见。
在盐胁迫下水稻植株首先表现出各种生长发育过程受阻[4],其危害机理通常为渗透胁迫、离子毒害和氧化胁迫[5],而植株耐盐生理调节机制主要包括渗透调节、养分调节、抗氧化调节和激素调节,其中植物内源激素发挥着重要的调节作用。研究表明,主要有3种内源激素参与水稻的盐胁迫调控。一是水杨酸(Salicylic acid,SA)。盐胁迫条件下,水杨酸可通过诱导抗氧化防御系统或增强抗氧化能力,缓解膜脂过氧化的伤害,并通过降低质膜通透性改善细胞的代谢,调控离子吸收与分布,缓解盐胁迫的压力[6-7]。二是脱落酸(Abscisic acid,ABA)。在盐胁迫条件下,ABA可诱导植物渗透调节物质脯氨酸(Pro)大量积累,缓解盐分过高造成的渗透胁迫和离子毒害,维持水分平衡[8],并提高相关保护性酶的活性[9],从而减轻植物的盐害。三是茉莉酸(Jasmonic acid,JA)。该内源激素与ABA结构相似[10],也是一种防卫信号分子,经信号转导调控气孔的闭合,以削弱蒸腾作用进而减少水分的散失[11]。
植物内源激素的含量很低,通常在10-6~10-9g之间[12];且性质不稳定,易分解或对周围环境和介质温度敏感[13];加之植物机体构成复杂,粗提液中往往含有大量基质,使得植物激素的测定分析容易受到干扰[14]。因此,检测植物激素时,操作必须简便、快速,仪器必须灵敏、专一。目前,植物激素主要采用色谱-质谱联用技术测定,可分为气相色谱-质谱联用(Gas chromatography-mass spectrometry,GC-MS)和液相色谱-电喷雾-串联质谱法(HPLC-ESI-MS/MS)。GC-MS虽然在灵敏度问题上能满足植物激素的测定要求,但对样品的纯化要求很高,样品需要进行衍生化处理,使样品前处理步骤变得更加繁琐[15]。而HPLC-MS/MS不仅具有灵敏度高和选择性好的特点,且该方法不需要对样品进行繁琐的衍生化处理,操作步骤简化,检测效率较高,适用于热稳定化合物、极性化合物等物质的测定。因此,普遍采用HPLC-MS/MS法测定植物激素[16]。但是目前有关盐胁迫下植物激素含量变化的研究报道较少,且无法精准定量检测植物内源激素含量变化。笔者改进了NY/T 2871—2015[17]中水稻植物激素的检测方法,使检测方法的准确度与精确度更高,以便更精准地分析植物内源激素含量的变化。研究比较了不同水稻品种在相同盐胁迫下茉莉酸(JA)、水杨酸(SA)、脱落酸(ABA)3种植物激素含量的变化,初步探讨了水稻耐盐能力与植物激素的关联性,从而明确对水稻耐盐能力起关键作用的植物内源激素,为今后通过调节激素水平提高水稻耐盐能力提供参考。
1 材料与方法
1.1 试验材料
供试水稻品种有耐盐品种超优千号、Y两优900以及盐敏感品种IR64,均由湖南杂交水稻研究中心 提供。
主要试验试剂有Yoshida水稻营养液(Coolaber公司)、HPLC甲醇(Merck公司)、HPLC甲酸(科密 欧)、甲酸铵(Sigma-Aldrich)、纯水(Waters蒸馏水)。茉莉酸(JA)、水杨酸(SA)、脱落酸(ABA)的标准品均来自sigma-aldrich西格玛奥德里奇(上海)贸易有限公司。
主要仪器设备有三重四极杆液相色谱-质谱联用仪(SHIMADZU LCMS-8060)、C18色谱柱(Shim-pack GIST-HP 2.1 mm×50 mm,3 µm)、分析天平(Mettler toledo)、涡旋振荡器(其林贝尔仪器制造有限公司)、台式超速冷冻离心机(德国Eppendorf)、移液枪(德国Eppendorf)、氮吹仪(上海锦文仪器设备有限公司)、混合型阴离子交换固相萃取柱(上海安谱实验科技仪器有限公司)、超低温冰箱(三洋冷链公司)、冰箱(青岛海尔股份有限公司)、超纯水设备(莱特莱德纯水设备技术有限公司)、光照培养箱(韶关市广智科技设备有限公司)等。
1.2 试验方法
1.2.1 标准品溶液配制精确称取各植物激素标准品适量,用甲醇溶解制成浓度为1000 µg/mL标准储备液;分别吸取一定量的3种植物激素标准储备液,用甲醇制成浓度为1 µg/mL的混合标准储备液;分别吸取一定量的混合标准储备液,用80%甲醇水制成浓度为0.5~100 µg/L的植物激素混合标准工作液。
1.2.2 水稻幼苗培养取3个品种的水稻种子各约200粒,在50℃烘箱中处理3 d后置于35℃、光照强度两级的光照培养箱中浸泡至露白;待种子发芽后,放入96孔板,每孔放置一颗发芽种子,将96孔板放入盛有纯水的托盘内,盖上保鲜膜,置于光照培养箱培养;待幼苗的主根长至2~3 cm时(一般3~4 d),将托盘内的纯水改为1/2 Yoshida培养液(pH值5.5),并转移到人工气候室进行培养;培养6 d后,将1/2培养液改为全培养液(pH值5.5);注意每3 d更换一次培养液,并确保培养液体积不变。人工气候室的培养条件:光照时间14 h,温度(25±4)℃;黑暗时间10 h,温度(20±2)℃;光照强度为240~350 µmol/(m2·s);相对湿度为60%~70%。每个品种设置试验组和对照组。
1.2.3 苗期盐处理待幼苗长至3叶一心时更换新的全培养液,加入浓度0.8%的NaCl进行盐处理。每周更换一次全培养液,并且重新加入相应浓度的盐,确保盐浓度的稳定。期间注意观察水稻幼苗的形态变化,并拍照记录。
1.2.4 样品采集及前处理(1)样品采集:分别采集盐胁迫0(对照组)、6、24和72 h的水稻幼苗样品,采样时将茎叶与根分开,用锡箔纸包好,做好标记后于-80℃冰箱中避光保存。(2)样品前处理:研钵预冷,将茎叶放入研钵中,加入液氮研磨,称取0.1 g试样(精确到0.1 mg)于2 mL塑料离心管中,加入1 mL预冷(4℃)的80%甲醇水,置于4℃冰箱中浸提16 h,期间振摇2~3次;取出,于4℃下13000 r/min离心15 min后,倾出上清液;往残渣中再次加入1 mL 80%甲醇水,漩涡振荡,按上述条件离心,合并2次提取液于10 mL容量瓶中,加入2 mL 80%甲醇水后用水稀释至刻度线,混匀;移取4.00 mL上述提取液过混合性阴离子交换固相萃取柱(使用前需活化),依次用2 mL纯水和2 mL甲醇淋洗,用2 mL 1%甲酸甲醇溶液洗脱2次,用5 mL离心管收集洗脱液,并于50℃下氮吹干,加水稀释至0.5 mL,漩涡混匀,滤膜过滤,待测。
1.2.5 检测方法优化(1)色谱条件:Shim-pack GIST-HP C18(2.1 mm×50 mm,3 µm)色谱柱;设置2种流动相A,一是5 mmol/L甲酸铵,二是5 mmol/L甲酸铵-0.02%甲酸溶液,考察哪种溶液更适合作为流动相A;流动相B为甲醇;流速0.4 mL/min;进样体积5 µL;柱温40℃;梯度洗脱程序0~6 min 20%~90% B、6~8 min 90% B、8~8.1 min 90%~20% B、8.1~13 min 20% B。(2)质谱条件:电喷雾离子源负离子模式(ESI-);离子源接口电压3.0 kV;离子源温度300℃;脱溶剂管温度526℃;加热模块温度400℃;雾化气为氮气,3.0 L/min;干燥气为氮气,10.0 L/min;碰撞气为氩气;检测方式为多反应监测(MRM)。优化后,3种植物激素的MRM参数见表1。

表1 优化后的MRM参数
1.2.6 方法学考察(1)线性关系、检出限及定量限:将0.5、1、5、10、25、50和100 µg/L的系列混合标准溶液进行HPLC-MS测定,每个样进3针,以浓度 (µg/L)为横坐标、峰面积为纵坐标制作标准曲线,进行线性回归分析;并通过信噪比S/N=3和S/N=10计算得出方法的检出限(LOD)与定量限(LOQ)。(2)精密度:以5、50和100 µg/L这3种浓度水平的混合标准溶液在优化后的色谱-质谱条件下按顺序连续进样5次,通过计算3种植物激素的保留时间和峰面积的相对标准偏差(RSD,%)来衡量精密度。
2 结果与分析
2.1 同时测定3种植物激素的方法优化
与NY/T 2871—2015中的方法相比,该研究的优化在于:(1)将样品减少为0.1 g,使用较小的离心管,让提取液与样品充分接触;(2)将氮吹步骤的吹至“近干”改为“全干”,以改善误差问题;(3)将原来的流动相A 5 mmol/L甲酸铵溶液改为5 mmol/L甲酸铵-0.02%甲酸溶液。如图1所示,当以5 mmol/L甲酸铵溶液为流动相A时,SA、JA和ABA 3种植物激素的峰分离效果不佳,而以5 mmol/L甲酸铵-0.02%甲酸溶液为流动相A时,3种植物激素之间的分离度较好,各激素基线之间没有重叠。由此表明,该检测方法可同时进行SA、JA和ABA 3种植物激素的检测。
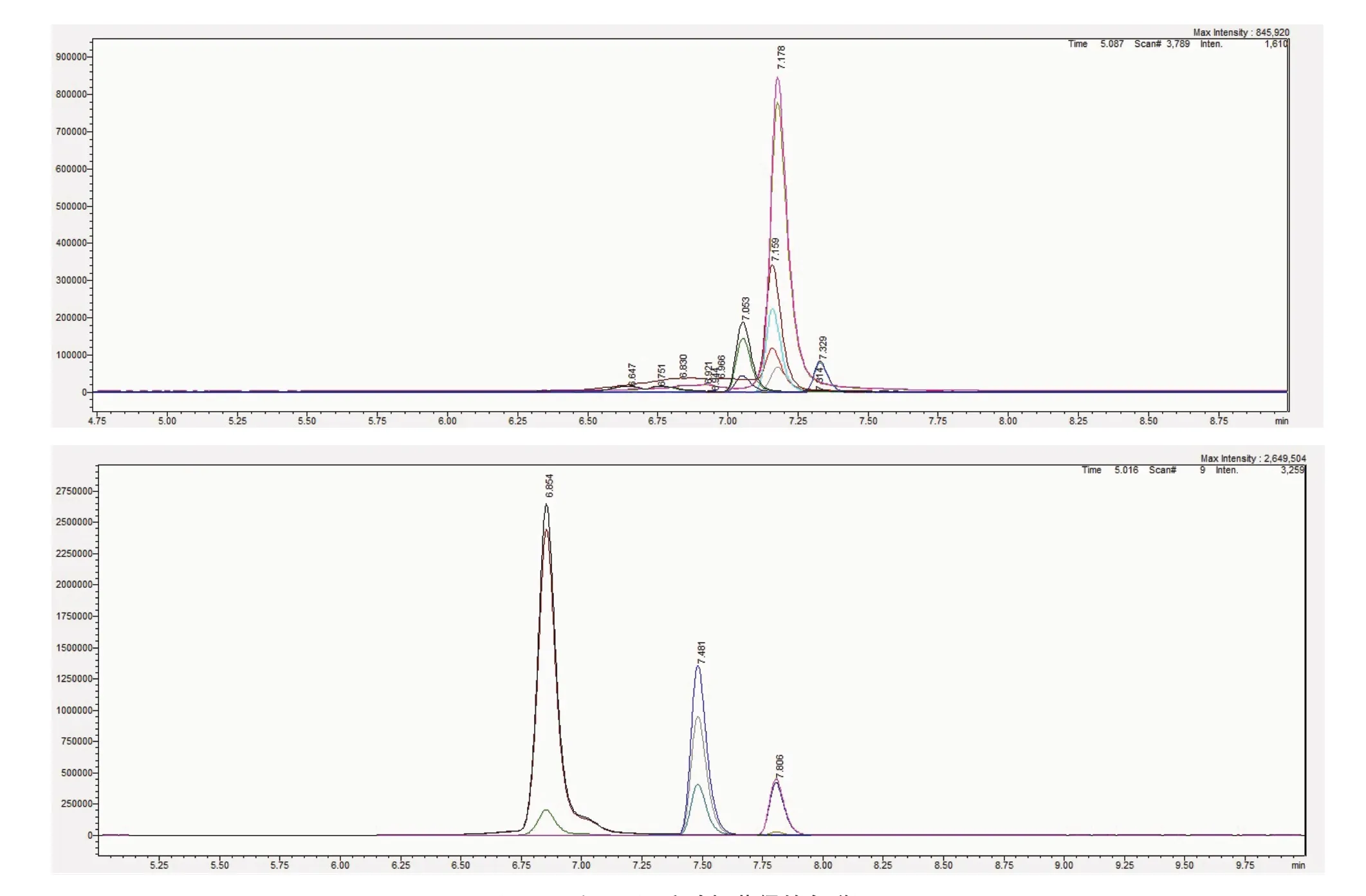
图1 采用不同流动相获得的色谱图
2.2 方法学考察
2.2.1 线性关系、检出限及定量限从表2中可以看出,3种植物激素在所选的浓度范围内与其峰面积都呈现出良好的线性关系,相关系数(R2)均大于0.999;该检测方法的灵敏度较高,检出限在0.02~0.08 µg/L之间,定量限在0.07~0.25 µg/L之间。

表2 3种植物激素的线性关系、检出限和定量限
2.2.2 精密度由表3可知,3种植物激素的保留时间相对标准偏差在0.100%~0.194%之间,峰面积相对标 准偏差在0.286%~3.125%之间,表明仪器精密度较优。
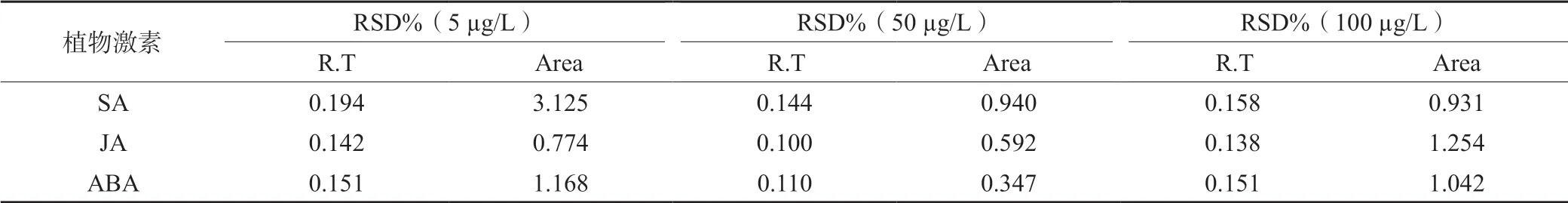
表3 3种植物激素保留时间和峰面积的重复性结果(n=5)
2.3 盐胁迫不同时间后各水稻品种幼苗的形态表现
3个供试水稻品种在不同盐处理时间下的生长状况如图2所示。在盐处理之前,耐盐品种Y两优900、超优千号与盐敏感品种IR64的水稻苗期长势不同,耐盐品种株型挺拔,而盐敏感品种叶片披散,株高相对矮小。经盐处理6 h后,2个耐盐品种并无明显 变化,而IR64经盐处理6 h后部分叶尖已经开始泛黄并出现轻微卷曲。经盐处理24 h后,2个耐盐品种的水稻叶片尚未出现明显变化,而此时IR64的叶片明显卷曲,且可较为清晰地看到叶尖部分的叶脉纹路颜色暗黄,表现出显著的盐胁迫特征。经盐处理72 h后,2个耐盐品种的叶尖部分泛黄,幼苗生长情况依旧良好;而此时IR64的叶片卷曲得更为严重,且泛黄明显。

图2 盐胁迫不同时间后各水稻品种幼苗的形态变化
2.4 盐胁迫不同时间后各水稻品种幼苗SA含量的变化
由图3可知,3个水稻品种叶片中植物激素SA的含量变化趋势不同,但在盐胁迫下,SA的含量都有所增加,只是不同品种中SA含量出现上升的时间点不同。盐敏感品种IR64的SA含量在盐胁迫前为(383.85±63.79) ng/g;随着盐胁迫时间的延长,其含量变化呈现出先增加后降低,再增加的规律。耐盐品种Y两优900的SA含量在盐胁迫前达到了(552.31±51.80) ng/g,高含量的SA可能与该品种的特殊耐盐性有着一定的关系;随着盐胁迫时间的延长,其含量变化呈现出下降的趋势,而在盐胁迫72 h后又略微升高。另一耐盐品种超优千号的SA含量在盐胁迫前为(186.49±10.76) ng/g,在盐胁迫24 h后,SA含量增加至(427.97±26.67) ng/g,在盐胁迫72 h时开始出现轻微的下降。

图3 盐胁迫下3个水稻品种苗期SA含量的变化
2.5 盐胁迫不同时间后各水稻品种幼苗JA含量的变化
由图4可知,在盐胁迫前,盐敏感品种IR64的JA含量明显高于另外2个耐盐品种;盐胁迫24 h时,JA的含量出现骤降;整体来看,随着盐胁迫时间的延长,JA含量变化呈现出先减少后增加的趋势。相较于盐敏感品种IR64,2个耐盐品种的JA含量变化较为缓和,差异不显著。Y两优900品种的JA含量变化在盐胁迫24 h内呈现出下降趋势,而在72 h其含量又有所增加;而超优千号品种在盐胁迫72 h内,JA含量一直呈现出逐渐下降的变化规律。

图4 盐胁迫下3个水稻品种苗期JA含量的变化
2.6 盐胁迫不同时间后各水稻品种幼苗ABA含量的变化
由图5可知,ABA作为一种逆境胁迫调控激素,在正常生理条件下其含量是极低的;但在经0.8%NaCl处理6 h后,ABA的含量显著升高;但随着盐胁迫时间的延长,ABA含量均有所下降;且3个水稻品种叶片的ABA均表现出相同的变化规律,该变化规律与他人的研究结果也一致。此外,对比3个水稻品种在盐胁迫24 h后ABA的含量可以发现:2个耐盐品种的ABA含量下降恢复得较快,特别是Y两优900,在盐胁迫24 h后ABA的含量已降至(99.37±4.61) ng/g;而盐敏感品种IR64的ABA含量相比之下恢复得较为缓慢。
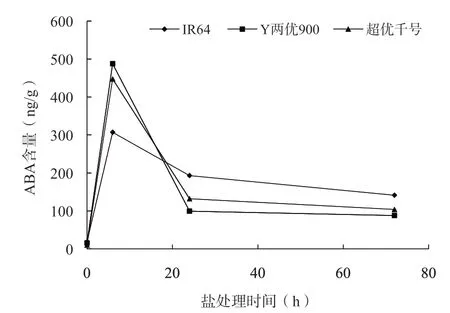
图5 盐胁迫下3个水稻品种苗期ABA含量的变化
3 讨 论
研究结果表明,脱落酸(ABA)在盐胁迫中起着非常关键的作用,对于胁迫环境极其敏感。盐胁迫初期ABA迅速积累,可使气孔关闭,降低蒸腾速率,并通过启动植物体内的各信号分子进行复杂的网络调控,以缓解盐胁迫造成的离子毒害和氧化损伤,尤其是渗透胁迫[18],从而减少或避免盐胁迫对植物生长的迫害,起到一定的保护作用。由于过多的ABA会抑制植物的生长,因此当水稻幼苗适应了这种环境胁迫后,ABA含量的降低,会让植物恢复正常的代谢水平与生长状态。
ABA作为植物激素响应胁迫的调控中心,同时还影响着其他植物激素的含量变化。3个水稻品种的JA含量在盐胁迫前期均呈降低趋势,原因尚不明确;但在盐处理一段时间后,JA含量有所增加,原因可能是ABA的积累促进了茉莉酸信号通路阻遏蛋白JAZ(Jasmonate-ZIM-domain,JAZ)的泛素化降解[19],从而释放JA下游基因的表达,表现为茉莉酸含量的增加,使自身耐受性得到进一步的提高。与耐盐品种不同的是,盐敏感品种IR64本身就含有较高的茉莉酸(JA),这可能是由于不同品种之间存在理化特性差异所致。李天雪等[20]在测定不同盐碱处理下金银花幼苗JA含量时发现,盐碱胁迫下JA含量会有所下降,在后期才会出现明显增加。试验中JA的含量变化规律与该研究相符。
研究改进了现行的植物激素检测方法,提升了植物激素检测的灵敏度和精确度,后期需通过内标法和衍生化处理,进一步提升植物激素前处理的回收率和检测的稳定性。通过探讨不同耐盐能力的水稻品种盐胁迫0、6、24和72 h下3种植物激素的含量变化,初步分析了3种植物内源激素含量变化规律以及激素间相互作用对水稻生长的影响,有助于解析植物激素参与水稻盐胁迫调控的生理机制,为水稻耐盐胁迫研究提供理论支撑。
