基质细胞衍生因子1及受体在创伤后异位骨化组织中的表达
2022-01-18熊文蔡贤华
熊文,蔡贤华
(1武汉市第四医院骨科,武汉 430000;2南方医科大学第一临床医学院(中部军区总医院),武汉 430070)
异位骨化(heterotopic ossification, HO)的病理过程一般认为是间充质干细胞(mesenchymal stem cell, MSC)在微环境和调控因子作用下的异常成骨过程,该过程由一系列信号分子控制[1-3]。基质细胞衍生因子1(stromal cell-derived factor 1,SDF-1)又称趋化因子C-X-C motif chemokine 12(CXCL12),是一种CXC亚家族趋化因子。与其它因炎症诱导产生的趋化因子不同,SDF-1由骨髓基质细胞、内皮细胞等持续产生,并在胚胎生长发育期,为B淋巴细胞和髓系细胞的生成、神经元形成和心血管内皮细胞发展所必需。SDF-1的趋化作用由其受体CXCR4介导,两者结合并通过相互作用启动下游信号通路。SDF-1或CXCL2/ CXCR4轴在机体的免疫、炎症、胚胎发育、器官发生、肿瘤、HIV病等多种生物学过程中发挥着重要作用[4-10],SDF-1及其受体促进间充质干细胞的趋化活性,可促进人脊髓韧带异位骨化[11],但其是否参与介导创伤后异位骨化中骨髓间充质干细胞动员、黏附和分化,目前尚不清楚。本实验采用免疫组织化学染色方法观察基质细胞衍生因子1及其受体在关节创伤后异位骨化组织中的表达,探讨其在创伤后异位骨化发病中的作用。
材料与方法
1 标本收集
收集2019年1月至2020年12月武汉市第四医院骨科31例手术患者骨组织标本,分为2组。实验组:髋关节创伤或手术后异位骨化9例,膝关节创伤后异位骨化2例,肘关节创伤或手术后异位骨化10例;男13例,女8例;年龄22~55岁,平均33岁;均为创伤或手术后9~16个月;收集术中切除的异位骨化组织标本。对照组:外伤致肢体严重毁损行截肢术的患者10例,收集术中切除的骨组织标本;男7例,女3例;年龄23~56岁,平均年龄35岁。实验方案得到医院伦理委员会批准,征得患者知情同意。纳入标准:①实验组,异位骨化组织形成8个月后,连续观察3个月无进一步加重,碱性磷酸酶正常,骨扫描检查显示异位骨化已成熟;②对照组,肢体毁损,无保肢条件,取标本处骨组织完整。排除标准:①肢体存在血管病变,②肢体存在骨髓炎、骨肿瘤等骨质破坏病变。
2 主要试剂及仪器
兔抗SDF-1 或 CXCL12(17402-1-AP)和兔抗CXCR4(11073-1-AP)一抗购自三鹰公司(武汉),HRP标记的山羊抗兔二抗(G23303)、DAB显色试剂盒(G1211)、EDTA抗原修复液(pH9.0; G1203)和牛血清白蛋白(BSA)购自Servicebio公司(武汉);RM2016病理切片机(上海徕卡仪器有限公司),XSP-C204显微镜(CIC公司),DHG-9140A烤箱(上海慧泰仪器制造有限公司),JJ-12J脱水机(武汉俊杰电子有限公司),JB-P5包埋机(武汉俊杰电子有限公司),WGK2430包埋框(武汉Servicebio公司),KD-P摊片机(浙江省金华市科迪仪器设备有限公司)。
3 组织切片制备
取材:取出术中采集的标本,清除周围软组织,切成大小约1cm×1cm×0.3cm骨块,4%多聚甲醛固定液固定24h,标记后放入有孔的EP管或包埋框中,然后放入螺旋试剂桶中,倒满新型脱钙液,密封,恒温摇床上(25~30℃,110~120r/min)脱钙2~4d,每2d观察一次脱钙程度,每2~3d更换一次脱钙液。
脱水、浸蜡与包埋:取出脱钙后标本,流水冲洗4~5h,放入脱水吊篮,于脱水机内依次梯度乙醇脱水:5%乙醇2h,85%乙醇2h,90%乙醇1.5h,95%乙醇2h,无水乙醇I 、II各 2h;无水乙醇和二甲苯1:1混和的试剂40min,二甲苯I 、II 各40min,石蜡浸透3次,分别 0.5h、1h和2.75h;更换石蜡,在蜡凝固之前将组织从脱水盒内取出,按照包埋面的要求放入包埋框并贴上对应的标签,于-20°冻台冷却,蜡凝固后将蜡块从包埋框中取出并修整蜡块。
切片:将修整好的蜡块置于石蜡切片机切片,厚4μm。切片漂浮于摊片机40℃ 温水上使其展平,用载玻片将切片捞起,入60℃ 烘箱内烤片。
4 免疫组织化学染色
石蜡切片脱蜡至水:依次将切片放入二甲苯Ⅰ15min,二甲苯Ⅱ15min,二甲苯III 15min,无水乙醇Ⅰ5min,无水乙醇Ⅱ5min,85%乙醇5min,75%乙醇5min,蒸馏水洗。
抗原修复:组织切片置于盛满EDTA抗原修复缓冲液(pH9.0)的修复盒中于微波炉内进行抗原修复,中火10min至沸,停火5min保温再转中低火5min,停火2min,再转中低火5min,此过程中应防止缓冲液过度蒸发,切勿使切片干燥。自然冷却后将玻片置于0.01mol/L PBS(pH7.4)中在脱色摇床上晃动洗涤3次,每次5min。
阻断内源性过氧化物酶:切片放入3%H2O2水溶液,室温避光孵育25min,继而于PBS中振摇洗涤3次,每次5min。
血清封闭:滴加PBS配制的3%BSA 均匀覆盖组织,室温封闭30min。
一抗孵育:轻轻甩掉封闭液,滴加用PBS稀释的一抗(CXCL12,1:100;CXCR4,1:200),湿盒内4°C孵育过夜。
二抗孵育:将切片置于PBS(pH7.4)中在脱色摇床上晃动洗涤3次,每次5min。稍甩干后滴加二抗(1:200),室温孵育50min。
DAB显色:将切片置于PBS(pH7.4)中在脱色摇床上晃动洗涤3次,每次5min;稍甩干后滴加新鲜配制的DAB显色液,显微镜下控制显色时间,阳性为棕黄色,自来水冲洗切片终止显色。
复染细胞核:苏木素复染3min左右,自来水洗,苏木素分化液分化数秒,自来水冲洗,苏木素返蓝液返蓝,流水冲洗。
脱水封片:将切片依次放入75%乙醇5min,85%乙醇5min,无水乙醇Ⅰ5min,无水乙醇Ⅱ5min,二甲苯Ⅰ5min,脱水透明;将切片从二甲苯中取出稍晾干,中性树胶封片。
5 结果观察与图像采集分析
染色结果测定:苏木素染细胞核为蓝色,DAB显出的阳性表达为棕黄色。用CIC XSP-C204显微摄像系统对SDF-1、CXCR4免疫反应性进行定量分析。每张切片随机选取5个高倍视野(40),测定每个视野下SDF-1、CXCR4的阳性反应的平均光密度,以每例5个视野的平均光密度平均值作为该例患者的测量值。
统计学分析:应用SPSS 23.0软件进行统计分析,定量数据用x±s表示,两组数据间采用独立样本t 检验,P< 0.05为差异有显著性意义。
结 果
免疫组织化学染色显示:在非异位骨化标本中,SDF-1和 CXCR4免疫反应性较弱,血管周围有少量SDF-1和CXCR4阳性细胞;可见少量成纤维细胞样细胞,排列整齐,其中少数成纤维细胞样细胞SDF-1和CXCR4阳性(图1A,图2A)。在异位骨化组织中SDF-1和CXCR4免疫反应性较强,血管周围有大量的SDF-1和CXCR4阳性细胞,大量成纤维细胞样细胞呈较强SDF-1和CXCR4阳性(图1B、C,图2B、C)。
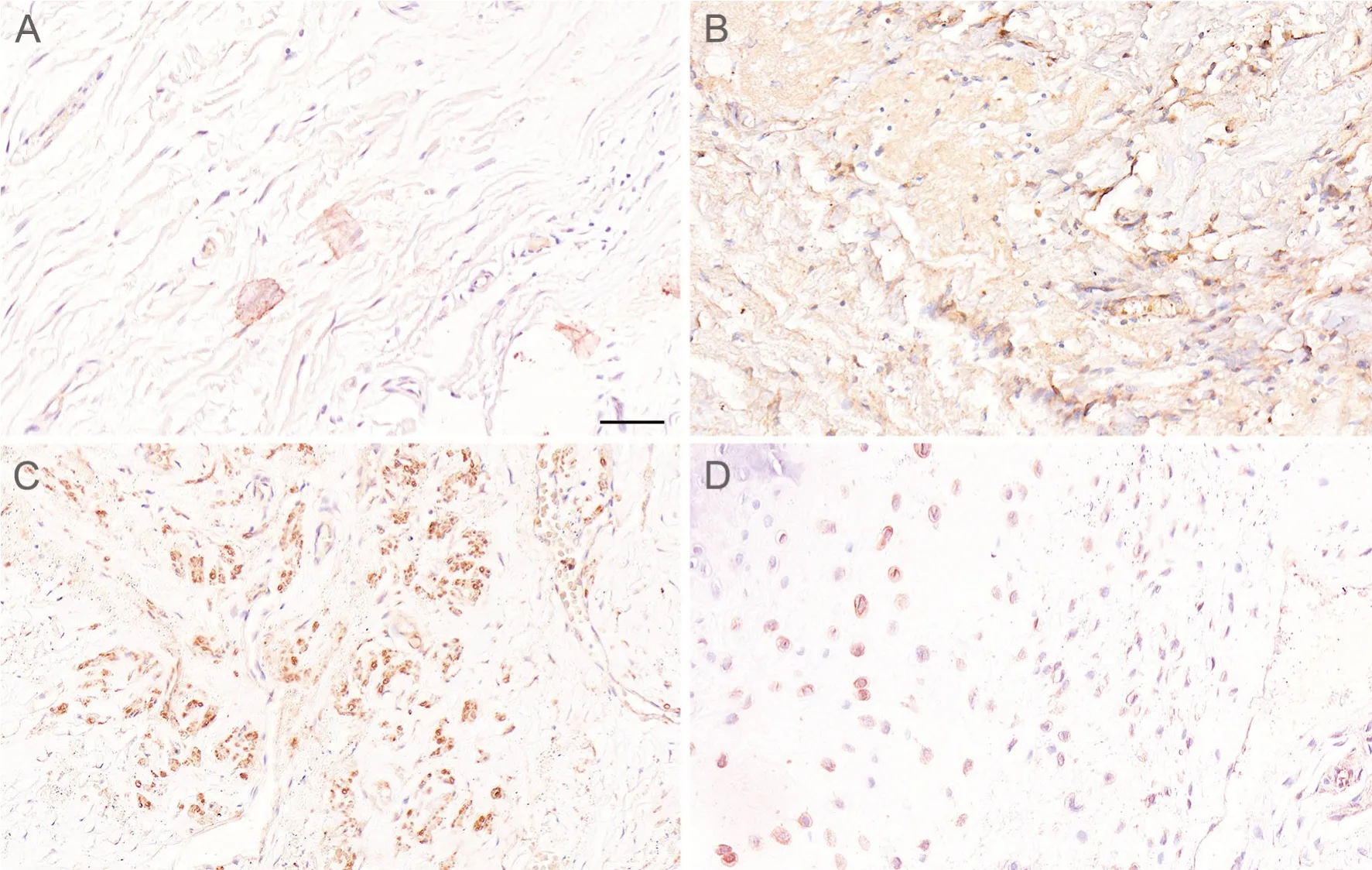
图1 SDF-1表达水平免疫组织化学检测。A,非异位骨化组织,SDF-1免疫反应性较弱;B,异位骨化组织中成纤维细胞增生,有大量细胞呈较强SDF-1阳性;C,在异位骨化组织中血管生成丰富,血管周围有大量细胞呈较强SDF-1阳性;D,在异位骨化组织中软骨细胞增生,有大量细胞呈较强SDF-1阳性;比例尺,50μmFig. 1 Immunohistochemical staining of SDF-1. A, weak SDF-1 immunoreactivity in normal bone tissues; B, fibroblasts proliferated in heterotopic ossified tissues, and a lot of cells were strongly SDF-1 positive; C, angiogenesis was abundant in heterotopic ossified tissues, and a great many cells around the blood vessels were strongly SDF-1 positive; D, chondrocytes proliferated in heterotopic ossified tissues, and plenty of cells were strongly SDF-1 positive; scale bar, 50μm
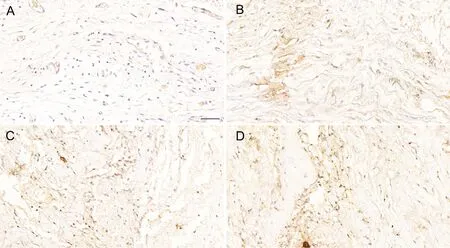
图2 CXCR4表达水平免疫组织化学检测。A,非异位骨化组织,CXCR4免疫反应性较弱;B,异位骨化组织中成纤维细胞增生,有大量细胞呈较强CXCR4阳性;C,在异位骨化组织中血管生成丰富,血管周围有大量细胞呈较强CXCR4阳性;D,在异位骨化组织中软骨细胞增生,有大量细胞呈较强CXCR4阳性;比例尺,50μmFig. 2 Immunohistochemical staining of CXCR4. A, weak CXCR4 immunoreactivity in normal bone tissues; B, fibroblasts proliferated in heterotopic ossified tissues, and a large number of cells were strongly CXCR4 positive; C, angiogenesis was abundant in heterotopic ossified tissues, and a great many cells around the blood vessels were strongly CXCR4 positive; D, chondrocytes proliferated in heterotopic ossified tissues, and plenty of cells were strongly CXCR4 positive; scale bar, 50μm
对非异位骨化和异位骨化组织中SDF-1和CXCR4免疫反应性强度进行定量分析显示:异位骨化组织中SDF-1和CXCR4免疫反应性强度显著高于非异位骨化组织(图3)。

图3 非异位骨化和异位骨化组织中SDF-1和CXCR4免疫反应性(阳性反应产物平均光密度)比较。HO,异位骨化;Non-HO,非异位骨化。**,P<0.01Fig. 3 Comparison of SDF-1 and CXCR4 immunoreactivity (mean optical density of positive reaction products) in non-heterotopic ossification and heterotopic ossification. HO, heterotopic ossification; Non-HO,non-heterotopic ossification. **, P<0.01
讨 论
目前认为大部分HO主要是软骨内成骨,成骨的前体细胞、多种诱导因子及相关信号通路、适宜的微环境是3个重要前提条件。细胞因子和化学诱导物在调控动员,运行及归巢中发挥重要作用。这当中基质细胞衍生因子1(SDF-1)及其受体CXCR4,在调控干细胞动员,定向迁移,归巢过程发挥独立的作用[12]。CXCR4在正常时几乎无表达,而在局部缺血时表达明显增加。组织器官损伤后产生的炎症因子可刺激骨髓间充质干细胞内部的CXCR4转移到细胞表面,SDF-1的浓度梯度对MSC表面的CXCR4具有极强的化学吸引作用,其与CXCR4的特异结合介导MSC的定向迁移和归巢,而当SDF-1或CXCR4被阻断后,这种定向迁移也就被阻断[13,14]。研究[15-18]已经证实,当组织或器官损伤后,SDF-1表达量明显增加,损伤部位会出现大量MSCs,在使用CXCR4拮抗剂AMD3100或CXCR4抗体后,损伤部位 MSCs 则明显减少。使用扩髓髓内钉治疗骨折后血清SDF-1因子水平升高,外周血SDF-1水平升高与骨髓MSCs的CXCR4 mRNA水平呈负相关[19]。Otsuru等[20]报道SDF-1/CXCR4信号通路可募集循环系统中骨髓来源的骨祖细胞,参与异位骨形成。研究[21]证实 SDF-1 会在骨损伤部位高表达,从而趋化CXCR-4+的骨髓间充质干细胞向骨损伤部位募集,参与骨再生[22]。Thieme 等[23]通过体外实验表明,激活SDF-1/CXCR4信号通路可使骨髓间充质干细胞发生迁移,并激活 Runx2信号通路使骨髓间充质干细胞分化为成骨细胞。Wei Xu[24]发现HIF-1α在缺氧诱导的间充质干细胞迁移中通过SDF-1/CXCR4信号通路发挥作用。He Nie[25]发现IL-1β预处理可通过增加CXCR4的表达部分增强MSCs的归巢能力。Zhu[26]等研究表明SDF-1能促进BMP2诱导C2C12和ST2细胞分化为成骨细胞,阻断SDF-1信号,则可抑制BMP2诱导分化成骨细胞。
SDF-1、CXCR4在异位骨化组织中的表达及意义 在正常生理状态下SDF-1、CXCR4表达高度受限,多数组织内检测不到或低表达,仅存在于组织损伤、炎症、肿瘤组织中。这在本实验中也得到验证,对照组中SDF-1、CXCR4基本为阴性表达。本实验在创伤后异位骨化组织中检测到SDF-1、CXCR4高表达,且多位于异位骨化组织中的骨髓腔中,由此可以确定SDF-1、CXCR4在异位骨化中MSC的动员,粘附和分化中起到一定的作用。而Shunfu Chin[27]报道在黄韧带骨化的组织标本中SDF-1、CXCR4也存在高表达,这与我们的研究结果一致。Michio Arakura[28]发现SDF-1和CXCR4的基因表达和定位在骨折愈合过程中发生改变,这可能导致糖尿病患者骨折愈合受损。Jia Xu[29]发现在牵张成骨中,骨折愈合过程中SDF-1和CXCR4的基因表达和定位发生改变,这可能导致SDF-1和成骨基因在牵张成骨区表达水平高于骨折区,且在撑开期结束时SDF-1表达水平最高。徐炜[30]发现SDF-1/CXCR4信号轴在颅脑损伤时骨折加速愈合发挥了关键作用;SDF-1/CXCR4信号轴对MSCs的迁移存在剂量浓度依赖。罗伟[31]发现在失神经骨折愈合早期SDF-1呈高表达,提示在失神经骨折愈合早期可能在骨折愈合早期通过募集间充质干细胞、促进成骨分化、调控新生血管形成发挥作用。尽管MSCs与SDF-1/CXCR4轴在异位骨化中的关系仍存在争议,但这些报道和我们的结果表明,MSCs可能通过上调SDF-1/CXCR4轴与异位骨化有关。我们推测SDF-1/CXCR4轴在异位骨化的过程中起重要作用。MSC与SDF-1/CXCR4轴在异位骨化中的调控机制有待进一步研究。
