用优化的切向流超滤法提高环境水中对虾白斑综合症病毒的浓度及检测效率
2022-01-18谢艳辉孙思阳斯泽恩李家侨
张 娜 , 刘 荭 , 谢艳辉 , 黄 磊 , 孙思阳 , 斯泽恩 , 李家侨
(1. 湛江海关技术中心 , 广东 湛江 524000 ; 2. 深圳海关动植物检验检疫技术中心 , 广东 深圳 518045 ;3. 南昌海关技术中心 , 江西 南昌 330038)
环境DNA(Environmental DNA,eDNA)是环境样本中发现的许多不同生物体基因组DNA的复杂混合物[1]。土壤、沉淀物、水甚至粪便被视为环境样品,其中也包括过滤空气或水、过滤沉积物或大块状样品所产生的物质[2]。水作为水产养殖的重要环境介质,是病毒传播和运输的最重要的组成部分[3],但是由于水中的病毒滴度低,并且水的样品成分复杂,需要进行水样品处理来得到足够量的病原数量进行检测,而在这方面的研究较少。从大量的环境水中进行病毒的浓缩,来研究水环境DNA中的病毒检测方法对样品处理要求较高。
白斑综合征病毒(White spot syndrome virus,WSSV)是一种包膜双链DNA病毒,属于线头病毒科(Nimaviridae)白斑病毒属。WSSV病毒粒子呈卵圆形、椭圆形或杆状,规则对称,直径80~120 nm,长250~380 nm。它已成为虾养殖中的一种破坏性病毒病原体。该病毒的宿主范围广泛,WSSV可垂直传播,也可经水和摄食感染组织(如残食同类、捕食等)进行水平传播,或通过诸如多毛蠕虫、饵虾、轮虫甚至可能是鸟类等携带者传播[4]。一些研究尝试在水中检测WSSV。
Hossain等[5]通过聚合酶链反应(PCR)对水样离心分离得到的沉积物进行了测试,并报告了12份虾池和水样中的5份检测WSSV呈阳性,该方法对病毒颗粒通过过滤器,并在低速离心后使病毒保持悬浮状态。Quang等[6]研究称,可以在沿海环境中检测到WSSV,如病虾池和周围运河,使用膜过滤,该方法仅捕获黏附在过滤膜上的海水颗粒物上的病毒。这些研究采用离心法和膜过滤法,未采用病毒浓缩法,因此,这些方法可能低估了水中真实的病毒量。
切向流过滤(Tangential flow filtration,TFF)是指液体流动方向与过滤方向呈垂直方向的过滤形式,采用交叉流动过滤形式,流向是切向于过滤膜表面。只有小部分液体透过过滤介质,截留的颗粒从膜的表面被“扫除”。切向流膜过滤技术适用于较大规模样品处理。传统的微孔过滤,包括除菌过滤所采用的过滤形式,其液体的流动方向与过滤方向一致,随着过滤的进行,过滤膜表面形成的滤饼层或凝胶层厚度逐渐增大,流速逐渐降低。当过滤介质为孔径细小的超滤膜或微滤膜时料液中固形物含量很高时,流速将急速降低,因此传统的过滤只能处理小体积的样品。对于较大规模的样品过滤时,需要采用切向流过滤方式,液体流动在过滤介质表面产生剪切力,减小了滤饼层或凝胶层的堆积,保证了稳定的过滤速度。
本试验是探讨切向流过滤超滤(Ultrafiltration,UF)技术浓缩养殖水样中的病毒浓度的有效性,以特异性检测WSSV病原体,对水生动物环境水中的病毒研究提供有效的样品处理方法。
1 材料与方法
1.1 试验材料 实验室保存的患白斑综合症的南美白对虾阳性样品;DNeasy Blood and Tissue Kit(Qiagen,德国);PremixExTaq(Probe qPCR),购自宝生物(TaKaRa)工程(大连)有限公司;微滴式数字PCR用探针法反应预混液(含dUTP)、样本制备通用试剂盒(广州永诺生物科技有限公司);PCR管、吸嘴等均为Axygen产品。0.2 μm孔径TFF滤筒(CFP-2-E-4MA,表面积420 cm2),超滤滤柱UFP-100-C-4MA、UFP-300-C-4MA、UFP-100-E-4MA(GE Health Care Bio Sciences Corp.)。
1.2 主要仪器设备 荧光定量PCR仪(ABI 7500);高速冷冻离心机(Eppendorf centrifuge 5417R);真空泵(津腾,GM-0-33A);基因扩增仪(ETC 811,东胜龙);真空离心浓缩仪(ZL3-1K,湖南可成仪器);数字PCR样本制备仪(MicroDrop-100A,广州永诺生物科技有限公司);数字PCR生物芯片阅读仪(MicroDrop -100B,广州永诺生物科技有限公司)。
1.3 试验方法
1.3.1 预过滤 取直径为50 mm的孔径为1 μm的玻璃纤维素膜进行杂质预初滤去除较大颗粒物,滤过的水经过50 mm的孔径为0.65 μm的玻璃纤维素膜经过初滤,保存滤过的水和膜。
1.3.2 微过滤 经过预过滤的水经过初过滤后水样放置在“原液瓶”中,通过连接管连接蠕动泵、压力表、0.2 μm孔径过滤柱(CFP-2-E-4MA)。过滤柱出来的样品分别接回流管和透过液管。回流管连接“原液瓶”,透过液管连接“透过液瓶”。
取“透过液瓶”进行下一步处理。每次使用后,用200 ppm游离氯和0.5 mol/L氢氧化钠溶液对过滤系统进行过滤消毒1 h。检查渗透物的酸碱度达到pH 7.0,以确保完全去除次氯酸钠。
1.3.3 水中病毒富集 经过微过滤后“透过液瓶”的水样全部放置在“浓缩液瓶”中,通过连接管连接蠕动泵、压力表、100kDa孔径超滤滤柱(UFP-100-C-4MA)的过滤装置中进行病毒浓缩。调节蠕动泵控制控制浓缩过程的压力为0.2~0.3 bar。当“浓缩液瓶”中样品浓缩为100~150 mL时,可结束浓缩。每次使用后,用200 ppm游离氯和0.5 mol/L氢氧化钠溶液对过滤系统进行过滤消毒1 h[7]。
1.3.4 水浓缩样品总DNA提取 取浓缩液和透过液,分别使用DNeasy Blood and Tissue Kit试剂盒进行DNA核酸抽提,采用世界动物卫生组织(OIE)《水生动物疾病诊断手册》[8]中WSSV荧光PCR方法的引物和探针序列进行病毒检测,F:5′-TGGTCCCGTCCTCATCTCAG-3′;R:5′-GCTGCCTTGCCGGAA-ATTA-3;探针 5′-FAM-AGCCATGAAGAATGCCGTCTATCACACA-TAMRA-3′。
1.3.5 数字PCR检测方法建立 微滴式数字PCR用探针法反应预混液(含dUTP) 5 μL、引物-F(10 μmol/L) 1.8 μL、引物-R(10 μmol/L)1.8 μL、探针(10 μmol/L) 0.5 μL、模板 10 μL,总体积为 20 μL。 (1)将微液滴生成芯片置于芯片卡座中,向油相孔加入40 μL微液滴生成油,向样本孔中加入20 μL 已加入样本的PCR反应水相。待油相和水相加入完成后,盖上微液滴生成芯片密封垫,将微液滴生成芯片置于MicroDrop-100A样本制备仪中进行微液滴生成;(2)待微液滴生成后,依次小心将生成的微液滴(45~55 μL)转移至96孔PCR反应板中;扩增程序:50 ℃ 2 min,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 60 s,45个循环;98 ℃ 10 min。PCR扩增完后,将96孔PCR反应板置于MicroDrop-100B生物芯片阅读仪中进行检测;使用QuantDrop数据分析软件分析数据结果。
1.3.6 不同孔径的膜进行超滤对比 用UFP-100-C-4MA(面积为650 cm2)和UFP-300-C-4MA(面积为650 cm2)分别对1L的样品进行过滤,对比不同孔径的膜的过滤效果。用UFP-100-C-4MA(面积为650 cm2)和 UFP-100-E-4MA(面积为420 cm2)不同面积的膜进行过滤,对比相同孔径时,不同膜面积的过滤效果。
1.3.7 检测对切向流WSSV的浓缩回收率 用已知WSSV阳性的病毒浓缩水样,取100 mL已知浓度的阳性病毒水样,加水稀释到1L,依次稀释共得到4个 梯度,分别把样品浓缩到150 mL。每个样品分取200 μL浓缩后的样品200 μL、浓缩的透过样品200 μL进行DNA抽提得到核酸50 μL,然后进行数字PCR定量检测病毒拷贝数,同时用荧光PCR方法检测。
1.3.8 对切向流浓缩回收WSSV的重复性检测 用已知WSSV阳性的病毒浓缩水样,平行取10个样品,每个样品为1L,分别把样品浓缩到150 mL。分别取浓缩后的样品200 μL、浓缩的透过样品200 μL进行DNA抽提,然后进行数字PCR定量检测病毒拷贝数,同时用荧光PCR方法检测。
2 结果
2.1 不同孔径的膜进行超滤对比 用UFP-100-C-4MA (孔径100 kDa)和UFP-300-C-4MA(孔径300 kDa)分别进行过滤,发现UFP-300-C-4MA浓缩后可以在透过液中检测到阳性,说明该膜会影响病毒回收率。同时,用不同面积的膜进行过滤,发现使用较小面积的滤筒UFP-100-E-4MA(面积为420 cm2),通过粗滤、MF和UF等不同步骤获得病毒浓缩物的时间大约需要6.5 h以上,而使用具有较大表面积的UFP-100-C-4MA(面积为650 cm2)滤筒的时间大大缩短到4 h以下。对比2个不同面积的膜,在相同3 h浓缩过程中,浓缩液流速是透过液流速的3倍时,透过液检出阳性,说明膜面积较小的话,会有机会透过病毒而影响浓缩,见图1。
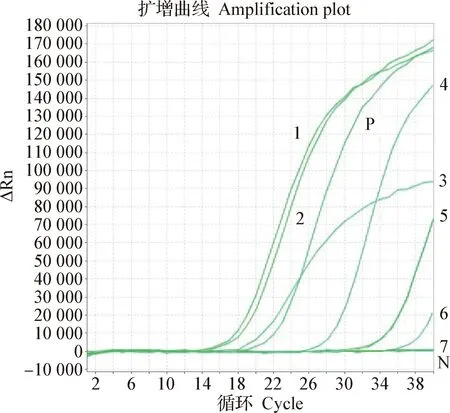
图1 不同孔径和不同面积超滤膜浓缩对比Fig.1 Comparative concentration efficiency of ultrafiltration membranes with different pore sizes and areas1:UFP-100-C-4MA浓缩病毒液; 2:UFP-100-C-4MA浓缩病毒液;3:UFP-100-E-4MA浓缩病毒液; 4:UFP-300-C-4MA浓缩病毒液;5:UFP-300-C-4MA浓缩透过液; 6:UFP-100-E-4MA浓缩透过液;7:UFP-100-C-4MA浓缩透过液; N:阴性对照;P:阳性对照1:UFP-100-C-4MA virus concentrate; 2:UFP-100-C-4MA virus concentrate; 3:UFP-100-E-4MA virus concentrate; 4:UFP-300-C-4MA virus concentrate; 5:UFP-300-C-4MA concentrated permeate; 6:UFP-100-E-4MA concentrated permeate; 7:UFP-100-C-4MA concentrated permeate;N:Negative control;P:Positive control
2.2 数字PCR和荧光PCR检测切向流过滤回收WSSV的回收率 如图2所示,用数字PCR方法定量检测病毒回收效果的结果显示,1和2孔道是UFP-100-C-4MA浓缩透过液样品,检测结果为阴性,而UFP-300-C-4MA浓缩透过液的样品检测结果为弱阳性,这个结果与2.1结果一致。说明用UFP-300-C-4MA的孔径的膜会有病毒透过从而影响回收浓缩。在对样品原液进行10倍稀释后而用UFP-100-C-4MA浓缩的结果显示,病毒原液拷贝数分别7.923×106和8.496×106,在分别进行10、102、103和104倍的梯度稀释并做平行样,病毒浓缩回收率分别为87.8%/89.45%、69.09%/61.95%、78.05%/69.67%和70.00%/65.38%,回收率均在60.00%以上。在稀释样品时,也出现病毒量没有很好平均而影响定量数字PCR病毒量。4次稀释的平均浓缩回收率为73.92%,浓缩效果较好。
从荧光PCR检测结果来分析,样品原液在进行10倍梯度稀释时,病毒浓缩回收结果呈倍比稀释,同时,检测透过液均为阴性。平行样的结果均一致。数字PCR结果与荧光PCR结果一致,倍比稀释的回收率效果较好,见图3。

图3 荧光PCR比对病毒浓缩回收率效果Fig.3 Determination of virus concentration recovery rate by fluorescent PCR1和2:病毒稀释原液样品; 3和4:原液稀释10倍样品;5和6:原液稀释102倍样品; 7和8:原液稀释103倍样品;9和10:原液稀释104倍样品; 11和12:UFP-300-C-4MA浓缩透过液样品; 13和14:UFP-100-C-4MA浓缩的透过液; P:阳性对照;N:阴性对照1 and 2:Original virus sample; 3 and 4:Dilute 10 times sample; 5 and 6:Dilute 102 times sample; 7 and 8:Dilute 103 times sample; 9 and 10:Dilute 104 times sample; 11 and 12:UFP-300-C-4MA concentrated permeate; 13 and 14:UFP-100-C-4MA concentrated permeate; P:Positive control; N:Negative control
2.3 数字PCR检测切向流过滤回收WSSV的重复性 平行做10个稀释样品,分别进行浓缩回收,用数字定量PCR检测后的结果显示,每个样品的病毒浓度差异不显著,病毒浓缩回收重复性较好,见图4。荧光PCR结果显示,10个样品的浓缩重复性较好,而用荧光PCR方法检测透过液均为阴性,见图5。数字PCR结果与荧光PCR结果一致,病毒浓缩的回收重复性较高。

图4 数字PCR比对病毒浓缩重复性效果(核酸为50 μL)Fig.4 Repeatability of virus concentration revealed by digital PCR (Nucleic acid was 50μL)1~10:浓缩病毒液样品,50 μL核酸中病毒拷贝数分别为1.989×106、1.919×106、1.911×106、1.933×106、2.049×106、2.006×106、2.034×106、2.019×106、1.923×106、1.996×1061-10:Concentrated virus sample,the copy number of virus in 50 μL nucleic acid was 1.989×106,1.919×106,1.911×106,1.933×106,2.049×106,2.006×106,2.034×106,2.019×106,1.923×106,1.996×106,respectively
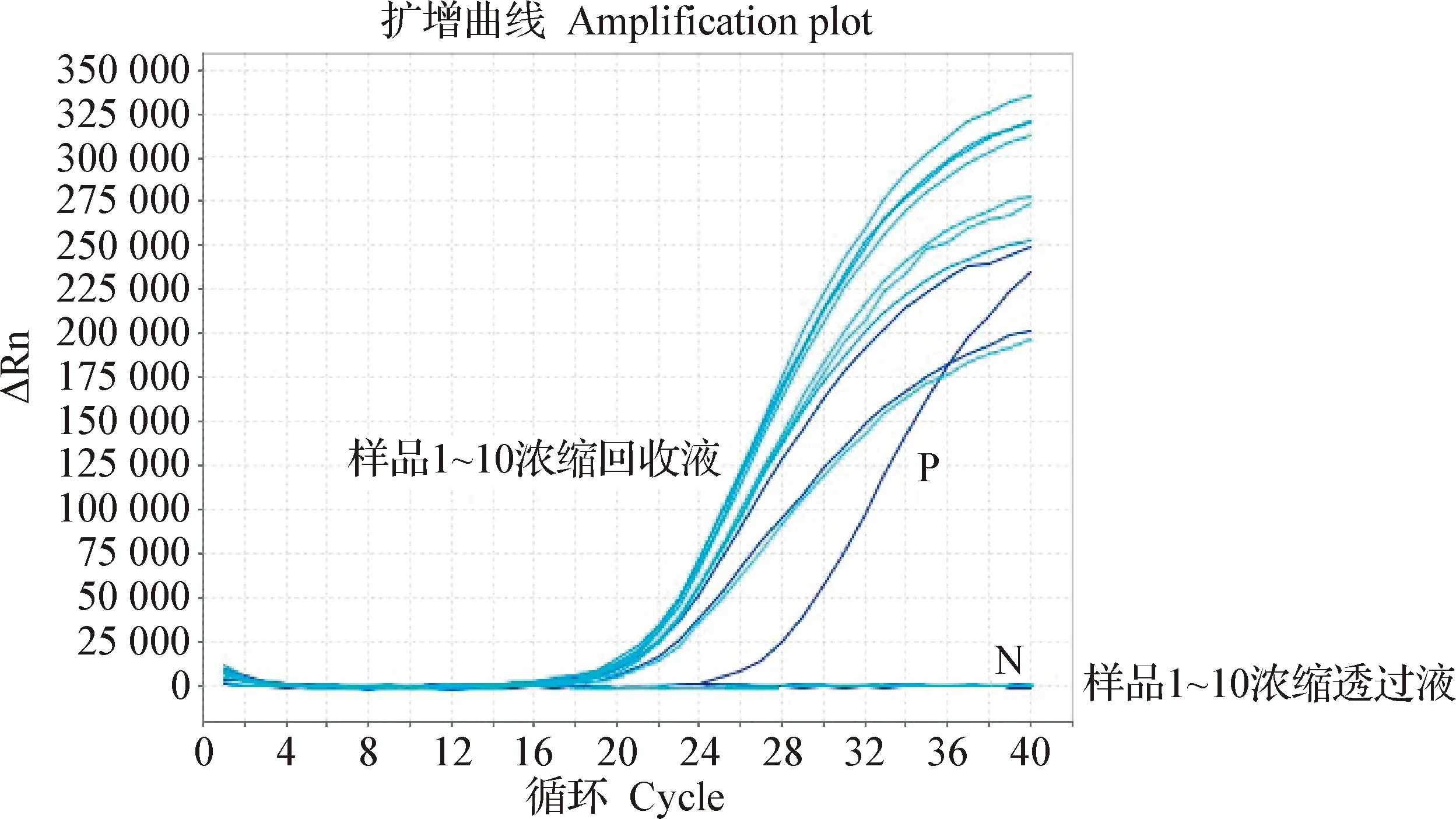
图5 荧光PCR比对病毒浓缩重复性效果Fig.5 Repeatability of virus concentration revealed by fluorescent PCR1~10浓缩回收液:10个平行样品浓缩回收液;1~10浓缩透过液:10个平行样品浓缩透过液;P:阳性对照;N:阴性对照Concentrated virus sample of sample 1-10:Concentrated recovery solution of 10 duplicate samples;Concentrated permeate virus sample of sample 1-10:Concentrated penetrant of 10 duplicate samples; P:Positive control; N:Negative control
3 讨论
目前,对水样处理的方法还有滤膜过滤法、吸附洗脱法、沉淀法、超速离心法、免疫磁珠分离法等[9]。这些方法均有优点,但是也有成本高、设备复杂等局限性,而洗脱法、沉淀法、免疫磁珠法,水样本身的水质状况也会一定程度影响病毒回收效果,对于小病毒更多具有不适合的特点[10]。
切向流超滤中泵推动流体通过滤膜表面,冲刷去除其上截留的分子,从而使滤膜表面的积垢程度降至最低。在渗余物流体中产生紧靠滤膜的压力,使溶质和小分子通过滤膜。在直流过滤中,增加压力,仅能对混合物施加压力,而无助于分离的促进;相比之下,在切向流超滤模式中,通过混合物的再循环防止限制层的形成,此再循环类似于振动以去除阻塞筛网眼的鹅卵石,使得位于混合物顶部的砂粒落下并通过筛网眼。因此,利用切向流超滤进行生物分子分离,效率更高,浓缩或洗滤速度更为快捷。但是,由于超滤法使用的滤膜孔径太小,容易堵塞[11],所以要先进行预过滤来去除较大的杂质。本试验中在进行样品的微滤和超滤之前,使用1 μm孔径和0.65 μm孔径的过滤膜先进性预过滤,这一步骤减少了预封闭超滤膜的需要,并提高了水中病毒的回收率。
病毒浓度与倍数浓度和处理水量成正比[12],检测虾致病性病毒的机会取决于池塘/孵化场水的污染程度。超滤技术对病毒颗粒的回收和截留直接或间接地与许多变量有关,如试验条件、滤筒总面积、泵速、泵压、分子和颗粒大小和形状、浓度等,以及可能在海水电解质中引起静电吸引的粒子极性等[13-14]。王建等[15]建立了切向流超滤富集法对饮用水中诺如病毒的检测,即用超滤膜进行第1次富集,用PEG第2次富集,结果显示,该方法检测的灵敏度为模拟水样10-4copies/μL,平均回收率为10%~20%,抑制指数均少于2。本试验中,比对了孔径300 kDa和100 kDa的超滤膜的浓缩WSSV效果,因为WSSV病毒粒子直径80~120 nm,长250~380 nm,呈卵圆形、椭圆形或杆状,在孔径300 kDa的透过液中检测到病毒,说明使用该孔径太大,影响浓缩效果。
第3代PCR技术—数字PCR(Digital PCR,dPCR)是一种核酸分子绝对定量分析技术[16-17],它是一种将PCR反应物进行有限稀释,随后在大量不同的反应单元中进行独立的PCR扩增,最后根据泊松分布原理及阳性微滴的个数与比例经过统计学分析直接数出DNA分子的个数的技术,而样本中DNA的提取质量会影响检测结果,本试验中出现的样本检测结果有差异性,分析原因可能与稀释样品效果不好有关,也可能与DNA提取质量有关。但是,从结果分析来看数字PCR结果与荧光PCR结果一致,倍比稀释的回收率效果较好。用数字PCR定量检测样品中病毒量,4次稀释的平均浓缩率为73.92%,浓缩效果较好。平行做10个重复性样品分别进行浓缩,数字定量PCR和荧光PCR方法检测后结果显示每个样品的病毒浓度差异不显著,重复性较好。
与传统的PCR方法相比,数字PCR方法更加灵敏,不需要依赖Ct值和标准曲线而实现绝对核酸定量。近几年,数字化PCR方法在动物疫病研究中也被广泛应用[18-20],但是,数字PCR检测成本较高,需要使用特定的数字PCR混合液、微滴生成油、微滴生成仪等试剂和检测仪器,成本远高于荧光PCR 检测方法。Jia等[21]比较了反转录数字PCR(RT-ddPCR)与逆转录定量PCR(RT-qPCR)2种方法对13个不同区域的传染性造血器官坏死病毒毒株的测定。结果表明,反转录数字PCR虽然检测灵敏度与检测范围弱于反转录定量PCR,其相关性可达到69.40%以上。郝中香等[22]建立了针对鲤疱疹病毒2型的数字PCR检测体系,结果显示,数字PCR检测灵敏度较荧光定量PCR高5倍,且重复性较好。赵欣等[23]也对鲤疱疹病毒Ⅱ型进行进一步研究,结果显示,数字PCR及荧光定量PCR两种方法线性关系和特异性均良好,但是数字PCR具有更好的重复性,并且临床样品检测中,数字PCR较荧光定量PCR的阳性检出率高,表明数字PCR技术在水生动物病毒检测中具有一定前景。
对于整个虾塘来说,对于虾体进行病毒检测,样品的代表性具有非常大的挑战性。对于同一虾池,发病情况也有不同,这主要是因为同一池虾并不是来源于同一条亲虾,或虾的个体免疫力差异的原因。而在实际检测中无法做到每一条虾都得到检测,只能抽取一定数量的样品,所以检测结果就有可能存在偏差[24]。这种情况下,对虾塘的水环境进行病原检测可以快速了解虾的生长水环境中是否存在病原,可以在出现病毒量高引起虾体死亡之前做出正确的生物安全措施,如隔离、消毒等,以减少损失。此外,这个方法还可以扩展到了解虾场、孵化场和水库所采用的消毒方案的效力检测。
