猪源摩氏摩根菌的分离与鉴定
2022-01-18朱来萍杨仕标詹建举李鸷隆刘丁予王生奎
朱来萍 , 张 昇 , 杨仕标 , 詹建举 , 李鸷隆 , 刘丁予 , 王生奎 , 姚 俊
(1. 云南农业大学动物医学院 , 云南 昆明 650201 ; 2. 云南省畜牧兽医科学院 云南省热带亚热带动物病毒病重点实验室 , 云南 昆明 650224 ; 3.云南鸷坤生态农业有限公司 , 云南 昆明 650502 ; 4.昆明市阳宗海风景名胜区管理委员会农业农村局 , 云南 昆明 650502)
2018年9-10月,云南省昆明市郊某规模化猪场饲养的保育猪群散发腹泻,虽然发病率及病死率不高,但腹泻持续发生。通过投喂治疗腹泻的混试剂药物及饮水用药进行治疗,但疗效欠佳。从药物治疗效果不佳的结果初步判断为病毒性腹泻,本试验遂采集了6份临床腹泻粪便样品,开展了引起猪腹泻的常见病毒——猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪传染性胃肠炎病毒(Transmissible gastroenteritis of swine virus,TGEV)、猪Delta冠状病毒(Porcine delta coronavirus,PDCoV)、轮状病毒A群(Rotavirus A,RVA)的核酸RT-PCR检测,但检测结果均为阴性,排除了上述腹泻病毒感染的可能。为了尽早查明腹泻病因,采取对应的有效治疗及防控措施,本试验开展了腹泻仔猪病料的病原菌分离、培养和鉴定工作。
1 材料与方法
1.1 材料 云南省昆明市郊某规模化猪场采集的腹泻仔猪肛门棉拭子样品6份。
1.2 主要试剂 营养琼脂培养基、革兰染液,均购自杭州滨和微生物试剂有限公司;Gibco新生犊牛血清、厌氧环境发生剂、病毒基因组RNA提取试剂盒(MagMAX-96 Viral RNA Isolation Kit),均购自美国ThermoFisher Scientific公司;细菌基因组DNA提取试剂盒及DNA Marker 2 000,均购自天根生物技术(北京)有限公司;一步法RT-PCR试剂盒(One Step RT-PCR Kit),购自宝生物工程(大连)技术有限公司。生化鉴定及药敏测定读板仪(ATB Reader)、细菌浊度测定仪(DENSIMAT)、肠杆菌科鉴定试条(ID 32E)、兽用细菌药敏鉴定试条(ATBTMVET)、API NaCl 0.85%培养基及ATB培养基,均购自法国梅里埃公司。
1.3 实验动物 14只昆明小鼠,购自昆明医科大学实验动物中心。
1.4 引物 细菌16S rRNA通用扩增引物序列参考文献[1]中的引物序列,委托昆明硕擎生物科技有限公司合成。引物、探针信息见表1。

表1 引物和探针信息Table 1 Primers and probes informations
1.5 猪主要腹泻病毒核酸的RT-PCR检测 将采集的6份腹泻仔猪肛门棉拭子样品分别匀浆、震荡静置后,取上清抽提病毒RNA进行PEDV、TGEV、PDCoV、RVA的病毒核酸RT-PCR检测。
1.6 细菌分离培养、纯化,形态学观察及氧化酶试验 用无菌接种环取适量腹泻仔猪肛门棉拭子样品,划线接种于血清琼脂平板,置于37 ℃厌氧培养和5%、CO2培养箱培养24~72 h后,取出观察菌落生长情况,并挑取单菌落进一步划线纯化培养,然后对纯化后的菌株进行革兰染色并置于1 000倍光学显微镜(油镜)下观察菌体形态,同时对菌株进行氧化酶试验。
1.7 分离菌株的16S rRNA序列扩增、测序及序列分析 取适量纯培养的分离菌株抽提细菌基因组DNA,操作方法按照细菌基因组DNA抽提说明书进行。以抽提纯化的DNA样品为模板进行PCR扩增,PCR的反应体系为25 μL:2×TaqPCR Master Mix 12.5 μL,上、下游引物(10 μmol/mL)各 1 μL,模板 DNA 4 μL,无核酸酶的离子水补至25 μL。PCR反应条件:95 ℃预变性3 min;94 ℃变性 30 s, 57 ℃退火30 s,72 ℃延伸90 s,共35个循环;72 ℃ 延伸5 min。扩增产物经 1.25%琼脂糖凝胶电泳检测。将PCR产物送至昆明硕擎生物科技有限公司测序,所得序列经DNASTAR软件进行拼接、校对后,在NCBI GenBank中进行BLAST比对分析。
1.8 细菌生化及药敏鉴定 选用法国梅里埃ID 32E生化鉴定试条对分离菌株进行细菌生化鉴定,具体操作按照说明书进行,接种后鉴定试条置于37 ℃、 5%CO2培养箱培养24 h±30 min,读板前滴加1滴JAMES生化试剂于IND孔(吲哚试验)后读取结果。选用法国梅里埃细菌药敏鉴定试纸条(ATB VET)对分离菌株进行细菌药敏鉴定,具体操作按照说明书进行,接种后于37 ℃、5%CO2培养箱培养24 h±30 min后读取结果。
1.9 实验动物致病性试验 用接种环取适量纯化的摩氏摩根菌菌落,悬浮于无菌生理盐水后测定细菌浓度,并稀释为2.1×109CFU/mL的细菌浓度,腹腔接种成年昆明小鼠0.3 mL/只,总计接种10只作为试验组,同时给4只成年昆明小鼠接种同等剂量的无菌生理盐水作为对照组。接种后每日观察并记录小鼠的发病及死亡情况,及时剖检发病死亡小鼠并观察内脏器官的病理变化,无菌采集其内脏组织进行致病菌株的回收试验。
2 结果
2.1 猪主要腹泻病毒核酸的RT-PCR检测 送检的6份腹泻仔猪肛门棉拭子样品的猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪Delta冠状病毒、轮状病毒A群RT-PCR检测结果均为阴性。
2.2 细菌的分离培养 在37 ℃、5%CO2培养箱中培养的血清琼脂平板上生长出无色至淡黄色、圆形、凸起、光滑、边缘整齐的菌落(图1),37 ℃厌氧培养条件下血清琼脂平板上均无任何菌落生长。

图1 分离菌株在血清琼脂平板上菌落形态Fig.1 Bacterial colonies on serum agar plate
2.3 分离菌株的镜检 分离菌株经革兰染色镜检,菌体大小为(0.6~0.7)μm×(1.0~1.7)μm,散在排列,呈球状、杆状,有鞭毛,无荚膜,无芽孢的革兰阴性短杆菌(图2)。
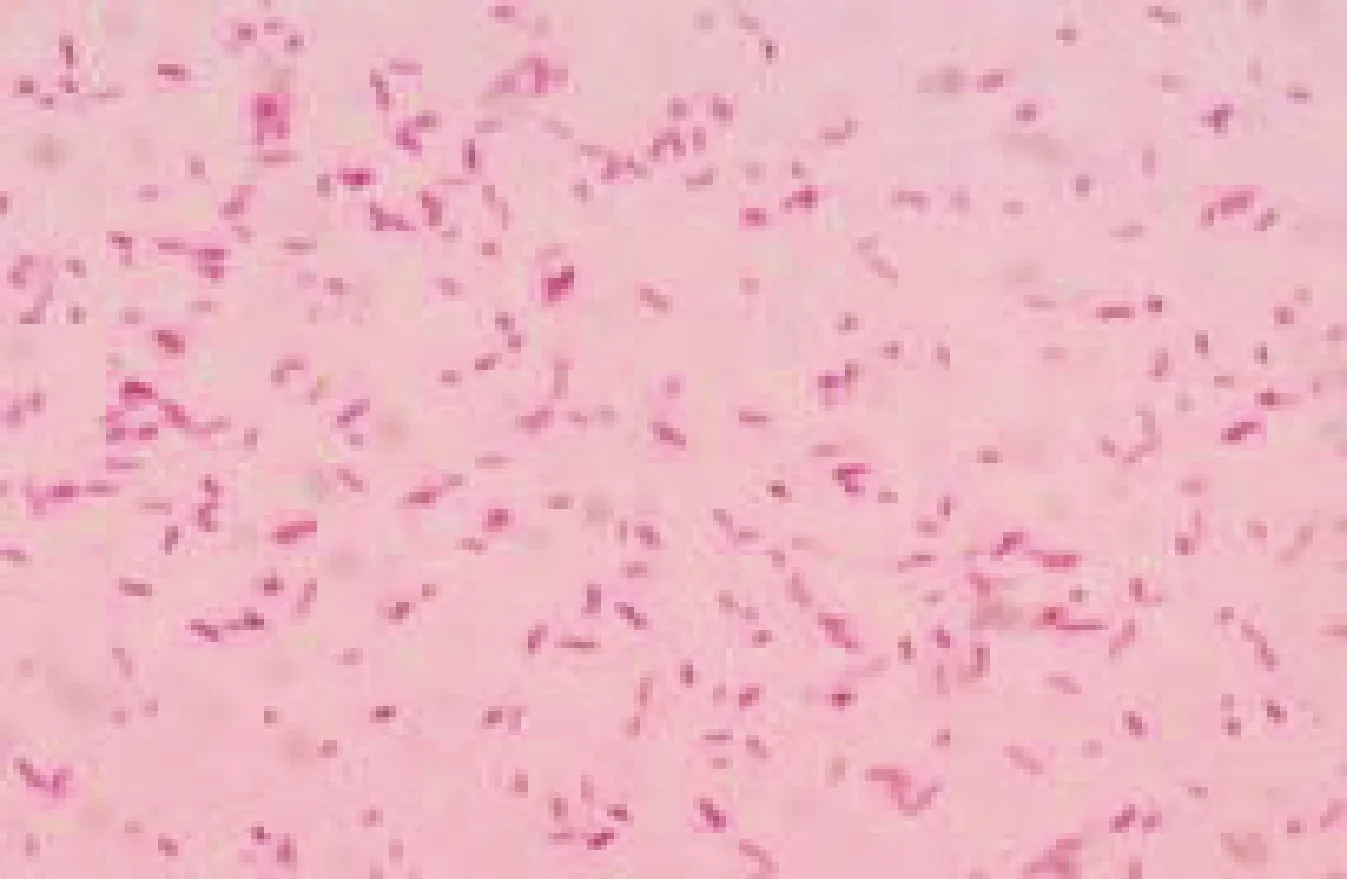
图2 革兰染色镜检结果(1 000×)Fig.2 Gram staining results (1 000×)
2.4 分离菌株的氧化酶试验 腹泻仔猪粪便分离出致病菌株的氧化酶试验结果为阴性。
2.5 细菌16S rRNA基因的PCR扩增及序列分析 用细菌 16S rRNA 通用引物 PCR扩增获得该分离菌株的目的基因片段 (图3)。由图3可知,目的基因片段大小约为1 415 bp,此片段PCR产物测序,得到1 387 bp的序列,将测定序列进行BLAST比对,结果显示该菌与摩氏摩根菌的符合率为99%,判定该分离菌株为摩氏摩根菌。将分离菌株16S rRNA序列的测序结果与NCBI GenBank中不同来源的摩氏摩根菌的序列进行比较分析,结果显示,分离菌株与SDTA-2 株(MH299416.1)和FDAARGOS-172株(CP014026.2)同源性达99.78%。
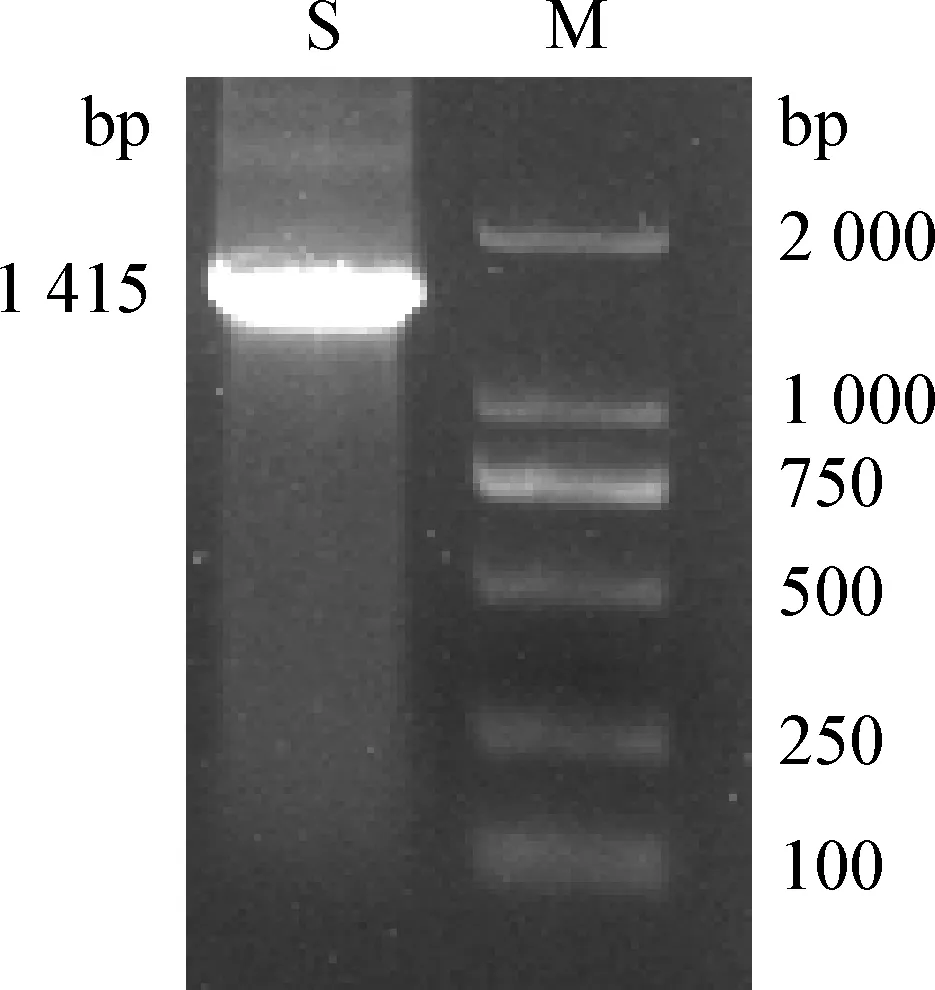
图3 分离菌株的16S rRNA PCR扩增结果Fig.3 PCR amplification results of 16S rRNA gene from the isolateM:DL2 000 DNA Marker; S:分离菌株M:DL2 000 DNA Marker; S:The isolated bacterial strain
2.6 细菌的生化鉴定 生化鉴定结果表明该分离菌株为摩氏摩根菌的可能性是99.9%(ID%),鉴定结果见表2。

表2 分离菌生化鉴定结果Table 2 Biochemical identification results of the isolate


表3 分离菌药敏试验结果Table 3 Drug sensitivity test results of the isolate
2.8 实验动物致病性试验 腹腔接种致病菌的10只 试验组小鼠于6 h后可观察到精神沉郁,饮食欲减退,分别于48 h内死亡6只,腹腔接种同等剂量的4只对照组小鼠饮食、精神状况均正常。剖检可见发病死亡小鼠的肺脏充血、出血,肝脏、肾脏及脾脏肿大,胃肠道浆膜面充血,并成功从肝脏及心血样品分离培养回收到同一菌株。
3 讨论
近年来,由于猪流行性腹泻等病毒性腹泻在云南乃至全国均有发生和流行,鉴于2018年9-10月云南省昆明市郊某规模化猪场发生的仔猪腹泻案例,虽然临床上主要是保育猪群中存在持续性、散发性腹泻,粪便形态也并非水样,但为了排除猪流行性腹泻等病毒性腹泻的可能,本试验首先对采集的腹泻仔猪肛门棉拭子样品进行了PEDV、TGEV、PDCoV、RVA核酸的RT-PCR检测。在排除了病毒性腹泻的前提下,为了进一步查明病因,遂开展了病原菌的分离、培养及鉴定。
摩氏摩根菌(M.morganni)隶属于摩根菌属(Morganella),肠杆菌科。该属有2个种和2个亚种,即摩氏摩根菌(M.morganni)、耐冷摩根菌(M.psychrotolerans)、摩氏摩根菌摩根亚种(M.morgannisubsp.morganni)和摩氏摩根菌西伯尼亚种(M.morgannisubsp.sibonni)[1]。摩氏摩根菌(M.morganni)是一种革兰阴性兼性厌氧肠道杆菌,大小约为(0.6~0.7)μm×(1.0~1.7)μm,散在排列,无明显荚膜,无芽孢[2]。该菌于1906年首次被摩根等从小儿粪便中分离出[3],基因组大小约为4 000k, 其蛋白编码序列(CDSs)约为4 000个[4]。摩氏摩根菌在自然界中分布广泛,通常存在于人类、哺乳动物和爬行动物的肠道中,是正常菌群的一部分[5]。摩氏摩根菌对人类而言,这种机会性病原体不容疏忽,能导致人体败血症、脓肿、蜂窝组织炎等[6],该菌通常是从人粪便中分离出,常与尿路感染有关[7]。
近年来,摩氏摩根菌耐药性呈上升趋势,这种耐药性主要是遗传和流动性因素导致[8-9],该菌本质上对大多数对其有活性的抗生素是敏感的,如氨基糖苷类、氯霉素、环丙沙星等,但对磷霉素、大肠菌素和某些抗生素耐药[10-11]。这种多药耐药(MDR),甚至广泛耐药(XDR)容易导致摩氏摩根菌引起的感染在临床上治疗失败[12-14]。本试验对摩氏摩根菌分离菌株的药敏试验结果也显示其耐药菌谱较广,对法国梅里埃细菌药敏鉴定试条(ATB VET试条)上的所有28种药物均耐药,这在开展本试验的兽医实验室药敏检测中还是第1次遇到,提示该条件致病菌在兽医临床上的潜在危害同样值得引起重视,同样提示当前养殖环境中的细菌耐药现象依然严重,养殖环节的兽药滥用现象依然突出。在国内,由摩氏摩根菌引起大鲵、中华鳖、禽蛋、胡子鲶、黑山羊被感染的案例有见报导[15-20],但关于哺乳动物源的摩氏摩根菌致病案例报导较少,特别是猪源摩氏摩根菌的分离鉴定到目前为止尚未见报导。
