晚期胃 食管胃结合部腺癌免疫治疗临床分析*
2022-01-18张鑫鑫李帅吴晨侯新芳
张鑫鑫 李帅 吴晨 侯新芳
胃/食管胃结合部(gastric/gastroesophageal junction,G/GEJ)癌发病率为全球第五位,癌症死亡排列第三位[1]。中国胃癌发病率第三位,死亡率第二位,约80%患者确诊时已进入中晚期,仅能通过系统治疗来延长生存期[2]。晚期胃癌一线标准化疗生存期难以突破1年,二线姑息性化疗为主,三线及以上抗血管治疗及免疫治疗疗效不明显。晚期G/GEJ 癌治疗手段有限,预后差,迫切需要新的治疗方案。
免疫检查点的异常在晚期胃癌的发生、浸润和转移中发挥重要作用,程序性死亡受体(programmed cell death protein 1,PD-1)和程序性死亡配体(programmed cell death-ligand 1,PD-L1)分别在T 细胞和肿瘤细胞上的过度表达,表明PD-1/PD-L1 通路在胃癌肿瘤细胞免疫逃逸中起关键作用[3-4]。多项研究表明PD-1 单抗在晚期胃癌领域中表现出良好抗肿瘤活性,因此纳武利尤单抗及帕博利珠单抗(CPS≥1%)获批晚期胃癌三线及以上治疗。根据最新Checkmate-649[5]及Keynote-062[6]研究结果纳武利尤单抗及帕博利珠单抗已被推荐晚期胃癌一线治疗,晚期胃/食管胃结合部腺癌治疗模式正在逐渐更新。
各型临床试验有严格入排标准,但真实世界中患者体质及治疗模式多样性及个体化。因此,本研究回顾性分析晚期胃/食管胃结合部腺癌患者PD-1 单抗免疫治疗临床数据资料,分析其在临床中真实疗效,为后续免疫治疗探索提供参考。
1 材料与方法
1.1 病例资料
回顾性分析2018年9月至2020年9月就诊于河南省肿瘤医院接受PD-1 单抗治疗的晚期胃/食管胃结合部腺癌患者资料。纳入标准:1)经组织病理学确诊为G/GEJ 腺癌;复发或转移晚期G/GEJ 腺癌;2)年龄>18 岁,男女不限;3)美国东部肿瘤协作组(ECOG)评分0~2 分;4)至少接受过2 个周期免疫治疗,且疗效可评价;5)所有治疗方案均获得患者知情同意并签字。排除标准:1)鳞癌或未分化型;2)不可控高血压;3)6个月内出现过严重心脏不良病史;4)具有严重全身系统性疾病或自身免疫性疾病;5)合并其他原发肿瘤。
收集患者临床资料,包括性别、年龄、ECOG 评分、转移数目及部位、免疫治疗线数及方案、PD-1 单抗药物、PD-L1 表达、MMR 表达、EBER 表达。
1.2 方法
1.2.1 疗效评价及不良反应 根据实体瘤疗效评价标准(RECIST)1.1 版,评价指标包括完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。计算客观缓解率(overall response rate,ORR)=(CR+PR)/总例数×100%、疾病控制率 (disease control rate,DCR)=(CR+PR+SD)/总例数×100% 。无进展生存期(progression-free survival,PFS)定义为首次使用PD-1 单抗治疗直到确认PD、死亡或末次随访的时间。总生存时间(survival,OS)定义为首次使用PD-1 单抗治疗直到死亡或末次随访的时间。根据不良事件(adverse events,AEs)通用术语标准(CTCAE)5.0 版本进行分级。
1.2.2 随访 根据患者在本院住院系统及门诊系统查阅随访,在当地医院通过电话随访。随访患者一般情况、是否复查、肿瘤控制情况及是否生存。随访截至2021年6月,失访5 例,失访率4.1%。
1.3 统计学分析
采用SPSS 26.0 软件进行统计学分析。对基本特征数据采用描述性统计。采用χ²检验或Fish 确切概率法分析疗效。采用Kaplan-Meier 法进行生存分析,Log-rank 检验生存曲线比较。采用Cox 比例风险模型进行多因素分析。GraphPad 8.0.2 软件绘制生存曲线。以P<0.05 为差异具有统计学意义。
2 结果
2.1 临床资料
中位随访时间12.6 个月,1年生存率21.0%。118 例患者中位年龄64 岁;一线27 例,二线44 例,三线及以上47 例。PD-1 单抗单药9 例,联合化疗49 例,联合抗血管43 例,联合化疗及抗血管17 例。其中信迪利单抗组39 例(单药2 例,联合化疗18 例,联合抗血管14 例,联合化疗及抗血管5 例);卡瑞利珠单抗组48 例(单药2 例,联合化疗20 例,联合抗血管18 例,联合化疗及抗血管8 例);特瑞普利单抗组15 例;替雷利珠单抗组4 例;帕博利珠单抗组9 例;纳武利尤单抗组3 例。检测PD-L1 表达阳性35 例,阴性15 例。MSI-H 者4 例,EBER 阳性者3 例。临床基本特征,见表1。
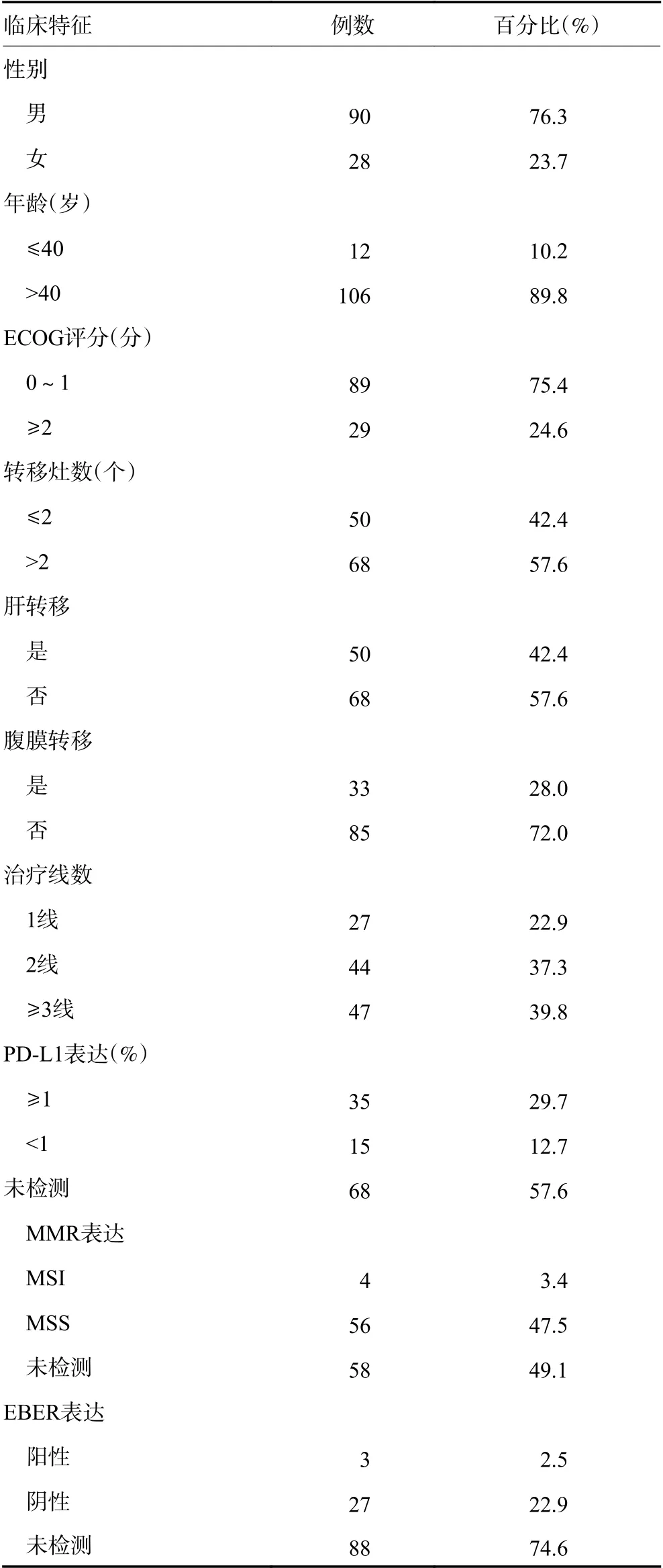
表1 晚期G/GEJ 腺癌临床基本特征 (n=118)
2.2 疗效评估
118 例患者ORR 为22.0%,DCR 为51.7%。免疫治疗一线vs.二线vs.三线及以上ORR 为(37.0%vs.20.5%vs.14.9%),DCR 为(81.5%vs.54.5%vs.29.8%),差异具有统计学意义(P<0.05)。PD-1 单抗联合化疗vs.抗血管vs.化疗及抗血管ORR 为(22.4%vs.18.6%vs.23.5%),DCR 为(55.1%vs.46.5%vs.52.9%)。信迪利单抗组对比卡瑞利珠单抗组中ORR为(17.9%vs.29.2%),DCR 为(43.6%vs.64.6%);其中两者联合化疗DCR 分别为(50.0%vs.60.0%),联合抗血管DCR 分别为(42.9%vs.55.6%)。PD-L1 表达阳性组vs.阴性组ORR 为(37.1%vs.13.3%),DCR 为(65.7%vs.46.7%),差异均无统计学意义(均P>0.05)。
2.3 生存分析
118 例患者中位PFS 为5.0 个月,中位OS 为8.9 个月。PD-1 单抗治疗一线vs.二线vs.三线及以上中位PFS 为(9.9 个月vs.4.8 个月vs.3.2 个月),中位OS 为(19.0 个月vs.7.8 个月vs.7.3 个月);且免疫联合化疗一线(22 例)vs.二线(20 例)中位PFS 为(9.0个月vs.4.7 个月),中位OS 为(NRvs.7.8 个月),差异均具有统计学意义(P<0.05),显示出早期一线免疫治疗较后线生存获益更持久。PD-1 单抗联合化疗vs.抗血管vs.化疗及抗血管治疗中位PFS 为(5.8 个月vs.4.4 个月vs.5.0 个月)及中位OS 为(11.4 个月vs.8.2 个月vs.8.2 个月),联合化疗者中位生存期可延长3 个月。信迪利单抗组vs.卡瑞利珠单抗组中位PFS为(4.4 个月vs.6.0 个月,P<0.05)及中位OS 为(9.4 个月vs.8.9 个月,P>0.05),其中两者联合化疗中位OS分别为(11.4 个月vs.10.5 个月),联合抗血管中位OS分别为(8.2 个月vs.8.3 个月)。PD-L1 表达阳性组vs.阴性组中位PFS 为(5.8 个月vs.4.7 个月)及中位OS 为(11.3 个月vs.9.3 个月),表达阳性者中位生存期可延长2 个月。见图1~4。
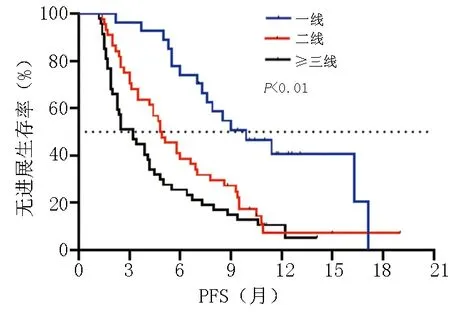
图1 免疫治疗线数与PFS 关系

图2 免疫治疗线数与OS 关系

图3 免疫联合治疗与PFS 关系
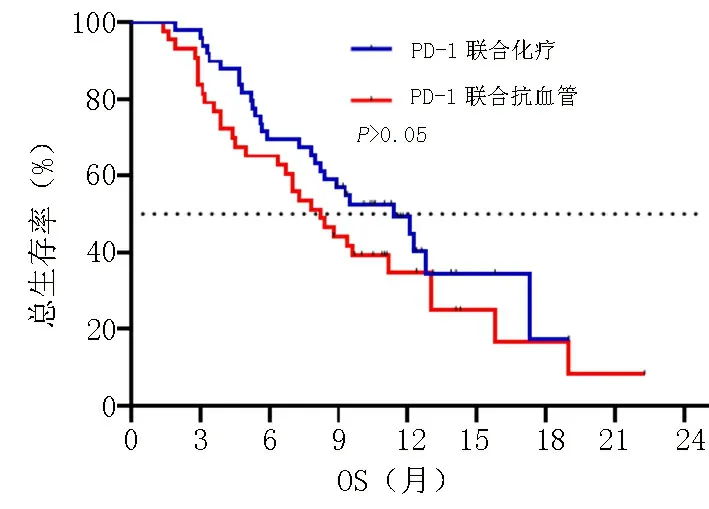
图4 免疫联合治疗与OS 关系
2.4 预后
单因素分析显示年龄、ECOG 评分、转移灶数目、腹膜转移、免疫治疗线数是患者OS 的影响因素(P<0.05)。进一步Cox 多因素分析仍显示年龄(P=0.042)、ECOG 评分(P=0.001)、转移灶数目(P=0.011)、腹膜转移(P=0.023)及免疫治疗线数(P=0.014)为OS 独立影响因素,且年龄为保护性因素(HR=0.498,95%CI:0.255~0.974)。截至随访日,19 例患者未进展继续PD-1 单抗联合治疗。见表2。
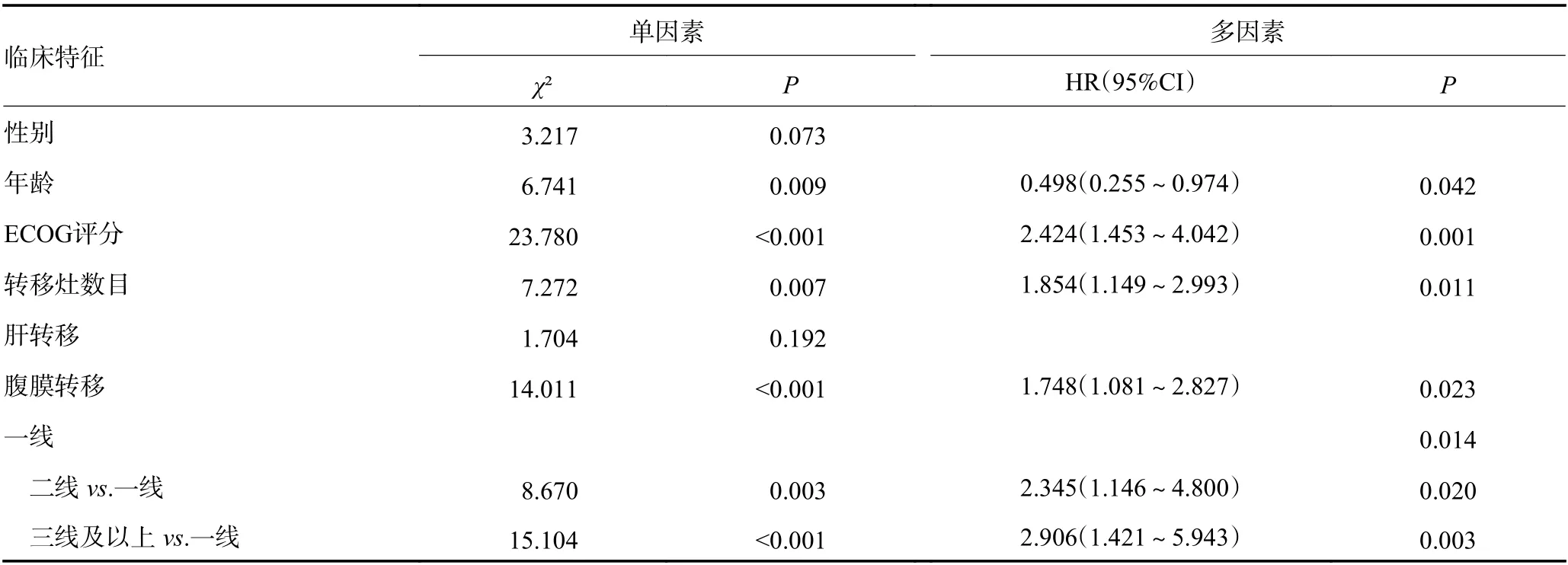
表2 晚期G/GEJ 腺癌中位OS 单因素及多因素分析 (n=118)
2.5 不良反应
所有不良事件中1~2 级发生率较高(83.9%),3~4 级发生率较低(30.5%),其中消化道反应(64 例)、骨髓抑制(89 例)及肝功能异常(30 例)发生率较高,主要原因可能与患者多次进行化疗病史及部分发生肝转移相关,见表3。免疫相关不良事件中甲状腺功能减退者19 例(16.1%)、肺炎者5 例(4.2%)。在信迪利单抗治疗组及卡瑞利珠单抗治疗组不良事件发生中,中性粒细胞减少(P=0.013)、血红蛋白减少(P=0.010)及肺炎(P=0.031),差异具有统计学意义。余未发生其他明显免疫治疗相关事件,所有不良事件均通过临床医师对症治疗得到好转及控制,安全性可控。
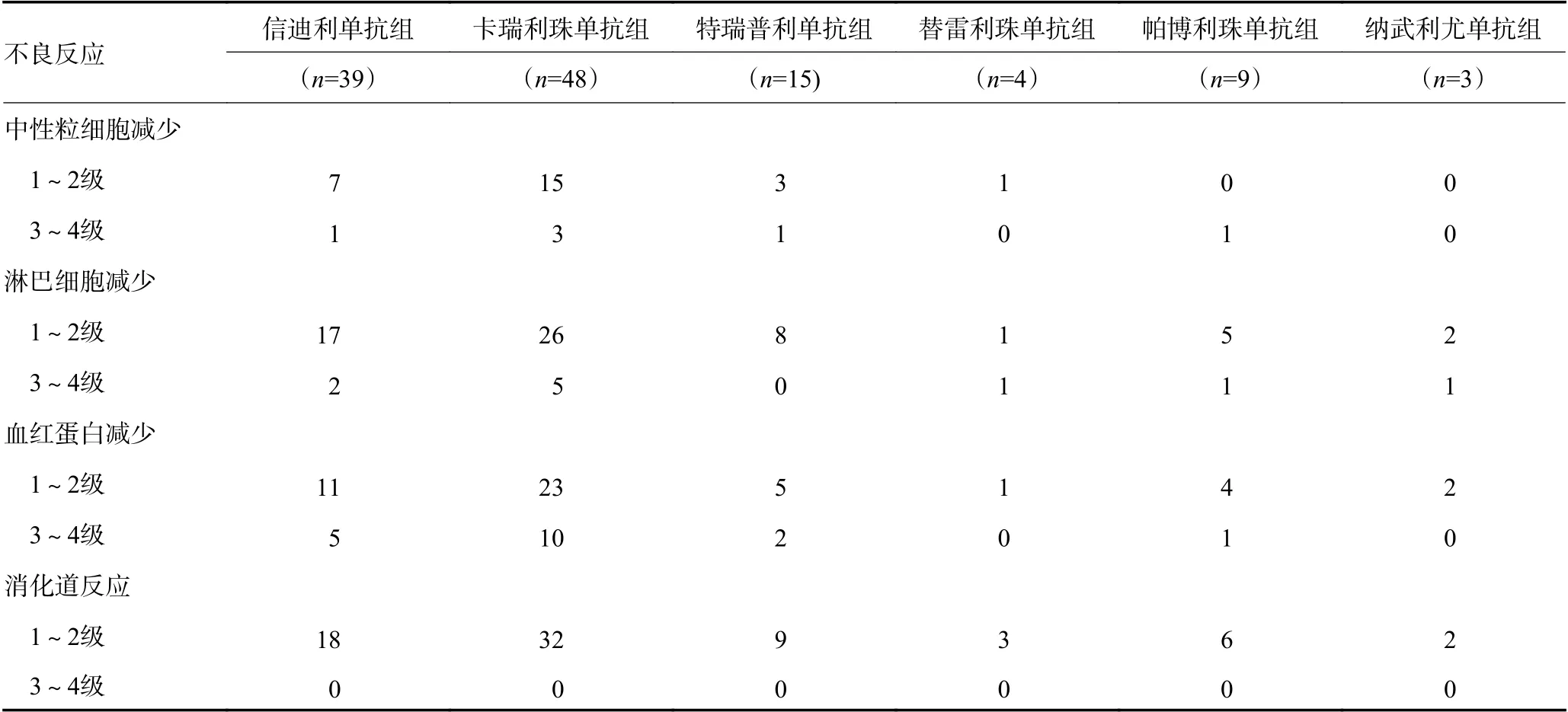
表3 治疗相关不良反应情况 (例)
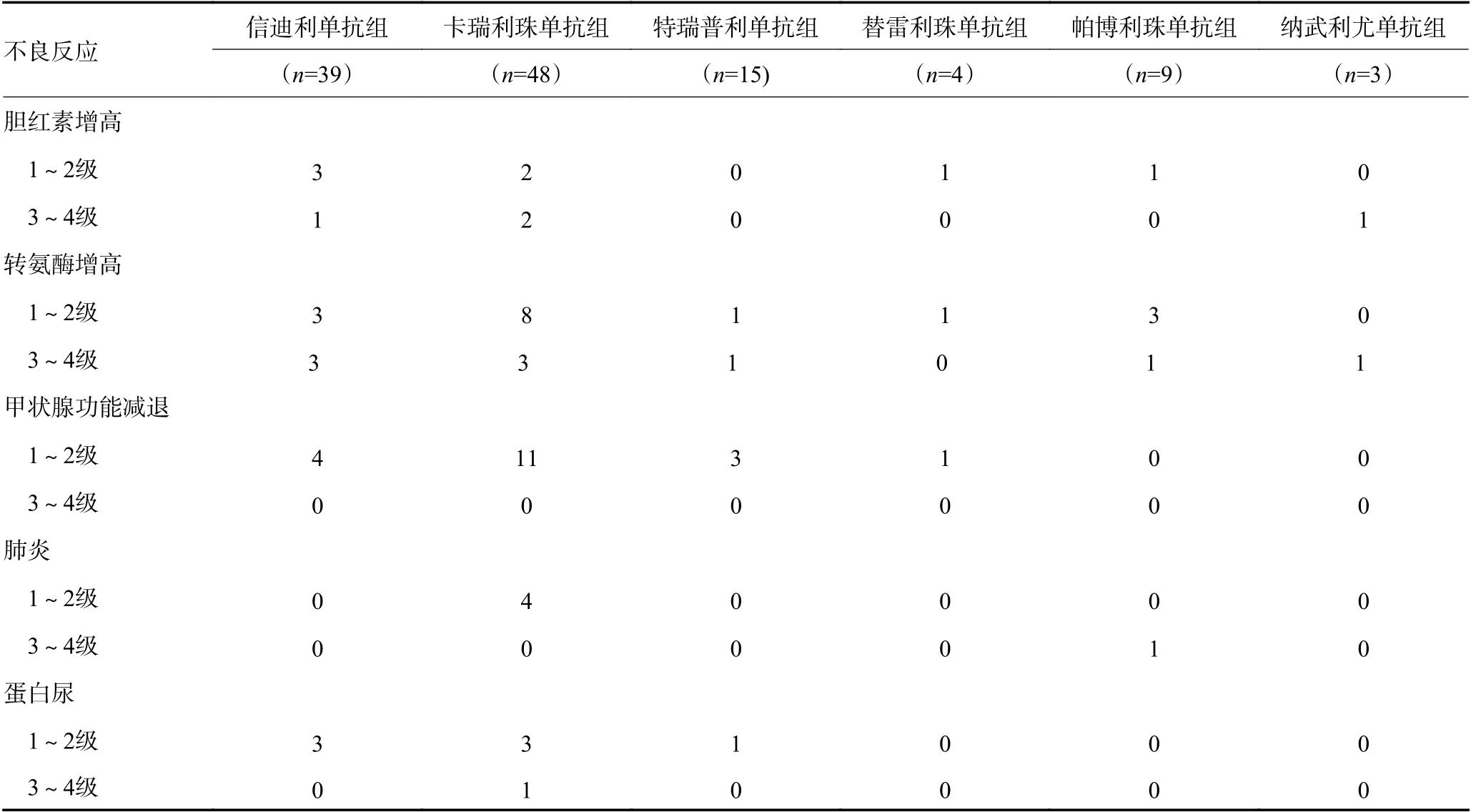
表3 治疗相关不良反应情况 (例) (续表3)
3 讨论
G/GEJ 是一种预后差、异质性强的恶性肿瘤,既往一线标准治疗铂类联合氟尿嘧啶类中位OS 为11个月[7],HER2 表达阳性者联合曲妥珠单抗,中位OS延长至13 个月[8];二线伊立替康、雷莫芦单抗单药或联合紫杉醇,中位OS 为5~9 个月[9];三线甲磺酸阿帕替尼及纳武利尤单抗(CPS ≥1%)治疗中位OS 为4~9 个月。基于Checkmate-649[5]及Keynote-062[6]中国亚组分析,最新中国临床肿瘤学会(CSCO)指南在晚期胃癌一线治疗中增加PD-L1(CPS≥5%)Ⅰ级推荐纳武利尤单抗联合化疗及PD-L1(CPS≥1%)Ⅲ级推荐帕博利珠单药治疗。现免疫治疗在晚期胃癌治疗中逐渐崭露头角,治疗模式正在逐步更新。
本研究中一线PD-1 单抗均为联合治疗,中位PFS 为9.9 个月,中位OS 为19.0 个月,比Checkmate-649[5]随机人群中位OS 为13.8 个月生存期更长些,可能与本研究中样本量较少相关,但总体疗效趋势一致。虽然二线Keynote-061[10]中及本研究PD-1 单抗联合治疗中位PFS 为4.8 个月,中位OS 为7.8 个月,结果显示免疫治疗结果未如人意,但在SHR-1 210 联合阿帕替尼[11]晚期胃癌分组中观察到PD-1 单抗联合治疗中位OS 为11.4 个月;另一项HX008 联合伊立替康[12]研究中位OS 虽尚未达到,但两项研究均提示二线治疗中加入PD-1 单抗治疗疗效仍然可观。根据Attraction-2[13]中位OS 为5.3 个月及Keynote-059 队列1[14]中位OS 为5.6 个月,本研究中三线及以上PD-1 单抗联合治疗中位PFS 为3.2 个月,中位OS 为7.3 个月,与临床试验相比说明PD-1 单抗联合治疗较单药治疗在后线治疗中更具有一定优势。上述所有研究结果提示PD-1 单抗在晚期胃癌各线治疗中均具有客观反应,且早期PD-1 单抗联合治疗使患者获益更明显。
研究表明免疫联合化疗或抗血管治疗具有潜在协同效应,均可增强机体免疫调节系统的抗肿瘤效应[15-16]。在Keynote-059[17](中位PFS=6.6 个月,中位OS=13.8 个月)、Attraction-4[18](SOX 组中位PFS 为9.7个月;XELOX 组中位PFS 为10.6个月)、Keynote-062[6](中位PFS 为6.9 个月,中位OS 为12.5 个月)及Checkmate-649[5](中位OS=13.8 个月)研究中可以观察到PD-1 单抗联合化疗在晚期胃癌治疗中优势;另外SHR-1 210 联合阿帕替尼[11](中位OS为11.4 个月)、EPOC1603[19](ORR=44%,中位PFS为5.6个月)及EPOC1706[20](ORR=69%,中位PFS=6.9 个月) 均提示PD-1 单抗联合抗血管治疗在晚期胃癌组具有一定疗效。本研究中PD-1 单抗联合化疗组和抗血管组中位PFS 分别为5.8 个月和4.4 个月,中位OS 分别为11.4 个月和8.2 个月,联合抗血管生存期较短可能与其多为三线及以上治疗相关,而联合化疗者多为一线治疗相关。本研究免疫联合治疗效果与各临床试验相比较差可能主要与免疫联合治疗线数及联合方案密切相关,真实反映出临床诊疗中免疫治疗真实情况。现各大型免疫联合化疗及抗血管治疗的临床试验结果尚未发布,具体在几线中联合哪种治疗方案更能使患者临床获益明显需进一步等待及探索。
在Attraction-2[13]及Keynote-062[6]中PD-L1 表达阳性或高表达者之间对比中位OS 并未延长,但在Keynote-059 队列1[14]及队列2[17]中随着PD-L1 表达增高中位OS 逐渐延长。本研究中检测到PD-L1 表达(阴性vs.≥1%vs.≥5%)中位PFS 为(4.8 个月vs.5.8个月vs.6.7 个月),中位OS 为(9.3 个月vs.11.3 个月vs.12.3 个月),此结果与Keynote-062[6]及Checkmate-032[21]结果趋势相同,生存期获益差异性并不显著。不同数据结果可能与PD-L1 表达检测标准及PD-1单抗药物选择性不同相关,但无论PD-L1 表达如何,均可观察到患者从PD-1 单抗治疗中生存获益。关于PD-L1 表达与患者预后的相关研究结论尚存争议[22-23],仍需进一步探索研究。
目前微卫星高度不稳定(MSI-H)、EBER 表达阳性为晚期胃癌患者选择免疫治疗提供一定方向[24-25]。有研究[26]分析了MSI-H 患者Keynote-059(n=7,ORR=57.1%)、Keynote-061(n=15,ORR=46.7%)及Keynote-062(n=14,ORR=57.1%)中免疫治疗结果可观,已被二线Ⅱ级推荐帕博利珠单抗单药治疗。本研究收集到4 例MSI-H 患者,2 例PR,2 例SD,ORR 为50%,DCR 为100%,与各临床试验结果类似。另收集到3例EBER 表达阳性者,1 例PR,1 例SD,1 例PD,ORR 为33.3%,DCR 为66.7%;在Kim 研究[27](n=6,ORR=100%)、Want 研究(n=4,ORR=25%,DCR=75%)中EBER 表达阳性者显示不同客观反应性,由于各研究中EBER 阳性样本量均较少,尚不能明确免疫治疗具体临床疗效,仍需进一步扩大临床研究数据进行验证。
综上所述,免疫治疗在晚期胃癌治疗中格局得以突破,但目前免疫治疗数据尚未完善,需探索一线PD-1 单抗联合化疗进展后后线如何选择、PD-1 单抗能否跨线治疗、PD-1 单抗联合抗血管治疗时机、PD-L1 表达阴性者如何选择、生物标志物适宜人群选择等。本研究为回顾性研究,尚存在选择性偏倚,且PD-1 单抗及联合方案未能完全统一,可能对结果具有一定影响,但本数据真实反映出临床治疗策略及疗效,希望能对晚期胃/食管胃结合部腺癌患者临床免疫治疗提供一定参考价值。
