高表达磷酸丝氨酸转氨酶1抑制胃癌细胞增殖的实验研究*
2022-01-18温绍艳蔡明志梁寒
温绍艳 蔡明志 梁寒
代谢重塑是肿瘤细胞的基本特征之一。除研究较为深入的糖代谢调控外,氨基酸代谢异常在肿瘤发生、发展过程中的作用也被逐渐认识。丝氨酸作为非必需氨基酸,其能支持快速生长的细胞对蛋白、谷胱甘肽和还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)的需求[1]。磷酸丝氨酸转氨酶1(phosphoserine aminotransferase 1,PSAT1)是丝氨酸生物从头合成代谢的重要催化酶之一,其将磷酸烯醇丙酮酸(phosphohydroxypyruvate)催化为磷酸丝氨酸(phosphoserine),而后者进一步去磷酸化最终生成丝氨酸(serine)。已有研究表明PSAT1 在乳腺癌、卵巢癌及部分消化道恶性肿瘤中表达异常,且与耐药相关并促进肿瘤进展,与预后负相关[2-5]。中国作为全球胃癌高发国家[6],目前鲜见该酶与胃癌相关的研究报道。仅有的一项来自韩国的研究表明,当使用幽门螺杆菌(Helicobacter pylori)分泌蛋白处理胃癌AGS 细胞后,PSAT1 在该细胞中的表达水平升高[7]。因此,本研究探索PSAT1 在胃癌细胞中的生物学功能,了解其作为胃癌治疗靶点的潜在可能性。
1 材料与方法
1.1 一般资料
在Kaplan-Meier plotter 数据库(http://kmplot.com/analysis/)的胃癌mRNA 数据集中,输入PSAT1基因名,探针号为223 062_s_at,取PSAT1 表达值中位数为界,分为高表达组和低表达组,比较两组患者的总生存期,绘制PSAT1 表达的生存曲线。
1.2 方法
1.2.1 细胞株及培养 使用含10% FBS 的RPMI-1 640培养基培养胃癌SGC7901、MGC803、BGC823、MKN45、NCI-N87、SNU1、SNU16、HGC27 细胞。使用含10% FBS 的DMEM 培养基培养永生化GES1 和293T 细胞。使用含10% FBS 的F12K 培养基培养AGS 细胞。使用含10% FBS 的IMDM 培养基培养KATOⅢ细胞。各培养基中均加入青霉素(5 U/mL)和链霉素(5 μg/mL)。细胞于37℃、CO2浓度为5%的培养箱中培养。
1.2.2 病毒质粒构建、包装和细胞转导 合成PSAT1的CDS 序列(NM_058179.4),构建在慢病毒载体plvx-IRES-puro 上(苏州泓迅生物科技公司)。按照提供的病毒包装方案,使用Lipofectamine 2000 转染试剂(美国赛默飞世尔科技公司)将PSAT1 高表达和对照质粒分别与包装质粒(pMD2.G 和psPAX2)共同转染进入293T 细胞,待48 h 后收获上清,用0.45 μm 滤器过滤,分装后于-80 ℃冰箱保存。
BGC823 和NCI-N87 细胞按照合适密度种于6孔板24 h 后,去掉培养基,加入病毒悬液(1 mL/孔),用含10% FBS 的RPMI-1 640 培养基补齐2 mL 后加入聚凝胺(polybrene,10 μg/mL)增加病毒感染效率。病毒感染24 h 后,加入含嘌呤霉素(1.2 μg/mL)的RPMI-1640 完全培养基筛选稳定感染的细胞。
1.2.3 RNA 提取、逆转和实时荧光定量聚合酶链反应 待细胞处于对数生长期时(密度约80%),采用TRIzol 提取细胞RNA(美国赛默飞世尔科技公司)。使用GoScript™逆转录试剂盒(美国Promega 公司)合成cDNA 。采用TB Green®Premix Ex Taq™Ⅱ(Tli RNaseH Plus,日本TaKaRa 公司)对PSAT1 进行实时荧光定量聚合酶链反应(qPCR)检测。GAPDH作为内参。通过2-ΔΔCt法计算各样品中PSAT1 的mRNA 表达量并进行比较。PSAT1 的qPCR 引物由美国OriGene 公司预设计:5’-ACTTCCTGTCCAA GCCAGTGGA-3’和5’-CTGCACCTTGTATTCCAGGA CC-3’。GAPDH 的qPCR 引物为:5’-TGCACCACCA ACTGCTTAGC-3’和5’-GGCATGGACTGTGGTCATG AG-3’。
1.2.4 蛋白提取和免疫印迹实验 细胞总蛋白在细胞处于对数生长期时收获。细胞裂解液配方:10 mM三羟甲基氨基甲烷盐酸盐(Tris-HCl)、150 mM 氯化钠(NaCl)、5 mM 乙二胺四乙酸二钠(EDTA)、1%曲拉通X-100(Triton X-100)、0.25% 脱氧胆酸钠(sodium deoxycholate)、蛋白酶和磷酸酶抑制剂(瑞士Roche 公司)。收获的蛋白采用BCA 蛋白定量试剂盒(美国赛默飞世尔科技公司)进行浓度检测和定量。每孔20~30 μg 蛋白进行电泳、转膜和检测。化学发光试剂采用SuperSignal West Pico PLUS(美国赛默飞世尔科技公司)。所有检测结果均使用凝胶成像系统Amersham Imager 600(美国GE 公司)采集。PSAT1抗体(10 501-1-AP)购自武汉三鹰生物技术有限公司。β-actin 抗体(AC-74)购自美国Merck 公司。辣根酶标记山羊抗兔(ZB-5 301)和辣根酶标记山羊抗小鼠(ZB-5 305)IgG(H+L)均购自北京中杉金桥公司。PSAT1 抗体按照1∶1 000 稀释,β-actin 抗体按照1∶2 000 稀释,二抗均按照1∶5 000 稀释。
1.2.5 细胞功能实验 采用Cell Counting Kit-8 试剂盒(CCK-8,美国MCE 公司)检测PSAT1 对BGC823和NCI-N87 细胞增殖的影响。PSAT1 高表达和对照BGC823 细胞种于6 块96 孔板(2 000 细胞/孔),每组重复6 孔。每隔24 h 加入CCK-8 试剂(10 μL/孔)孵育2 h 后用酶标仪(美国BioTek 公司)检测OD450值。根据同样的处理方法采用CCK-8 比较PSAT1 高表达/对照NCI-N87 细胞的增殖。因NCI-N87 细胞增殖慢,故每隔48 h 检测1 次。
将500 个PSAT1 高表达/对照BGC823 细胞和800 个PSAT1 高表达/对照NCI-N87 细胞分别种于6 孔板。每组细胞种3 个复孔。7 d 和12 d 后分别收获6 孔板。采用4%多聚甲醛室温下固定30 min,用0.1% 结晶紫染色约10 min 后,用自来水小心冲洗,晾干后拍照计数。每个孔中所有克隆数(细胞数>50 个计算为1 个克隆)计为1 个值。
1.2.6 裸鼠皮下成瘤实验 收获处于对数生长期的PSAT1 高表达/对照组BGC823 细胞,计数后用无菌PBS 重悬细胞(2×107个细胞/mL)。取100 μL 细胞悬液分别种于5 周龄雄性BABL/c 裸鼠(北京华阜康生物公司)背部左、右侧皮下。21 d 后处死小鼠,取出瘤块,称重比较。
1.3 统计学分析
采用GraphPad Prism 6 软件进行统计学分析。生存分析采用Log-rank 检验。其他实验数据采用t检验。以P<0.05 为差异具有统计学意义。
2 结果
2.1 PSAT1 表达水平与胃癌患者预后的关系
分析Kaplan-Meier plotter 数据库中PSAT1表达水平与胃癌患者预后的数据提示,根据PSAT1表达值中位数将胃癌患者分为高表达组(n=172)和低表达组(n=459)。PSAT1 高表达组患者的总生存期显著高于低表达组患者(P=1.7e-6,图1),提示PSAT1高表达很可能与胃癌患者较好的预后相关。

图1 Kaplan-Meier plotter 数据库中PSAT1 表达水平与胃癌患者总生存期之间的关系
2.2 PSAT1 在胃癌细胞株中的表达水平
qPCR 结果显示除了HGC27 和SNU1 细胞外,其余8 个胃癌细胞株中PSAT1 的mRNA 水平均显著低于GES1(图2A)。同时,免疫印迹实验显示,PSAT1 蛋白在多数胃癌细胞株中低于GES1 细胞(图2B)。HGC27 和SNU1 细胞中PSAT1 表达水平高于GES1 可能是不同胃癌细胞株中差异的遗传背景所致。提示PSAT1 表达水平的降低可能促进胃癌细胞的恶性表型。

图2 PSAT1 在胃癌细胞株及GES1 细胞中的表达水平
2.3 确认PSAT1 在胃癌细胞中过表达效率
本研究包装PSAT1 高表达的慢病毒,感染PSAT1 低表达的BGC823 和NCI-N87 细胞。通过qPCR 和免疫印迹实验,确认PSAT1 在2 个细胞中稳定高表达(图3)。
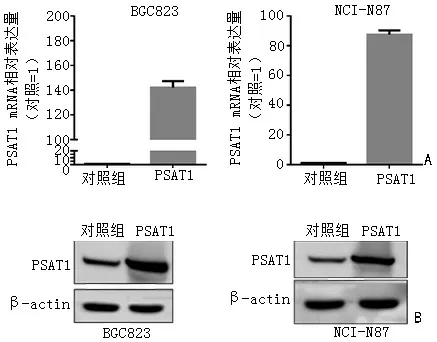
图3 PSAT1 在胃癌BGC823 和NCI-N87 细胞中过表达
2.4 过表达PSAT1 后对胃癌细胞体外增殖的作用
CCK-8 试验显示PSAT1 显著抑制BGC823 和NCI-N87 细胞的增殖能力(图4)。值得注意的是,PSAT1 对细胞增殖的抑制效应在较长时间后显现,如PSAT1 高表达/对照组的BGC823 细胞在72 h 后增殖率有所差异(72 h 时P=0.018;120 h 时P<0.000 1);而在NCI-N87 细胞中,两组细胞在96 h 后差异逐渐增大(96 h 时P<0.000 1,图4)。检测PSAT1 对胃癌细胞克隆形成能力的作用后,发现PSAT1 高表达的BGC823(P=0.029 6)和NCI-N87(P=0.036 5)细胞所形成的克隆数明显少于对照组细胞(图5)。

图4 PSAT1 抑制胃癌细胞增殖能力

图5 PSAT1 抑制胃癌细胞克隆形成能力
2.5 过表达PSAT1 后对胃癌细胞体内增殖的作用
进一步检测PSAT1 对胃癌细胞在裸鼠体内增殖能力的影响,在皮下注射21 d 后,对收获的瘤块进行称重,结果表明PSAT1 可以抑制BGC823 细胞在体内的生长(n=7,P=0.009 1,图6)。

图6 PSAT1 抑制胃癌细胞体内增殖能力
3 讨论
近年来,PSAT1 在多种肿瘤发生过程中的重要作用被逐渐认识。PSAT1 在结直肠癌、肺癌、乳腺癌、卵巢癌、食管鳞癌、胶质瘤中异常高表达,通过激活多条信号通路来促进肿瘤细胞生长增殖,预示了患者的不良预后[2-5,8-9],PSAT1 逐渐被视为潜在的预后生物标志物[10]。同时,过表达PSAT1 还可以增强肿瘤细胞对治疗的抵抗。如PSAT1 增强了结直肠癌细胞对奥沙利铂的耐药[11]。在子宫颈癌,PSAT1 通过激活PI3K/Akt 信号通路来增强对顺铂的抵抗[12]。除此以外,PSAT1 还可以促进肺腺癌、三阴性乳腺癌、食管鳞癌等肿瘤的转移能力[13-15]。
在胃癌中,PSAT1 的作用和机制均不明确。有研究发现PSAT1 表达水平在幽门螺杆菌感染的胃癌AGS 细胞中显著升高[7],提示该酶与胃癌发展可能有密切关系。本研究利用Kaplan-Meier plotter 数据库分析PSAT1 表达与胃癌患者预后之间的关系,确认PSAT1 高表达患者具有更好的预后。随之比较该基因在胃癌细胞株和GES1 细胞之间的表达差异,发现该基因在多数胃癌细胞株中的表达低于GES1 细胞。在胃癌细胞株中过表达该基因,结果发现PSAT1 可以显著抑制胃癌细胞的体外、体内增殖能力。此结果与PSAT1 促进其他类型肿瘤增殖的作用不同,提示该蛋白在不同遗传背景下作用显著不同。
综上所述,本研究初步证实了PSAT1 在胃癌细胞增殖中的抑制作用,但其作用机制尚需进一步的研究。
