ALDH2与乳腺浸润性微乳头状癌新辅助化疗的相关性研究*
2022-01-18付怡如时倩倩牛琛李帅付丽
付怡如 时倩倩 牛琛 李帅 付丽
乳腺浸润性微乳头状癌(invasive micropapillary carcinoma,IMPC)是高侵袭转移的乳腺癌亚型[1],患者从新辅助化疗(neoadjuvant chemotherapy,NAC)中获益较小[2]。乙醛脱氢酶2(acetaldehyde dehydrogenase 2,ALDH2)在维持肿瘤细胞干性方面起关键作用[3]。本研究旨在通过检测IMPC 和浸润性导管癌非特殊型(invasive ductal carcinoma no special type,IDCNOS)组织样本中ALDH2 的表达水平,分析ALDH2与IMPC 患者临床病理学特征、NAC 反应分级及预后的相关性,揭示 ALDH2 对行新辅助化疗IMPC 患者的意义,为IMPC 患者的精准治疗提供依据。
1 材料与方法
1.1 一般资料
选取2009年1月至2014年5月298 例于天津医科大学肿瘤医院行NAC 的乳腺癌患者的临床病理资料,其中IMPC 为84 例、IDC-NOS 为214 例。IMPC与IDC-NOS 患者采用倾向评分匹配法(propensity score matching,PSM)以1∶1 进行最近邻匹配(容差值为0.01),以治疗前连续变量肿瘤直径、分类变量年龄>50 岁、淋巴结是否转移为预测变量[4],标准化差异法评价两组基线资料的均衡性,匹配得到IMPC 组为84 例,IDC-NOS 组为84 例。纳入标准:1)本院初治的女性患者,既往无严重器质性基础疾病;2)术前明确无远处转移及其他部位原发肿瘤;3)手术均在本院进行,临床及病理学资料详尽完整;4)IMPC 患者均经EMA 染色验证(EMA 表达在肿瘤细胞团外表面);5)全部患者至少行6 个周期化疗,术前化疗至少1 个周期。
1.2 方法
1.2.1 免疫组织化学法 石蜡切片首先经脱蜡、水合、抗原提取、封闭及一抗孵育。再经二抗和过氧化物酶孵育并冲洗,DAB 显色及苏木精染色。最后洗涤、分化、返蓝、脱水及透明。
1.2.2 免疫组织化学法评估标准 ER 和 PR 阳性细胞核染色比例≥1%为阳性,HER-2 染色强度3+为阳性,或荧光原位杂交HER-2/CEP17≥2.0 或HER-2 基因拷贝数≥6;Ki-67 高表达为细胞核染色比例≥20%,p53 突变高表达为细胞核染色比例≥10%。ALDH2表达在细胞浆,染色强度分为无着色(0 分)、弱着色(1 分)、中等着色(2 分)、强着色(3 分),阳性细胞百分比分为0(0 分)、1%~25%(1 分)、26%~50%(2 分)、>50%(3 分)。强度与百分比乘积>4 分为ALDH2 高表达组,乘积≤4 分为ALDH2 低表达组。
1.2.3 病理化疗反应分级评分标准 采用日本乳腺癌协会的标准[5]:0 级:肿瘤细胞大部分变化不明显;Ⅰ级:肿瘤细胞<2/3 的区域变化明显;Ⅱ级:肿瘤细胞≥2/3 的区域变化明显,但仍存在浸润性成分,或疗效与Ⅲ级相似,但仍残留少量癌细胞;Ⅲ级:镜下未见浸润性成分仅存在原位癌,或癌细胞被肉芽组织或纤维化组织替代。病理学完全缓解(pathological complete response,pCR)即原发病灶与转移病灶病理检查均不存在浸润性癌细胞。
1.2.4 随访 通过电话和门诊进行随访。患者的生存时间为手术结束至末次随访。中位随访时间为41.27(4~124)个月。其他死亡原因按失访病例处理。随访内容为是否进展、复发、转移及死亡。末次随访时间为2021年1月。
1.3 统计学分析
采用SPSS 22.0 软件进行统计学分析。计量资料采用t检验,计数资料采用χ2检验或Fisher 确切概率法。单因素生存分析采用Kaplan-Meier 法,多因素生存分析采用Cox 比例风险回归模型。以P<0.05 为差异具有统计学意义。
2 结果
2.1 乳腺IMPC 与IDC-NOS 临床病理学特征及NAC 反应分级的比较
行PSM 后IMPC 组N 分期与Luminal 型比例较高,为50.0%(42/84)与86.9% (73/84),IDC-NOS 组为34.5%(29/84)与64.3%(54/84),差异均具有统计学意义(均P<0.05)。ALDH2 均定位于细胞浆中,IMPC组ALDH2 高表达率为48.8%(41/84),IDC-NOS 组为33.3%(28/84),差异具有统计学意义(P=0.041,图1,2)。此外,两组患者均未达到pCR,IDC-NOS 组的NAC 反应分级较高,对NAC 的敏感性为73.8%(62/84),显著高于IMPC 组的54.8%(46/84),两者比较差异具有统计学意义(P<0.001,表1)。

表1 IMPC 与IDC-NOS 临床病理学特征及NAC 反应分级的比较

图1 免疫组织化学法检测ALDH2 在IMPC 组织中的表达(SP×200)

图2 免疫组织化学法检测ALDH2 在IDC-NOS 组织中的表达(SP×200)
2.2 ALDH2 与IMPC 临床病理特征及NAC 反应分级的相关性
对84 例IMPC 进行分析显示,ALDH2 高表达组N 分期与p53 突变水平较高,分别为65.9%(27/41)与53.7%(22/41),ALDH2 低表达组为34.9%(15/43)与27.9%(12/43),差异均具有统计学意义(均P<0.05)。ALDH2 表达水平与NAC 反应分级呈负相关,ALDH2高表达组的IMPC 患者化疗敏感性为39.0%(16/41),显著低于ALDH2 低表达组的69.8%(30/43),差异具有统计学意义(P=0.011)。见表2。

表2 ALDH2 与IMPC 患者的临床病理特征及NAC 反应分级的相关性 (续表2)

表2 ALDH2 与IMPC 患者的临床病理特征及NAC 反应分级的相关性
2.3 ALDH2 表达水平与IMPC 预后的关系
IMPC 患者的中位随访时间为40.91(4~109)个月,Kaplan-Meier 生存曲线显示ALDH2 高表达组的无病生存(disease-free survival,DFS)率为43.9%(18/41),显著低于ALDH2 低表达组的72.1%(31/43),ALDH2 高表达组预后不良(P=0.003,图3)。
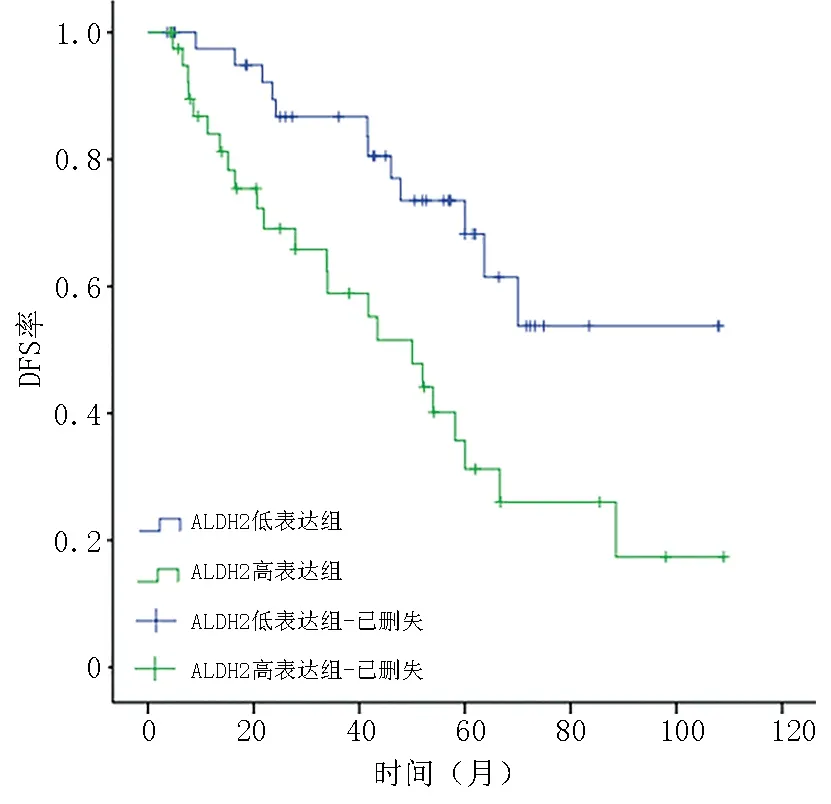
图3 ALDH2 不同表达组对IMPC 患者DFS 的影响
对84 例IMPC 患者行单因素生存分析显示,T分期、N 分期、p53 突变水平及ALDH2 表达水平与IMPC 患者的DFS 显著相关(表3)。将上述有统计学意义的因素纳入Cox 比例风险回归模型分析显示,ALDH2 表达水平与p53 突变水平是IMPC 患者的独立预后因素(HR 为2.607,95%CI 为1.284~5.294,P=0.008 与HR 为2.735,95%CI 为1.374~5.442,P=0.004,表4)。

表3 IMPC 患者DFS 的单因素生存分析
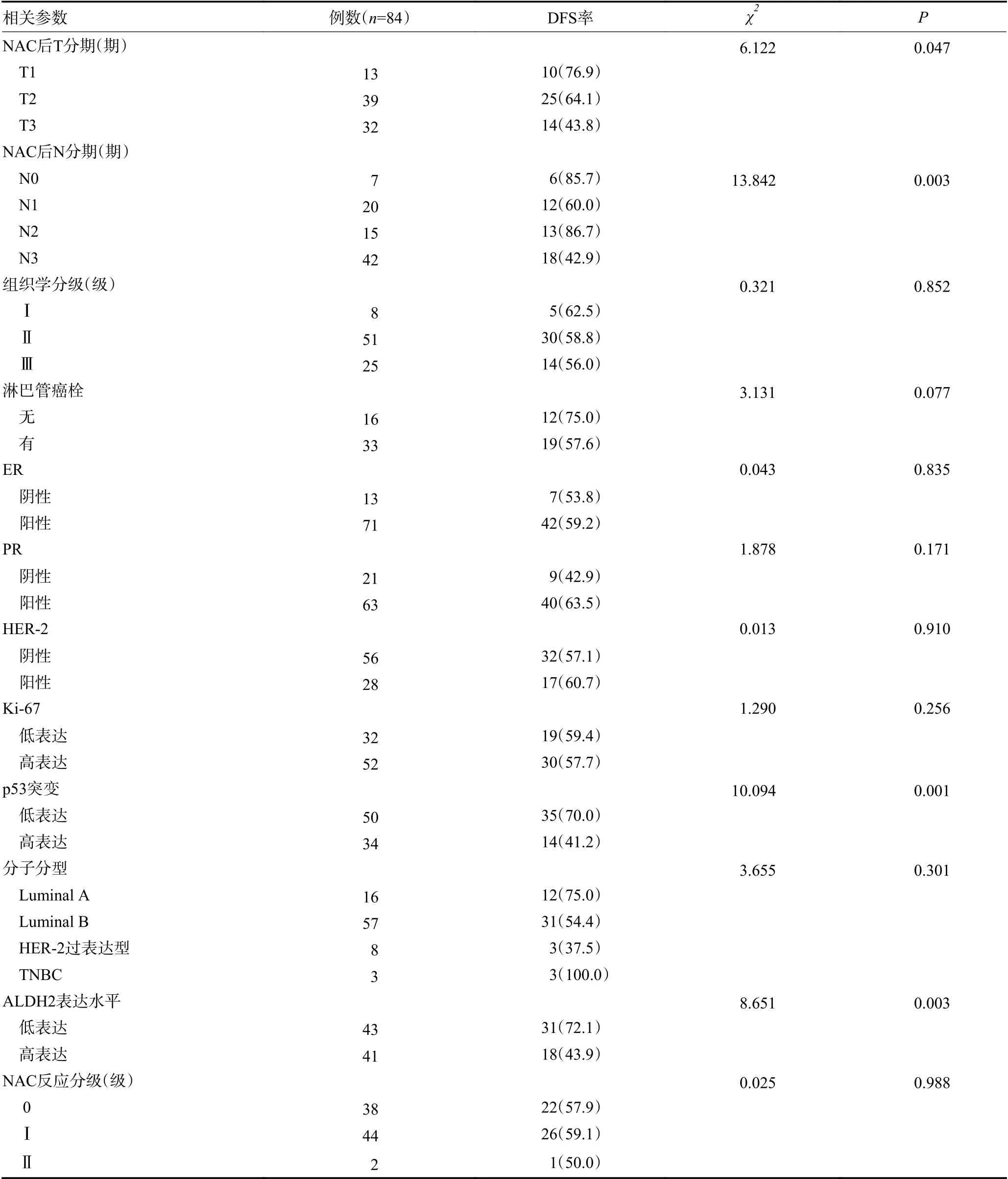
表3 IMPC 患者DFS 的单因素生存分析 (续表3)

表4 IMPC 患者DFS 的Cox 比例风险回归模型分析
3 讨论
研究表明,NAC 可缩小乳腺癌原发肿物体积,进行降期,提高患者生存质量[6]。对纯型IMPC 行NAC的疗效分析发现,所有患者均未获得pCR[2]。行NAC的Luminal 型患者获得pCR 的比例较低,且在未达到pCR 时可使总生存率降低[7]。本研究发现,IMPC组Luminal 型多达86.9%(73/84),均未达到pCR,84例患者中12 例(14.3%)肿瘤体积增大,10 例(11.9%)出现复发和/或转移。
研究显示,IMPC 具有部分肿瘤干细胞(cancer stem cells,CSCs)的特征[8],肿瘤干细胞行化疗后仍出现复发和/或转移[9]。本研究显示,ALDH2 高表达的乳腺癌患者预后较差。此外,研究发现,在浸润性膀胱癌中,ALDH2 高表达组病理学分期和组织学分级均高于低表达组[10-11]。
ALDH 家族因表达水平与预后相关,被作为CSCs 生物标志物[3]。ALDH2 可维持癌细胞干性和微管结构,在细胞水平过表达ALDH2,使肿瘤细胞对化疗药物的敏感性降低[12]。化疗药物常见的耐药机制包括低活性氧(reactive oxygen species,ROS)状态、抗凋亡途径激活和DNA 修复系统激活等,ALDH2 高表达可促进底物乙醛转化为乙酸,降低ROS,增强肿瘤细胞对化疗药物的耐受性[13]。小鼠体内实验显示,降低ALDH2 可增加肿瘤细胞对顺铂的敏感性,同时细胞内ROS 增强顺铂对肿瘤细胞的毒性[14]。在乳腺癌中,ALDH2 抑制剂双硫仑(disulfiram)可增加肿瘤细胞对化疗药物的敏感性[15]。
本研究结果发现,IMPC 中ADLH2 表达水平高于IDC-NOS,在IMPC 患者中ALDH2 表达水平与NAC 反应分级及DFS 呈负相关。由此推测,ALDH2高表达不仅与淋巴结高转移及不良预后有关,也可能影响患者从NAC 中获益。这可能与ALDH2 作为干细胞标志物,可导致肿瘤细胞对化疗药物耐受有关。
综上所述,IMPC 是一类具有高侵袭转移特性的乳腺癌亚型,ALDH2 高表达与预后不良密切相关,此外,ALDH2 高表达与NAC 疗效呈负相关。因此,针对ALDH2 高表达的IMPC 患者应尽早手术切除,以改善患者预后,延长生存。
