促肾上腺皮质激素治疗婴儿期癫痫性痉挛的药学监护
2022-01-18韩凤周昀箐李浩王翠锦王纪文上海交通大学医学院附属上海儿童医学中心上海200127
韩凤,周昀箐,李浩,王翠锦,王纪文 (上海交通大学医学院附属上海儿童医学中心,上海 200127)
1841年,West W J[1]描述了他的孩子出现一种点头伴随智力和四肢发育落后的临床事件,后被称为West综合征(West syndrome,WS)。2017年,国际抗癫痫联盟(International League Against Epilepsy,ILAE)明确了癫痫性痉挛(epileptic spasms,ES)这一概念,将婴儿痉挛症(infantile spasms,IS)统称为ES[2]。ES是一种与年龄高度相关的癫痫,新生儿ES发病率为0.2‰~0.5‰,94%的ES发生在1岁以内[3]。ES患儿脑电图多表现为高度失律,并伴随着以鞠躬样、点头样或闪电样的痉挛发作[4]。ES病因多种多样,传统抗癫痫药物治疗效果差,如不及时治疗易引起智力发育迟滞或停滞[5-6]。促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、糖皮质激素(泼尼松或泼尼松龙)和氨己烯酸是ES的一线治疗药物,临床治疗中常首选ACTH[5,7]。但在ACTH治疗过程中易发生不良反应,主要为免疫抑制和高血压[3,8]。因此,在ACTH治疗ES过程中,需密切开展药学监护工作,以快速对不良事件进行干预[9]。前期研究[10]发现,中性粒细胞/淋巴细胞比值(N/L)<0.5和前白蛋白异常增高可作为ACTH治疗期间发生高血压的预测因子。本研究对2例高血压高风险ES患儿采用ACTH治疗,结合治疗前制定的药学监护要点与病情进展进行动态药学监护,为临床提供参考。
1 病例资料
1.1 入院诊断
病例1:患儿,男,9个月17 d,身长78 cm,体质量10 kg,因“反复惊厥6个月余”入院。患儿于3月龄时出现反复点头、四肢屈曲样动作,成串发作,10~20个/串,每天发作1~3次,苏醒及入睡时均有发作,发作后无特殊不适,病程中有咳嗽,无其他特殊情况。入院前头颅核磁共振(MRI)提示患儿左侧大脑皮层发育不良伴左侧巨脑畸形。视频脑电图示异常脑电图,但无高度失律。外院给予托吡酯胶囊(12.5 mg,bid)治疗,好转,但每日仍有点头、耸肩表现,夜晚多发。为进一步诊治,以“婴儿痉挛症”收入我院神经内科。患儿入院体温36.5 ℃,心率100次/分,呼吸28次/分,血压80/60 mm Hg,神志清,精神反应可,发育落后,可追视,不能翻身、独坐。心脏超声提示存在少量心包积液。诊断:婴儿痉挛症;左侧脑发育不全。
病例2:患儿,男,7个月21 d,身长71 cm,体质量8.0 kg,因“反复惊厥2个月余”入院。患儿于5月龄时出现反复点头、四肢抖动,并成串发作,5~10个/串,每天发作3~5次,均为睡醒后发作,发作后无特殊不适,病程中无其他特殊情况。1个月前在院外就诊,头颅MRI未见异常,视频脑电图示异常脑电图-高度失律,未予特殊治疗。为进一步诊治,以“婴儿痉挛”收入我院神经内科。患儿入院体温36.4 ℃,心率118次/分,呼吸24次/分,血压90/50 mm Hg,神志清,精神反应可,发育落后,可翻身、追视,不能独坐(需靠物)。心脏超声提示房间隔缺损0.21 cm,左向右分流。诊断:婴儿痉挛症;生长发育迟缓;房间隔缺损。
1.2 主要用药情况
病例1:患儿入院第2天起采用每日1剂ACTH静脉缓慢滴注治疗(记为治疗第1天),起始剂量25 U,之后剂量12.5~37.5 U,连续给药14 d。ACTH治疗第 3天血压108/70 mm Hg,心率130次/分,给予卡托普利片(3 mg,tid)。治疗第5天血压120/60 mm Hg,心率115次/分,加用美托洛尔片(6.25 mg,q12h)稳定心率。治疗第9天,加用25%硫酸镁注射液静脉滴注(4 mL,qd)。治疗第14天,出现咳嗽,采用吸入用异丙托溴铵溶液(2 mL,bid)、硫酸特布他林雾化液(2.5 mg,bid)、吸入用布地奈德混悬液(1 mg,bid)雾化治疗,孟鲁司特钠(4 mg,qn,po),氨溴特罗口服溶液(5 mL,bid)。患儿ACTH治疗14 d后停药改为醋酸泼尼松片(20 mg,qd,po)并于 2 d 后开始生酮饮食。第17天,将醋酸泼尼松片调整为甲泼尼龙片(16 mg,qd,po)。入院第20天,患儿血压连续4 d未出现异常增高,予以出院。出院带药口服:甲泼尼龙片(16 mg,qd)、托吡酯胶囊(25 mg,q12h)、酒石酸美托洛尔片(6.25 mg,q12h)、卡托普利片(3 mg,tid)和氨溴特罗口服溶液(5 mL,bid)。
病例2:患儿入院4 d后采用ACTH(25 U,qd)静脉缓慢滴注治疗,最大剂量50 U,共使用12 d。ACTH治疗第9天,患儿血压100/50 mm Hg较前增高,第10~15天血压均高于正常范围,最高达125/50 mm Hg。降低ACTH剂量至25 U后血压仍偏高,于第13天停用ACTH改为泼尼松片(20 mg,qd)口服治疗,但血压仍持续偏高。第14天予卡托普利片(3.125 mg,tid)口服治疗后血压逐渐平稳,予以出院。患儿出院后采用卡托普利(3.125 mg,tid)继续治疗20 d预防血压增高;托吡酯胶囊(12.5 mg,q12h)口服;醋酸泼尼松片(20 mg,qd)口服,每周减量5 mg/d,至5 mg/d后服用3 d,减为“5 mg,qod”再服用3 d后停药。
2例患儿住院期间主要治疗事件、血压和心率变化情况见图1。
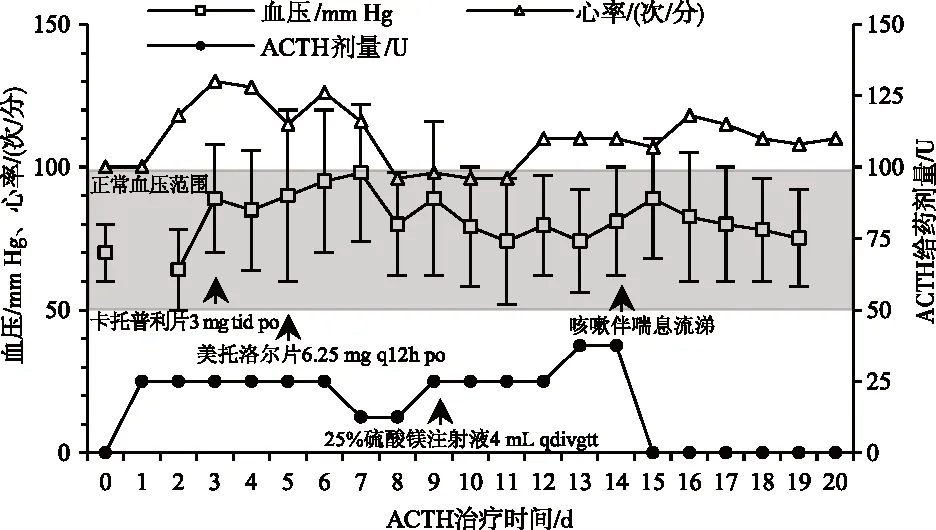
病例1
1.3 实验室检查
病例1:ACTH治疗前,N/L<0.5且前白蛋白水平增高。治疗第3天,中性粒细胞计数升高,淋巴细胞计数降低。治疗第14天,患儿淋巴细胞计数仍低于正常值,呼吸道副流感病毒RNA阳性。见表1。
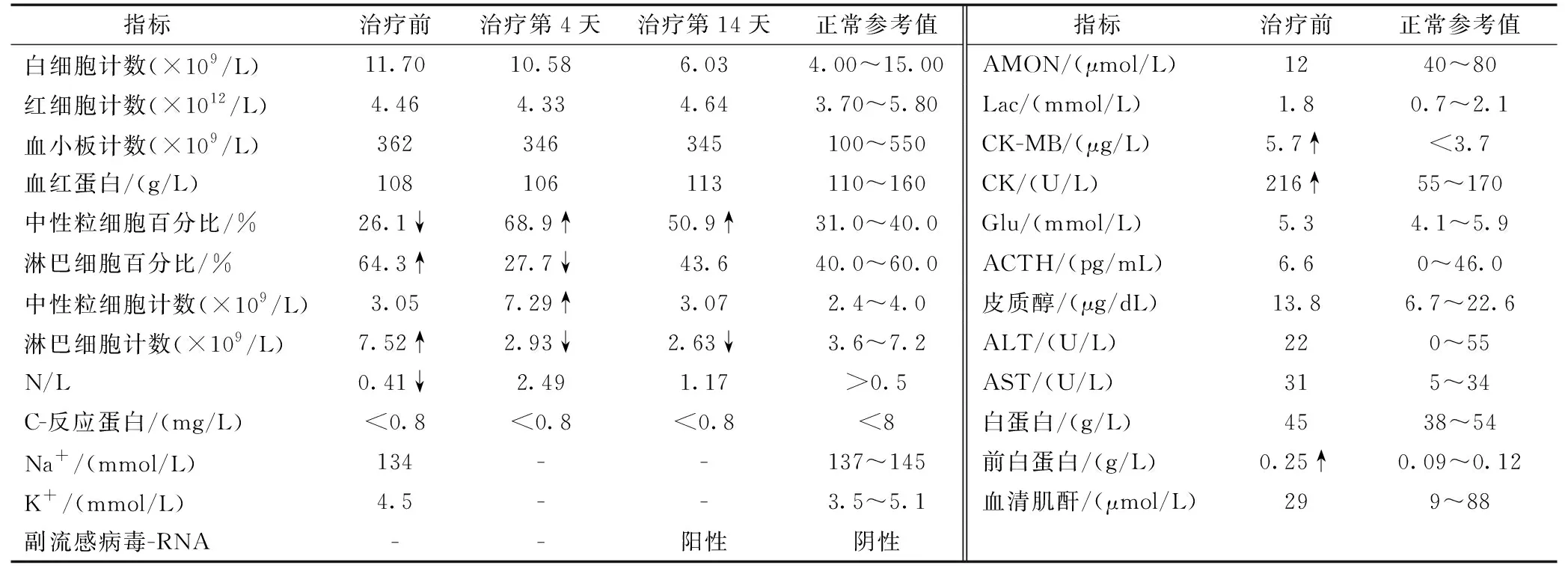
表1 病例1 ACTH治疗期间的主要实验室检查结果
病例2:ACTH治疗前,N/L<0.5且前白蛋白水平增高,血K+5.26 mmol/L偏高,AST偏高,CK-MB偏高。ACTH治疗第10天,患儿血小板计数和白细胞计数增高,其余未见明显异常。ACTH治疗第13天,血小板计数和中性粒细胞百分比偏高,其余未见明显异常。见表2。
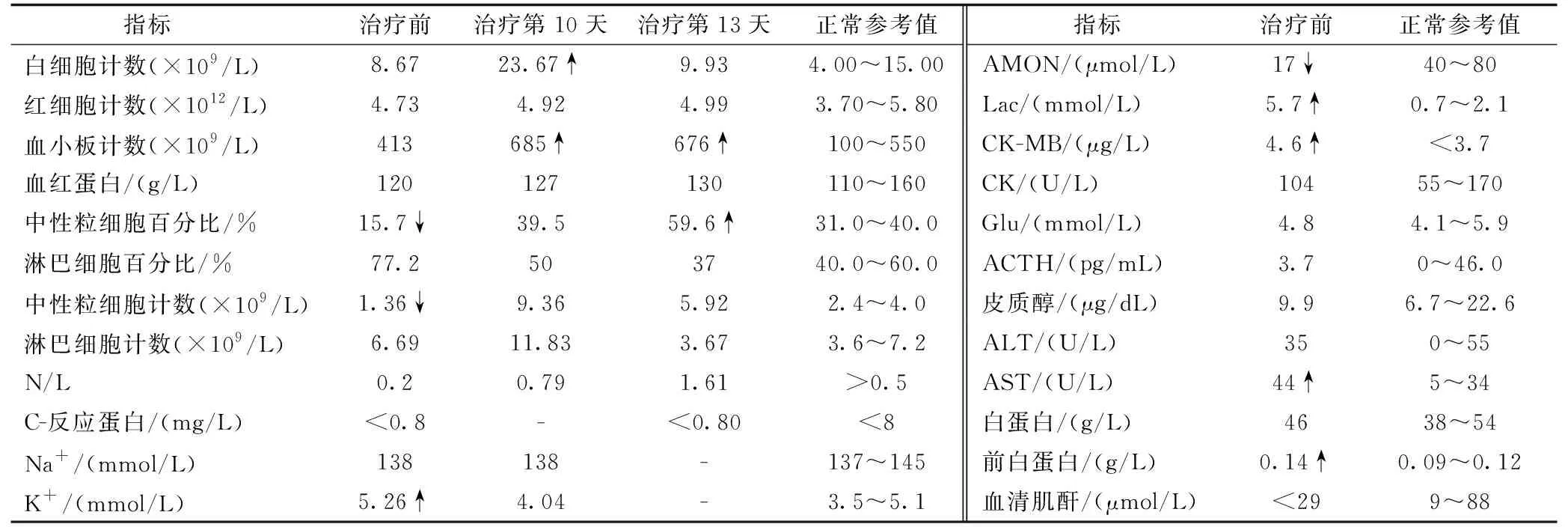
表2 病例2 ACTH治疗期间的主要实验室检查结果
2 治疗与转归
病例1:患儿采用ACTH治疗第3天出现血压和心率增高,给予卡托普利对症治疗,但血压、心率仍偏高。ACTH治疗第5天血压达到120/60 mm Hg,加用美托洛尔后心率逐渐稳定,但收缩压连续3 d高于120 mm Hg,减小ACTH剂量后,血压恢复正常。第9天恢复ACTH剂量后,患儿血压仍偏高,加用硫酸镁注射液后,恢复正常。治疗第14天,患儿因副流感病毒感染出现咳嗽,采用雾化吸入治疗,加用孟鲁司特钠和氨溴特罗口服液治疗后,咳嗽改善,于治疗第20天出院。
病例2:患儿使用ACTH治疗第10天开始出现血压异常增高,降低ACTH给药剂量和停止ACTH给药后,血压仍未得到良好的控制,于ACTH治疗第14天采用卡托普利对症治疗后,血压逐渐恢复平稳。考虑患儿血小板增多为反应性,未给予特殊处理。
3 讨论
3.1 药学监护方案的制定
ACTH是治疗ES的首选药物,但作为垂体前叶分泌的一种激素,进入人体后会作用于肾上腺皮质进而促进肾上腺皮质激素的分泌[11]。2012年美国神经病学会和儿童神经病学会循证指南推荐低剂量ACTH作为治疗ES的首选[11]。免疫抑制和高血压是ACTH治疗过程中的常见不良事件[3]。McGarry L等[12]研究发现,IS患儿采用ACTH治疗期间,高血压发生率为44%。Angappan D等[13]研究发现,IS或WS患儿采用ACTH肌肉注射治疗后,高血压的发生率高达93.3%。在我国,Yin J等[14]研究发现,IS患儿采用不同ACTH剂量治疗时,高血压的发生率在13.5%~23.6%。我们前期研究发现,N/L<0.5和前白蛋白水平可能可以作为预测ACTH治疗ES期间是否会发生高血压的预测因子[10]。在成人中,N/L在预测高血压中的作用已被证实[15-16]。中性粒细胞通过参与炎症反应介导活性氧成分的产生,进而参与一氧化氮基细胞信号传导,从而导致与高血压相关的血管反应[17-18]。淋巴细胞,尤其是B7/CD28 T细胞,与高血压的发生密切相关[19]。对于N/L<0.5的患儿,在ACTH治疗过程中,中性粒细胞水平的快速提升、淋巴细胞的高水平可能共同介导患儿发生高血压。血清前白蛋白可能通过甲状腺激素的转运来影响人体的血压[20]。因此,在采用ACTH治疗前,如果患儿N/L<0.5,且存在血清前白蛋白水平异常增高的情况,应当在ACTH治疗过程中密切监护患儿血压。如果采用卡托普利进行血压的控制,需要同时对卡托普利的使用开展药学监护。
3.2 ACTH的药学监护
在ACTH治疗前,2例患儿N/L<0.5、前白蛋白水平均增高,推测这2例患儿在ACTH治疗过程中发生高血压的风险较高[10]。为此,在ACTH治疗前,临床药师会同临床医师为患儿制定严密的药学监护计划,主要包括针对ACTH的药学监护,即每日清晨ACTH用药前、下午和晚上共3次监测血压、心率、感染指标和血清电解质。对于血压监护的指标,由于我国目前缺乏3岁以下儿童血压参考标准,低龄儿童高血压的诊断和监护存在困难[21]。Dionne J M等[22]指出,32周龄血压参考值第99百分位数(P99)为收缩压88 mm Hg,舒张压60 mm Hg。2017年美国儿科学会儿童高血压防治指南中1岁身高为77.2 cm的男孩P95血压参考值为收缩压102 mm Hg,舒张压54 mm Hg[23]。国外38周婴儿收缩压参考值P99为97 mm Hg[22-23]。儿童3个不同时间点收缩压≥P95即可诊断为高血压。高血压程度分级:1级,血压在P95~ 血小板增多依据诱发原因可分为反应性血小板增多和原发性血小板增多症[24]。内源性血小板生成素、白细胞介素-6或儿茶酚胺水平升高可能诱发反应性血小板增多[25]。儿茶酚胺主要包括去甲肾上腺素、肾上腺素和多巴胺。儿茶酚胺在临床上可用于辅助诊断高血压、甲亢、嗜铬细胞瘤和神经母细胞瘤等内分泌相关疾病。ACTH可通过促进肾上腺皮质激素的分泌,增强多巴胺β羟化酶和苯乙醇胺-N-甲基转移酶活性从而促进肾上腺髓质合成儿茶酚胺,进而引起反应性的血小板增多[24-27]。然而,对于病例2出现的反应性的血小板增多,临床无需过多干预,在正常的疾病治疗方案完成后血小板即可逐渐恢复正常[24]。 对于婴儿,在非医源性干扰的情况下,如果血压持续高于参考值P99时,需要对高血压进行干预,推荐采用静脉输注抗高血压药物。卡托普利是美国FDA批准用于婴儿的血管紧张素转化酶抑制剂(ACEI)类抗高血压药物,对年龄>3个月的婴儿推荐单次剂量为0.15~3.00 mg/kg,最大日剂量6.00 mg/kg[22-23]。该患儿为ACTH治疗ES的潜在高血压高风险患儿,经临床医师和临床药师讨论,采用口服降压药物控制血压较静脉输注对婴儿的损伤更小,因此计划一旦发生高血压,应首先考虑使用卡托普利。卡托普利作为ACEI类药物,在使用过程中需要进行密切的药学监护,监护内容包括以下三点:(1)首剂给药后密切监护血压,避免血压快速下降造成低血压,尤其在合用利尿剂时。该患儿初次使用卡托普利后未发生低血压现象。(2)密切监测血清肌酐和血K+。使用ACEI治疗时可能会导致血K+和血清肌酐升高。该患儿治疗期间未发生血钾和血清肌酐异常增高的情况。(3)给药期间注意患儿是否存在干咳,并与呼吸道感染进行鉴别。患儿使用ACTH治疗呼吸道感染风险增高,结合干咳是ACEI较为常见的不良反应,在治疗期间应当密切监护。当出现咳嗽症状时,可通过肺部体征、呼吸道病原学检测、肺部影像学等鉴别。病例1患儿ACTH治疗第3天,血压108/70 mm Hg,已达到2级高血压,紧急启用卡托普利治疗;ACTH治疗第14天出现咳嗽伴喘息流涕,经鉴别诊断为呼吸道感染,非使用卡托普利引起的不良反应。病例2患儿于ACTH起始治疗第14天使用卡托普利控制血压。2例患儿在卡托普利用药期间并未出现用药相关不良事件。 病例1患儿在ACTH治疗第2天起,心率明显增快,第3天达到130次/分,且伴随有血压异常增高,使用卡托普利控制血压,但血压仍在ACTH治疗第5天达到120/60 mm Hg。经心内科会诊和临床药师讨论,建议增加β受体阻滞剂稳定心率,并控制血压。我院供应的β受体阻滞剂包括美托洛尔、普萘洛尔、索他洛尔和艾司洛尔。普萘洛尔和索他洛尔是非选择性β受体阻滞剂,考虑其与患儿ACTH治疗过程中如发生呼吸道感染时的潜在治疗药物存在相互作用,因而选用选择性β1受体阻滞剂选择性阻断心脏β1受体而达到稳定心率和降低血压的作用。美托洛尔和艾司洛尔均为选择性β1受体阻滞剂,但艾司洛尔仅有注射剂型,因此选用美托洛尔。用药期间,应密切监护心率和血压。病例1患儿使用美托洛尔期间,心率平稳,血压控制良好。患儿在ACTH治疗14 d后出现咳嗽伴喘息流涕,呼吸道RNA检查提示副流感病毒感染,采用异丙托溴铵、特布他林和布地奈德雾化吸入治疗,氨溴特罗口服溶液、孟鲁司特钠口服治疗。特布他林和氨溴特罗中的克仑特罗均为选择性β2受体激动剂,使用过程中可能引起低血钾,用药期间需要进一步检测血钾。选择性β2受体激动剂可能会导致震颤,应密切监护。此外,应继续密切监测心率,避免心率过快。患儿在治疗期间心率出现轻微上升,未出现血钾异常和震颤。 2例患儿在病情得到控制后准予出院。对于卡托普利和美托洛尔,在出院前建议进行详细的用药指导。对于卡托普利,在出院前应告知患儿家长,婴儿对卡托普利的降压作用更为敏感,用药期间应当密切注意观察是否出现血压过度下降或者少尿的症状。食物可以减少卡托普利的吸收,建议在餐前服用药物。卡托普利可能降低白细胞水平,使患儿更容易发生感染,用药期间建议每2周检查一次血常规,如出现发热、寒战和喉咙疼痛等症状需要及时就医。卡托普利可能引起高血钾,应向家长宣教出院后需要门诊定期复查血钾。此外,用药期间如出现干咳应告知医师或药师,对于卡托普利可能引起的喉头水肿,需密切监测呼吸状况,观察有无气急、呼吸困难、发绀等表现。对于美托洛尔的使用,应告知患儿监护人美托洛尔在儿童专科医院中使用的是普通片剂,食物可以增加美托洛尔的吸收,因此在使用时建议空腹服药。美托洛尔停药时需要在医师的指导下逐渐减量,不可擅自停药。为了解药物疗效,建议定期检测心率和血压。 我国目前正加快临床药师队伍建设。临床药师工作不仅包含临床查房、药学监护,还需要完成合理用药监管、处方点评和医嘱审核等工作。由于儿童专科医院临床药学队伍建设起步晚,临床药师数量少,较难实现临床药师全职下临床。即使可以全职下临床,临床药师参与临床工作也难以覆盖全天时段,无法实现全时间段的药学监护。在临床实践中,临床医师对药学监护点和药物相互作用等药学专业知识存在较多盲区,临床药师在临床工作中可以很好的与临床医师形成知识互补。临床药师与临床医师在治疗前进行病例讨论,制定个体化药学监护方案,并在治疗过程中对药学监护方案进行动态调整,由住院医师在患儿治疗期间进行药学监护全时间段覆盖,在出现新的问题时及时反馈给上级医师和临床药师,快速进行干预,以最大程度地减少不良事件的发生。这种临床全时间段药学监护模式,是一种新颖的、可操作的、具有实践意义的临床治疗模式[28]。 临床药师在患儿用药治疗前,制定临床和药学监护方案,由临床医师开展患者住院期间的全时间段监护是可行的。临床药师与临床医师共同开展异常病情讨论,形成知识互补,能更好地为患者提供服务。3.3 血小板增多的药学监护
3.4 卡托普利的药学监护
3.5 β受体阻滞剂/激动剂的药学监护
3.6 用药宣教
3.7 基于临床药师与临床医师职能互补的全时间段药学监护模式
