嫁接于3个枣园病砧的抗病接穗枣疯植原体检测及分子变异*
2022-01-18张文鑫于少帅田国忠任争光王圣洁孔德治林彩丽
张文鑫 于少帅 田国忠 王 合 任争光 王圣洁 孔德治 李 永 林彩丽
(1.中国林业科学研究院森林生态环境与保护研究所 国家林业和草原局森林保护学重点实验室 北京 100091; 2.中国热带农业科学院椰子研究所 文昌 571339;3.北京市林业保护站 北京 100029;4.北京农学院植物科学技术学院 北京 102206)
由植原体(phytoplasma)引起的枣疯病(jujube witches’-broom,JWB)是威胁我国枣树(Ziziphusjujuba)栽培和红枣生产的最严重病害之一。该病害传染性强、分布范围广、危害严重;病树结枣少、品质下降或不结枣,小树1~2年、大树5~6年即全株死亡,造成巨大经济损失(田国忠,2002)。枣疯病的防治措施主要有选用无病繁殖材料、推广抗病或耐病品种、清除病株和野生酸枣毒源、杀灭或趋避传病媒介、病树抗生素治疗及水肥管理等栽培和生态控制等(王焯等,1988;田砚亭等,1993;田国忠等,2009)。
我国是枣树原产地,栽培历史悠久,种质资源丰富,其中一些品系表现出对枣疯病的高度感病,而另一些品系则表现出不同程度的自然抗病能力(曲泽洲等,1991;田国忠等,1999)。有学者通过人工接种-嫁接手段鉴定和筛选出抗病品系(种)(温秀军等,2005;赵锦等,2006;赵京芬等,2011)。任争光等(2015)采用分子检测手段对抗病与感病品系染病后病原菌浓度的比较研究初步揭示了某些抗病品系对病原菌生长与繁殖的抑制作用。病原菌因环境和寄主的选择压力作用存在广泛的遗传变异与多样性,因此,充分了解不同地区病原菌变异不仅有助于预测病害的发生和流行规律,而且及时监测病原菌的致病性变异对合理利用抗病遗传资源、预防病害爆发性流行、控制枣疯病等均具有重要意义(马占鸿,2010;于少帅等,2016)。
植原体难于人工培养,从技术上很难获得单克隆菌株,因此病菌变异分析的难度较大。王海妮等(2002)利用16SrDNA和tuf基因比较发现,陕西、河北、山东的枣疯病病原一致。Bu等(2016)对我国北方4省枣疯植原体株系16S rDNA进行克隆测序,测得其同源性超过99.8%,推测4省枣疯植原体广泛传播与其高度保守性特征相关。徐启聪等(2009)以16S rDNA、16S-23S间区序列(SR)和secY基因片段为靶标研究我国不同地区枣疯病分离物的分子变异,发现不同地区、不同品种上的枣疯植原体间存在较为丰富的遗传变异。目前,对于寄主抗病反应、症状表现、环境适合度相关的植原体群体的生长繁殖规律、分子变异特性等仍不明确。本研究在对我国主要枣产区抗病资源调查与鉴定的基础上,选择有代表性的抗病品系在3个不同背景已感染枣疯病的枣园进行嫁接传病试验,采集三地不同品种、不同抗性和不同病级枣树接穗和砧木样品作为试材,采用直接PCR、巢式PCR和环介导等温扩增(LAMP)技术对嫁接接种后的砧木和接穗感染植原体状况进行检测;同时,利用16S rDNA、SR、secA基因、tuf基因、fusA-tuf基因间区、himA及其下游假定蛋白基因序列等基因片段进行分析,揭示病原遗传变异规律和系统发育关系,以期为抗病品系合理利用与病害防治提供依据。
1 材料与方法
1.1 供试样品
嫁接传病试验地为北京玉泉山枣树资源圃(YQ)、北京昌平王家园(CP)和河北唐县军城镇(JC)3个枣园。选取枣园内自然发病IV-V级的枣树作为砧木,当年3—4月采集不同品种的健康接穗,于当年4月底采用插皮接方式嫁接到上述发病砧木上。昌平王家园嫁接用发病砧木品种为冬枣(Z.jujuba‘Dongzao’);河北唐县军城镇枣园发病砧木品种为当地感病婆枣(Z.jujuba‘Pozao’);玉泉山有9株嫁接树,其中2株枣树砧木嫁接多接穗,苗圃地T19砧木上嫁接4种接穗,分别为T27(2016和2017年都有成活嫁接枝)、T30、Z18、50号;中国林业科学研究院(CAF)内1株未知品系砧木(2009年嫁接时砧木无症,2016年发病)嫁接3种接穗,分别为T27、M11、JK。同时在玉泉山苗圃用健康接穗嫁接到健康砧木上作为对照处理。接穗及砧木抗性情况见表1。

表1 不同枣树品种对枣疯病抗性情况Tab.1 The resistance information of different jujube cultivars to jujube witches’broom
2017年8—10月,采集北京玉泉山枣树资源圃、北京昌平王家园和河北唐县军城镇枣园三地枣树材料样品57份。同时选取国内几个地区枣疯病样品9份,分别为江苏泗洪大枣4份(JWB-JSSH-QC1、JWB-JSSH-QC2、JWB-JSSH-QC3、JWB-JSSH-FJT)、山东泰安JWB-SDTA、河北唐县军城镇梁家沟JWB-HBTX-LJG、河北唐县军城镇史家沟JWB-HBTX-SJG、山东泰安长宁县葛石镇东长红枣(Z.jujuba‘Changhongzao’)JWB-SDTA-GSZD、北京通州区瑞正园农庄JWB-BJTZ-RZY。
1.2 试验方法
1.2.1 样品采集与DNA提取 采集3个枣园不同材料中有典型枣疯病症的枣树组织,无症样品选取1年生枝条梢部枣吊叶片,同时进行综合病级划分(I-V级)(任争光等,2015),单纯黄叶症状分级方法为i~iii,其中叶缘或叶面斑驳轻微发黄褪绿为黄叶i级,ii级为叶面2/3发黄或仅主叶脉未褪绿,iii级黄叶为全叶发黄变脆。将采集的枣树样品分别装袋并标记,干燥备用。植物总DNA提取参照艾德莱生物科技有限公司CTAB法植物基因组DNA快速提取试剂盒说明书。
1.2.2 植原体分子检测 利用通用引物对P1/P7(Dickinsonetal.,2013)和R16 mF2/R16 mR1(Leeetal.,1993)对枣树样品DNA进行PCR和Nested-PCR。LAMP检测参考广州迪澳生物科技有限公司恒温扩增试剂盒的说明书。采用显色法对提取的总DNA进行63 ℃水浴恒温扩增(王圣洁等,2017)。
1.2.3 枣疯植原体基因与基因间区的扩增测序与序列分析 将枣树DNA样品进行16S rDNA、SR(Changetal.,2004)、secA基因(Hodgettsetal.,2008)、tuf基因(Dickinsonetal.,2013)、himA及其下游假定蛋白基因(设计引物对himA-F 5′-TAGAAATACCTGCGAAAACC-3′/himA-R 5′-AAGGA AGATTGTTCATTAATTG-3′扩增,退火温度54 ℃)、fusA-tuf基因间区(于少帅等,2016)PCR扩增。将具有阳性结果的PCR产物送北京博迈德基因技术有限公司测序。利用DNAMAN6.0对测序结果进行分析和手工校验,用DNAman6.0和MEGA5.0对所得序列进行校验、拼接、比对和分子进化遗传分析。
1.2.4 构建系统发育树 将3个枣园不同样品各基因的测序结果分别与GenBank中已报道的植原体不同组的序列构建系统发育树,建树采用NJ法,Bootstrap 值为1 000。
2 结果与分析
2.1 3个枣园枣树嫁接传毒症状表现与样品的直接PCR、巢式PCR和LAMP检测
将抗性程度不同品系的休眠接穗嫁接到发病严重的感病砧木(一般为IV-V级)上,接穗上的萌芽表现出的症状包括小叶、丛枝、花梗延长、花变叶、脉间褪绿、叶片黄化、褐化、卷叶等,其中感病的砧木,包括昌平枣园的冬枣、唐县军城的婆枣、玉泉山枣资源圃的泗洪大枣、襄汾圆枣、晋枣、酸枣等发病砧木及感病接穗濮阳冬枣主要表现为丛枝、小叶、花变叶等典型症状。抗病品系接穗T30和T27在嫁接早期常出现花梗延长现象,但多未进一步发展成花变叶,而大都能正常开花结果;在正常光照生长条件下二者也未产生丛枝症状,T27多表现出典型的叶片黄化症状,T30则很少产生叶片黄化症状;但在遮荫或光照不足的条件下,这2个品系皆产生了小叶丛枝症状(表2)。

表2 3个枣园不同品种接穗嫁接后症状表现及植原体检测结果①Tab.2 Symptom and phytoplasma detection results of different cultivars after grafting transmission in three jujube orchards

续表2 Continued
中抗品系蜂蜜罐M11接穗嫁接接种后的表现复杂多样,初期表现出叶片脉间褪绿、花梗延长,进一步表现叶片黄化、卷叶(上卷)、部分叶片局部褐化坏死、部分新梢出现小叶、丛枝、花变叶等症状,后期部分变态叶又能逆转抽出近正常形状和叶色的叶片。
待鉴定品系Z18接穗嫁接初期也观察到部分花梗延长症状,但后期开花均正常发育且当年结果,枝叶生长正常,表现出对植原体的高度抗性(HR);而且其嫁接砧木枝条的丛枝症状也明显减轻、个别萌条丛枝症状消失。
从北京古枣树筛选的抗病品系50号在三地的症状反应有明显差异。在玉泉山与Z18嫁接同一母株不同分支砧木上的50号接穗当年症状严重,其下部砧木也发病严重(皆为V级);昌平接穗则表现为无症;而在唐县军城的50号是嫁接在无症的酸枣砧木上,但当年也感染发病严重。
巢式PCR检测结果表明,来源于玉泉山苗圃的枣树抗病品系的采穗树Z18、T27、T30、M11均未检测到植原体;但用LAMP的复核检测验证结果显示,除T30外,Z18、M11、T27无症采穗母树皆检测阳性。而嫁接到发病砧木上的一直未表现症状的T30接穗用直接和巢式PCR及LAMP均检测不到植原体的感染,即使在遮荫条件下表现出小叶丛枝的样品中也未检测到植原体,表现出高度抗感染能力。Z18接穗嫁接到北京玉泉山资源圃和河北唐县军城的发病砧木上皆表现为健康无症或个别黄叶症状,其中玉泉山黄叶未检测到植原体,而军城无症样品却检测到植原体。抗病接穗T27黄叶症状部位同样检测到植原体,而对花变叶部位的检测结果则是玉泉山资源圃的样品用直接和巢式PCR皆检测到植原体,而昌平枣园嫁接的T27和Z25及感病的L2接穗花变叶部位未检测到植原体,但以上样品用LAMP却检测到植原体。对中度抗病的M11接穗不同症状样品的检测结果显示,脉间褪绿、花梗延长、丛枝、小叶和花变叶部位皆易于检测到植原体的感染。对昌平嫁接的50号无症接穗用3种方法都能检测到植原体感染。表现花变叶、小叶丛枝等症状乃至无症的感病接穗与砧木样品包括冬枣、泗洪大枣、婆枣等品系、酸枣及不同地区采集的典型枣疯病样品大多用直接PCR即检测到植原体,LAMP复核验证结果也与PCR结果完全吻合,表明这些样品植原体浓度相对较高(表2)。
2.2 枣疯植原体株系变异分析
2.2.1 不同靶标基因和基因间区序列的PCR扩增和测序 对采集样品进行的植原体其他基因与基因间区的PCR扩增和直接测序,与序列比对(BLAST)结果显示,42条16S rDNA序列、42条SR基因序列、31条secA基因序列和32条tuf基因序列各自同源性为100%,而himA及其下游假定蛋白基因序列以及fusA-tuf基因间区,序列变异率分别为9.6%和18.9%(表3)。且这些序列扩增及比对结果也表明枣疯植原体株系的均一性,即皆属于16SrV-B亚组的候选种Candidatusphytoplasmaziziphi;也进一步验证了直接PCR、巢式PCR和LAMP检测植原体的结果,从而保障测定结果的准确性与可靠性。

表3 枣疯植原体基因扩增测序及各基因序列变异情况Tab.3 Sequences from gene amplification and variations of gene sequences of jujube switches’broom phytoplasma
2.2.2himA及下游假定蛋白(HP)基因序列分析himA基因编码整合宿主因子亚基,在 DNA 修复和复制蛋白方面起作用(王景丽,2016)。Wang等(2018)在JWB全基因组中公布了himA和下游假定蛋白基因序列。通过序列比对在OY-M、AYWB基因组中也发现了同源性序列(图1)。从38份样品中扩增himA及其下游假定蛋白基因序列并测序,得到长度约523 bp的himA及其下游假定蛋白基因序列。分析其中313 bp的假定蛋白基因序列片段,在117 bp位点,有碱基的颠换;在154 bp位点,河北唐县军城镇砧木3(嫁接接穗为Z18)有1个碱基A的插入;在190 bp位点,有碱基的颠换。根据3个位置碱基变化情况,将所测得38份样品及洋葱黄化和翠菊黄化植原体的himA及其下游假定蛋白基因序列,大体分为3种序列型,C-C型、C-A型和T-A型(表4)。

表4 38份样品枣疯植原体himA及其下游假定蛋白基因序列变异位点Tab.4 Variations of himA and its downstream hypothetical protein gene from 38 samples in three jujube orchards
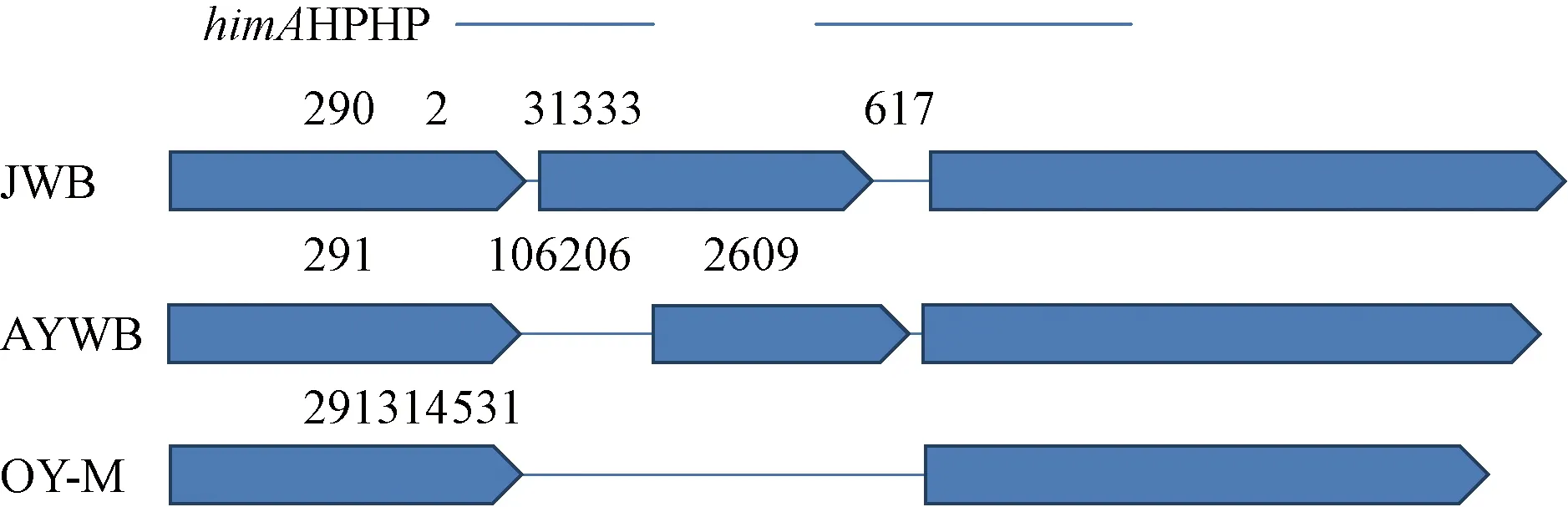
图1 OY-M、AYWB和JWB植原体himA及其下游假定蛋白基因位置和结构Fig.1 Gene structure diagram of himA and its downstream hypothetical protein gene from OY-M,AYWB and JWB
系统发育关系分析结果显示,测序菌株大致可聚于这3种序列型。其中军城镇样品序列聚于T-A型,玉泉山样品与河北唐县梁家沟枣疯序列聚于C-A型,而昌平样品和泗洪、泰安、通州枣疯序列同聚于C-C型。以上结果显示出明显的地域性分化特点(图2)。
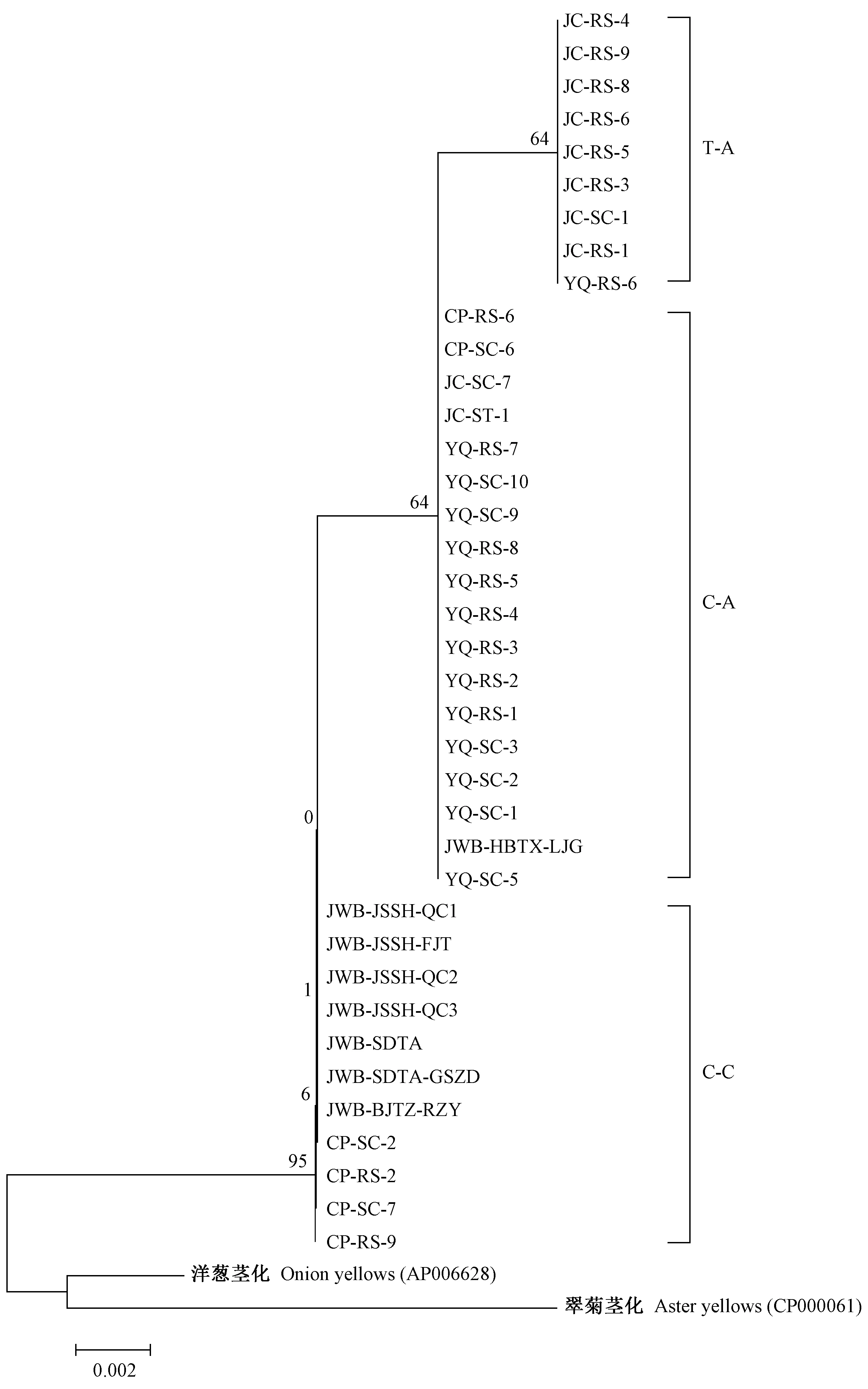
图2 38份枣疯病材料基于himA及其下游假定蛋白基因序列构建的系统发育树(MEGA 5)Fig.2 Phylogenetic tree based on himA and its downstream hypothetical protein gene from 38 samples in three jujube orchards constructed with MEGA 5
2.2.3fusA-tuf基因间区的序列分析 经扩增和测序,得到长度为338 bp的片段序列共29份,其中fusA-tuf基因间区序列长度为53 bp,在间区39 bp位置有碱基A插入/缺失。于少帅等(2016)将16SrV组不同植原体株系fusA-tuf基因间区序列分为2种变异类型,变异类型TJ1(A-)和TJ2(A+)。其中TJ1型包括枣疯病江苏南京、江苏镇江、北京海淀、辽宁大连3个株系、辽宁葫芦岛2个株系、辽宁建昌、河南周口、河南洛阳、安徽合肥、陕西渭南3个株系和重庆武隆2个株系,以及四川西昌樱桃致死黄化植原体株系和安徽合肥重阳木丛枝植原体株系。TJ2型仅包括河南濮阳枣疯植原体株系和北京海淀2个黄金槐丛枝植原体株系。
玉泉山和军城镇样品大都属于TJ2型,国内其他地区各株系和昌平样品大都为TJ1型。而YQ-RS-6、CP-SC-6以及CAF-SC-3是各地比较特殊序列株系,即与各地优势株系的类型不同。这3个株系在himA及其下游假定蛋白基因序列中也属于特殊株系,即玉泉山砧木(接穗为T30)属于军城为主的T-A型,昌平M11接穗(砧木6)属于玉泉山为主的C-A型。50号古树接穗样品的昌平株系属于TJ1型,而玉泉山和军城镇株系属于TJ2型(图3)。
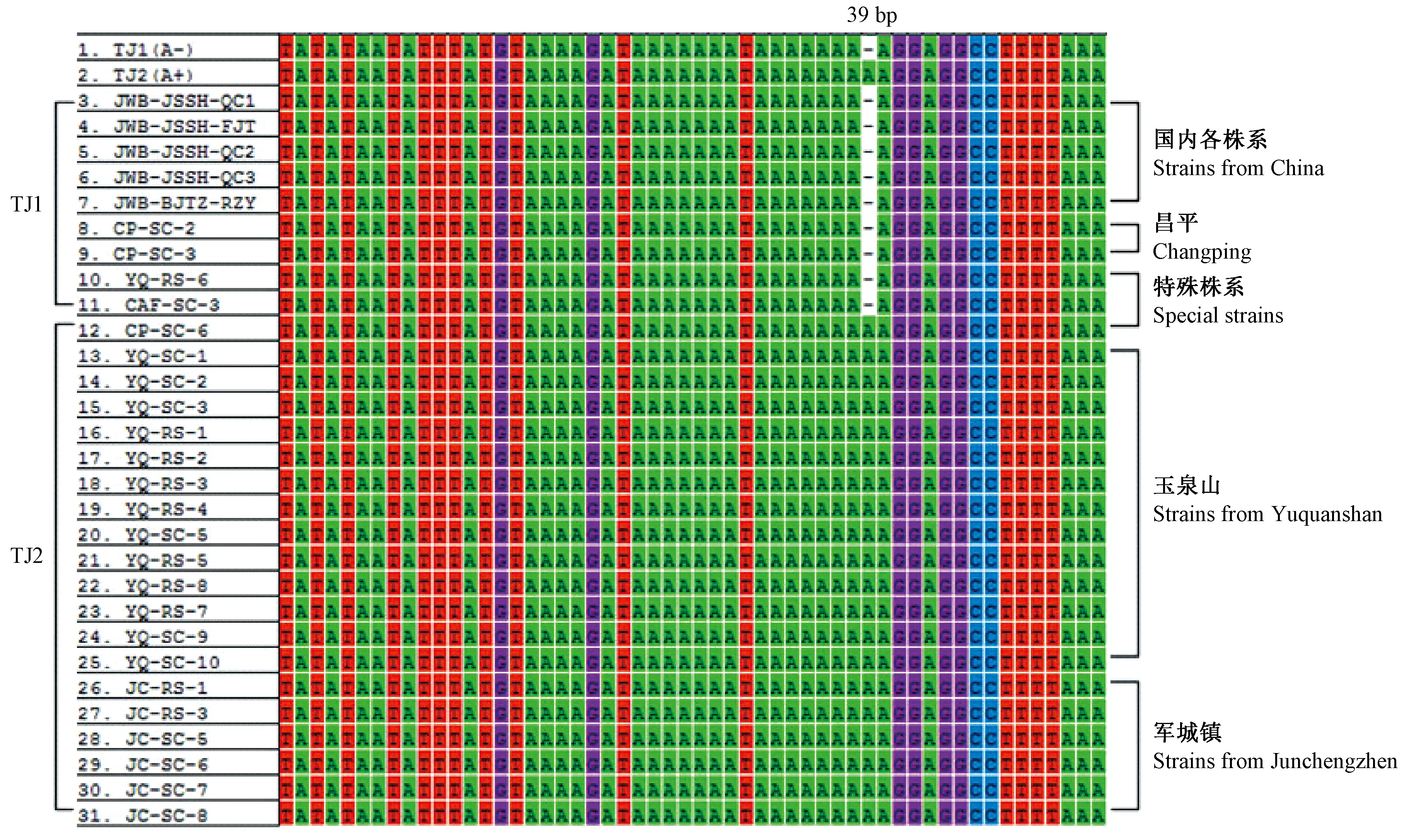
图3 29份样品与不同枣疯植原体fusA-tuf基因间区变异位点Fig.3 Variations of fusA-tuf intergenic region from 29 samples in three jujube orchardsTJ1(A-)表示碱基A缺失,TJ1(A+)表示碱基A插入,TJ3-TJ31为已测定的29个样品。TJ1(A-)means the deletion of A base.TJ1(A+)means the insertion of A base.TJ3-TJ31 means fusA-tuf genes of 29 samples.
3 讨论
3.1 枣树品种的抗病性
嫁接接后,抗病枣树接穗的症状多数轻于对应的感病砧木,甚至有部分抗性品种接穗表现无症,如T27、T30、Z18等。同品种接穗在不同枣园有较明显的症状表现差异,如北京古树50号接穗在昌平王家园枣园表现抗性较好,而在玉泉山苗圃和唐县军城镇枣园则发生V级严重小叶丛枝症状。这可能与地域环境差异有关,而三地枣疯植原体株系的致病性分化也是潜在因素。中抗品系T30接穗的抗枣疯病反应较为特殊,较少产生抗病品种T27、Z17、M11等品种接穗的黄叶、卷叶等抗病表征;也无感病品种接穗的丛枝、花变叶等典型症状;在极端遮荫条件下的接毒接穗仅产生小叶、矮缩和轻微腋芽萌生;接毒后无症接穗与健康对照接近,能正常开花结果,且无畸形病果。
本研究首次对山西农科院园艺所提供的‘骏优2号’优良品系进行了抗枣疯病能力测定。依据接穗嫁接于IV-V级病砧木上3个月后,接穗发病症状、病级和病情指数划分枣树品种抗病/感病类型(田国忠等,2013),对3个枣园不同枣树品种接穗枣疯病情指数分析,Z18品种的9枝接穗(嫁接于军城镇2株婆枣和玉泉山1株泗洪大枣)均未发病,病情指数为0,暂定其为高度抗性品种(HR)。
3.2 枣疯植原体himA及其下游假定蛋白基因和fusA-tuf基因间区的序列差异
本研究首次检测到在这3个枣园内枣疯植原体株系的himA及其下游假定蛋白基因序列与fusA-tuf基因间区存在明显的变异规律,即不同变异类型株系与地域差异有关,而与枣树抗病性强弱明显无相关性。通过对himA及其下游假定蛋白基因序列比对,可以将所测序3个枣园样品和国内几个地区枣疯样品较清晰地分为3个类型。第1类为昌平枣园和国内几个地区菌株,第2类为玉泉山枣园菌株,第3类为军城镇枣园菌株。而fusA-tuf基因间区序列分析也支持了这个结论,尤其在几个特殊序列株系玉泉山砧木(接穗为T30)、昌平M11接穗以及玉泉山林科院冀抗接穗的植原体地域变异上,himA及其下游假定蛋白基因序列与fusA-tuf基因间区序列的分析结果相吻合。而在tuf基因、secA基因、secY基因序列上并未发现明显变异,一方面表明引起枣疯病的植原体都属于16SrV-B亚组植原体,并未发现与该组其他亚组植原体的混合感染,更未发现其他组植原体引致的枣疯病(徐启聪等,2009),同时也表明这些保守持家基因的相对稳定性。
关于玉泉山枣园枣疯病的发生原因,特别是植原体来源,也是值得探讨的问题。最早推测为移栽泗洪大枣过程中误传入病原,2016年对江苏泗洪进行了枣疯病调查采样,本研究对该株系himA及其下游假定蛋白基因序列与fusA-tuf基因间区2个序列变异分析并未证实这种推论。江苏的泗洪大枣枣疯样品序列与玉泉山的优势株系序列明显不同,反而与昌平枣园优势株系序列有一定关联,故判断玉泉山病原可能是当地媒介昆虫传播感染或者通过其他来源的无症带菌接穗或种苗而传入该资源圃。因嫁接繁殖接穗来源多样,更进一步的溯源尚需要对所有引种地的相应样品的比较分析。而上述himA及其下游假定蛋白基因序列与fusA-tuf基因间区可以用作首选的靶标序列。
3.3 枣树抗病性鉴定要综合评价,尤其注意抗病稳定性
品种的遗传和抗病特性、病原变异、砧木种类与症状严重度、枣树生长和环境条件都会对抗病性鉴定的准确性和客观性产生影响,在抗病资源评价和开发利用时应统筹考虑。从北京古枣树筛选的50号品系为普通抗性类型,在强致病菌株存在或自身生长势较弱的情况下可能抗性表现较弱或丧失抗性;虽然已发现昌平菌株与玉泉山菌株的明显的分子差异,但是否昌平菌株致病性低于玉泉山菌株、且与所揭示的分子变异有关系尚待进一步研究证实(王合等,2018)。
高抗品种T27和中抗品种T30接穗在玉泉山枣园一处林荫位置表现症状为V级小叶丛枝症状,推测是林荫位置光照、湿度和通风条件较差,影响枣树有机物和抗性物质积累,从而发病严重。枣树是喜光树种,遮荫会严重影响接穗的光合作用、抑制抗病基因的表达和抗病物质的合成(田国忠等,2013)。Liu等(2016)比较了植原体感染对高抗品种“星光”和感病婆枣光合色素和活性的变化,认为抗性品种的光合响应模式有助于其产生对植原体感染的更强免疫力。而对同一抗性品种接穗在不同光照条件的反应,本研究也做了初步探讨。因此,采用适当的栽培管理方式、合理密植、适时修剪等可能会减轻枣疯病害发生和流行。
4 结论
本研究对嫁接传毒试验后3个枣园不同枣树材料进行症状观察、分子检测和分子变异分析,首次测定山西园艺所供试的骏优2号(Z18)为高抗品系;发现枣疯植原体株系差异与地域有关,而与枣树品种抗性强弱无关;初步排除了玉泉山枣园病原来源于江苏的泗洪大枣移栽传病。
