医源性与非医源性血管内异物的取出策略与方法:附15例报告
2022-01-17陈小彬黄春银林晨游悦楷戴天增黄建强黎成金郑凡陈剑伟
陈小彬,黄春银,林晨,2,,游悦楷,戴天增,黄建强,黎成金,2,,郑凡,陈剑伟
(1.中国人民解放军联勤保障部队第九〇〇医院普通外科,福建福州350001;2.厦门大学东方医院,福建福州350001;3.福建医科大学福州总医院临床医学院,福建福州350001)
近年来,随着介入手术的不断发展,中心静脉导管、起搏器、除颤器的用量不断增加,以及线圈干预病例的不断增加[1-2],导致血管内异物(intravascular foreign body,IFB)的发生风险呈逐年升高的趋势。IFB 主要分为医源性和非医源性两种,以前者为多见,多为导管断裂滞留或移位,发生率为1%[3],此类患者临床症状多不明显,常于体检胸片发现,少数患者根据异物存在部位不同症状表现多样,有肺栓塞,心脏穿孔、心脏骤停等;非医源性IFB 主要以外伤多见。IFB 存留在一定程度上可导致血管损伤、血栓形成、多器官功能损伤等风险发生,严重者可导致死亡,及时干预(取出异物)是至关重要的[4-5]。
既往取出IFB 多采用外科手术干预,但因其手术创伤较大,且预后较差,因此探索新的技术成为临床医务人员关注的热点。自Thomas 等[6]首次报道经皮血管介入取出异物以来,因其术后并发症少,临床成功率高(92.1%)等优势,已广泛应用于临床治疗IFB[7]。另一方面,随着介入各种设备的不断引入,导丝、圈套器、篮子、鹅颈式抓捕器等使用[8],IFB 高取出率及低手术风险等优势,可替代外科手术[9]。因此,本文就分析我院近几年来收治的医源性和非医源性IFB 患者的临床资料,并结合国内外相关文献报道进行分析总结,为提高此类疾病的诊疗有效性及安全性提供依据和手术操作要点,保障患者诊疗安全。
1 资料与方法
1.1 一般资料
回顾性分析2012年1月—2021年9月中国人民解放军联勤保障部队第九〇〇医院普通外科收治的15例IFB患者,男9例,女6例;年龄21~79岁,平均为(56.67±17.63)岁;原发病:医源性12 例,包括乳腺癌2 例、胃癌2 例、下肢深静脉血栓形成2 例、肺癌2 例、肝癌1 例、宫颈癌1 例、脑梗死伴颈动脉狭窄1 例、肾功能不全1 例,非医源性3 例,均为外伤致使金属制品残留血管内。纳入标准:⑴所有患者均经X 线平片或CT 证实异物存留于血管腔内;⑵临床数据及影像学资料齐全,无丢失。排除标准:⑴异物未完整取出;⑵造影剂过敏;⑶血流动力学不稳定。患者及家属均签署知情同意书。患者术前、术中临床资料如表1 所示。

表1 15例IFB患者的临床资料Table 1 The clinical data of the 15 patients with IFB
1.2 治疗方式
首选血管腔内介入取出,对于介入方法无法取出的患者,尤其是非医源性IFB,则采用局部切开取出或腔镜辅助下取出。
1.2.1 介入手术 DSA 机(GEInnovaIGS540) 引导下,患者平躺于检查床,通过改良Seldinger 技术穿刺血管,并置入导管鞘及相应抓捕器,抓捕器主要包括鹅颈抓捕器(Amplatz Goose Neck Snare Kit)、三叶草抓捕器(En Snare,MERIT Medical,US),抓捕器成功抓取异物后通过造影确认后再将其完整取出。
1.2.2 外科手术 对于血管异物较表浅的患者,可局部麻醉下切开,暴露血管并进行阻断,切开血管壁将异物取出,并通过5-0 Prolene 线进行缝合血管壁;针对位置较深的且难以行介入治疗的IFB 患者,可通过抓捕器将其拖至浅表静脉处(股静脉、颈静脉等),再行局部切开取IFB。
1.2.3 腹腔镜下异物取出术 对于介入手术失败的患者,可在术中尝试通过腹腔镜下异物取出术,在腹腔镜直视下将异物取出。
2 结果
15 例血管腔内异物均顺利取出,技术成功率为100%,手术时间为20~110 min,平均为(51±23.62) min。单纯介入治疗取出异物10 例,其中9 例通过导管撬拨并联合鹅颈抓捕器的方式进行,1 例通过环形圈套器将滞留腹主动脉内的静脉滤器取出;1 例肺癌患者,因断裂静脉输液港导管与管壁粘连严重,介入手段难以将其取出,若强行将异物拖拽取出,可导致血管壁损伤,故术中转腹腔镜下分离肺动脉进行阻断并切开血管前壁,直视下将异物完整取出;1 例患者因脑梗死伴颈动脉狭窄行颈动脉支架置入术,术后支架移位至主动脉处并造成血管壁破裂致使胸腔血性积液,急诊下行血管切开取出并血管壁修补术;3 例为非医源性IFB,均为外伤性导致,形状较不规则且粘连严重,无法将其拔出,遂行局部切开取出。1 例左大腿开放性外伤患者急查下肢X 线平片提示股静脉金属异物存留,急诊术中分离见股静脉后外侧一约0.8 cm 纵行裂口,股静脉探查未找到金属碎片,考虑铁片沿大隐静脉向心脏方向游走,遂5-0 Prolene 线进行缝合血管壁,未见渗血,血流通畅。次日复查X 线平片提示金属异物位于盆腔内,遂行剖腹探查联合异物取出;另2 例异物位于较为表前的血管腔内,遂行局部切开取出。所有患者术后均行X 线或CT 检查提示血管内异常均取出,无异物残留。术中造影剂量为(30.67±24.92) mL,术前除例6 因血管支架移位导致主动脉破裂大出血外,其余患者均未出现相应并发症,如血管破裂、出血、感染、继发性血栓形成等;术后给予抗凝治疗,15 例患者经随访,均未出现并发症,如感染、血栓形成等,超声复查血管通畅。部分患者术前、术中、术后照片见图1。
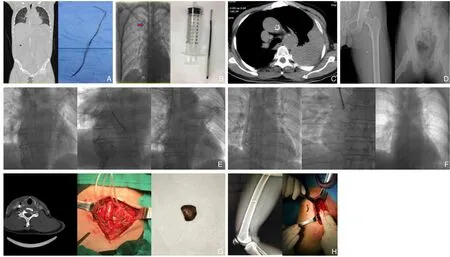
图1 部分患者术前、术中、术后照片A:导丝异物(腔静脉);B:静脉输液港导管断裂(上腔静脉);C:支架移位(主动脉);D:金属碎片(股静脉);E:静脉输液港导管断裂(上腔静脉与右心房交界处);F:静脉输液港导管断裂(右心房);G:弹片(颈动脉);H:钢钉(股动脉)Figure 1 Pre,intra- and postoperative pictures of some patientsA: Guide wire(vena cava); B: Ruptured catheter of the venous port(superior vena cava);C:Sent displacement(aorta);D:Metal fragment(femoral vein);E:Ruptured catheter of the venous port(the junction of the superior vena cava and the right atrium);F:Ruptured catheter of the venous port(right atrium);G:Shrapnel(carotid artery);H:Steel nail(femoral artery);
3 讨论
随着介入手术的不断发展和临床静脉通路的广泛应用(肠外营养、静脉输液、化疗等),特别是中心静脉导管、导丝、起搏器、栓塞线圈的使用增加,导管、鞘管、导丝其他介入器械留于体内的风险也随之增加[10]。血管腔内异物不能及时取出可导致一系列严重的并发症如心脏穿孔、肺栓塞等,其发生率高达71%,且病死率高达38%,危及患者的生命[11-12]。可见预防血管腔内异物的发生及探讨IFB 取出技术至关重要[13]。因此,现根据国内外取出异物的经验及相关文献报道与我院取出异物经验进行比较、分析和总结。
3.1 导管类异物
本研究纳入的对象有8 例IFB 为留置导管(6 例静脉输液港导管和3 例中心静脉导管)造成,考虑一方面,静脉导管多为硅胶材质,其生物相容性好、光滑,但内膜易磨损且不耐压,操作者通过固定时易打折、磨损,因此导致导管易断裂[14];另一方面,置管时间的延长,其发生断裂的风险明显提升,相关文献报道置管时长超过90 d,其发生风险高达50%[15]。相关文献报道,导管断裂在成人和儿童中的发生率分别为0.3%~2.9%和1.4%~3.6%,且多迁移入右心房和肺动脉[16],本研究中8 例导管异物均存留于右心房和肺动脉中。据报道[17]约90%导管断裂的临床患者可通过经皮血管介入方式进行回收。介入手术治疗血管腔内异物自Thomas 等[6]首次报道以来,相关设备如回收篮、抓取钳、环形圈套器、长鞘以及球囊导管相继被开发并引用到血管异物的腔内治疗上[18]。但有些设备因造成血管壁损伤等缺点逐渐被淘汰(如抓取钳),现在主要通过鹅颈抓捕器来提取IFB,因其具有较强弹性,塑形性较好,不易扭结等特性,在大多数情况下很容易用圈套环包围和捕获异物。在本研究中有7 例通过对导管游离端采取鹅颈抓捕器来抓取并将其成功取出,而针对游离端与血管壁粘连时,可尝试联合猪尾导管缠绕游离再配合抓捕器进行抓取,术后针对性给予抗凝治疗,预后较好,并发症发生率低[19]。另1 例为肺癌患者因断裂静脉输液港导管与管壁粘连严重,导管嵌入血管壁,导致抓捕器抓取失败,考虑若强行将异物拖拽取出可导致血管壁损伤风险增加,故术中转腹腔镜下分离肺动脉进行阻断并切开血管前壁,直视下将异物完整取出。笔者考虑,术中操作者可通过选取环直径为2~35 mm 的抓捕器便于IFB 的回收(抓取异物后可很好地固定,必要时进行压缩减少直径,便于将异物拖出),同时术前需借助影响学检查进行评估。
3.2 导丝类异物
以导丝为基础引导血管内穿刺可有效地提高中心静脉穿刺的安全性,然而由于操作者操作失误、管理不当致使未能及时将导丝取出,将造成严重的并发症,甚至导致患者死亡。本研究中有1 例患者因操作者未按规范操作,该患者经股静脉置管时,在导管进入血管后未及时退出导丝,致使导丝滑入体内,加上个人疏忽,从而致使导丝遗留体内,临床针对此类情况,需立即通过鹅颈抓捕器抓取近侧游离端并将其从对侧股静脉将其拖出,避免滞留时间延长导致血栓形成风险增加;据报道未及时取出体外的导丝可大概率造成血管壁机械性损伤、心律失常、感染等[20]。因此,在条件允许下,在超声定位下进行中心静脉穿刺置管后需完善胸部X 线进行评估,避免该风险的发生。
3.3 下腔静脉滤器
本研究中,2 例IFB 为下腔静脉滤器,临床上多通过置入下腔静脉滤器达到预防肾静脉血栓脱落导致严重的并发症(肺栓塞)[10]。随着滤器置入的时间延长,其相应并发症也随之上升,相关文献[21-22]报道2%~10%出现断裂、18%出现移位、50%出现静脉管壁穿孔、2%~30%出现血栓栓塞等风险。目前对于IFB 为IVCF 断裂的患者,临床上多通过介入手段(血管内钳和圈套器配合)将其取出,采用近端抓取法进行[16]。而对于下腔静脉滤器整体移位栓塞则建议外科手术取出,以防术中再次出现断裂从而损伤血管内膜。本研究例10、11 均为下腔静脉滤器断裂的患者,故术中均通过鹅颈抓捕器进行抓取,并成功抓取。
3.4 血管支架
随着血管内支架植入术的广泛应用,其发生断裂和迁移的几率也明显增加,据有关报道,支架断裂率逐年增加,从置入时间的1年(3%)增加到4年的(50%)[23];而支架移位多因支架尺寸选择不当、血管内未充分固定导致,且常迁移至下腔静脉、肺动脉以及右心房等,严重可导致肺梗死、心肌穿孔等并发症,临床上多通过球囊导管与圈套器配合将支架及时取出,其成功率高达50%~70%[9]。本研究例6 为支架移位至主动脉处并造成血管壁破裂出血,据悉该患者支架置入时长为2年,且颈动脉为双分支血管,血管的搏动和血流的压力可通过作用在颈动脉上进而产生7~9 N 的轴向分离应力,而这种分离应力可将支架从近端推向远点,支架移位易造成迟发性I 型内漏从而增加主动脉发生致命性破裂的风险,该患者急诊入院时伴随主动脉破裂出血,考虑以上可能,遂急诊下切开支架取出联合破裂血管修补。
3.5 金属异物
对于介入手术很难将IFB 移除的部分患者,应尝试立即手术取出。在本研究中2 例(例8、例9)患者因异物的形状且质地较硬,很难通过任何形式的圈套或抓捕器接触将其取出,同时异物位于较为表浅的血管腔内,遂直接行传统外科手术方法;例7 为左大腿开放性外伤致股静脉金属异物存留,急诊术中股静脉探查未找到金属碎片,考虑铁片沿大隐静脉向心脏方向游走,遂再次行剖腹探查联合异物取出;本研究3 例患者手术成功率为100%。而且在本研究中,IFB 清除过程中,并发症的发生率非常低,无严重并发症,与Koseoglu 等[24]研究结果相符。笔者考虑针对血管异物为金属异物时,术前需充分考虑异物的位置及相关治疗风险,评估手术可行性,避免异物损伤血管内膜。
总之,随着IFB 发生风险的增加,且由于异物存留时间、材质、与邻近器官的关系的差异对取出的困难程度产生不同的影响,大多数患者可通过急诊手术,首选治疗方式采用介入治疗方式,同时术前完善影响学检查如X 线、CT 等,对于简单病例,可通过鹅颈抓捕器进行抓捕异物,而针对较难取出的患者,也需要通过改进取出技术,可通过导丝塑形或改用较大的环形圈套器,操作者术中需耐心操作[25-26];对于一些形状特殊的异物,如金属异物、打折的导管等介入操作困难的患者,可结合临床具体情况,术中中转腹腔镜或开放手术进行治疗,安全性也较好[27]。
