单分支主动脉覆膜支架修复伴锚定区不足的急性Stanford B型夹层:附8例报告
2022-01-17朱凡郭媛媛李慧郭修海张雄邬光敏
朱凡,郭媛媛,李慧,郭修海,张雄,邬光敏
(昆明医科大学附属心血管病医院/云南省阜外心血管病医院1.血管外科2.放射影像科,云南昆明650032)
对于Stanford B 型主动脉夹层的治疗,胸主动脉腔内修复术(thoracic endovascular aortic repair,TEVAR)已成为治疗降主动脉夹层的首选术式[1-2]。随着对主动脉夹层分型及其预后理解的不断深入,Standford B 型夹层的定义由原来的单纯累及降主动脉向主动脉弓延伸,将病变范围,从原来的左锁骨下动脉(left subclavian artery,LSA)远端开口的范围,增加到头臂动脉远端开口的范围[3]。由于病变范围累及主动脉弓,TEVAR 术中常常需要覆盖LSA,以获取足够长度及相对健康的近端锚定区[4]。是否重建LSA 成为业内争议的话题。以往有学者认为,若非左椎动脉为颅内优势供血动脉,覆盖或栓塞左锁骨下动脉相对安全,并不影响后循环、左上肢肌力以及生活质量[5-6]。然而随着临床研究增加,学者[7-12]发现,牺牲LSA 将会在近期增加左上肢缺血的风险,同时使远期卒中发生率增加。因此,现今认为在TEVAR 术中,无论左椎动脉是否为优势动脉,都应尽量保留或重建LSA[13-14]。
TEVAR 术中全腔内重建LSA 方法有多种,如平行支架技术、开窗技术(原位或体外)及使用分支型支架等[15-17]。上述方法各有利弊。平行支架技术,由于分支支架与主体支架间存在“隙缝”,导致内漏风险相对较高。“裙边支架”正是针对此并发症而设计的,但目前尚处于临床研究阶段;体外开窗技术,如果弓型扭曲,可能会因对位不良而导致手术失败。此技术对术者要求较高,也更加适用于弓部小弯侧病变;原位开窗技术,所需“破膜”器械品种繁多,目前运用较广泛的Futhrough 穿刺针尚未上市。但与体外开窗一样,属于改变了覆膜支架结构和形态的超适应证范围的运用。针对上述各种方法的优缺点,带单分支的覆膜支架,因其操作简便,一体化设计更有利于预防“内漏”等优点,运用范围渐广。本文总结我中心单分支主动脉覆膜支架在急性Stanford B 型夹层伴锚定区不足患者中的经验,现将早期结果报告如下。
1 一般资料
1.1 病例选择
本研究为回顾性研究,选取2019年4月—2020年1月在我院接受微创Castor®一体化分支型主动脉覆膜支架的胸主动脉覆膜支架腔内隔绝术的8 例Stanford B 型夹层患者。本组8 例患者中,男7 例(87.5%),女1 例(12.5%);中位年龄42(33~64)岁。8 例患者的一般临床资料及合并症情况见表1。患者均在术前行全主动脉CT 血管造影(computed tomography angiography,CTA),诊断为急性Stanford B 型夹层(图1)。
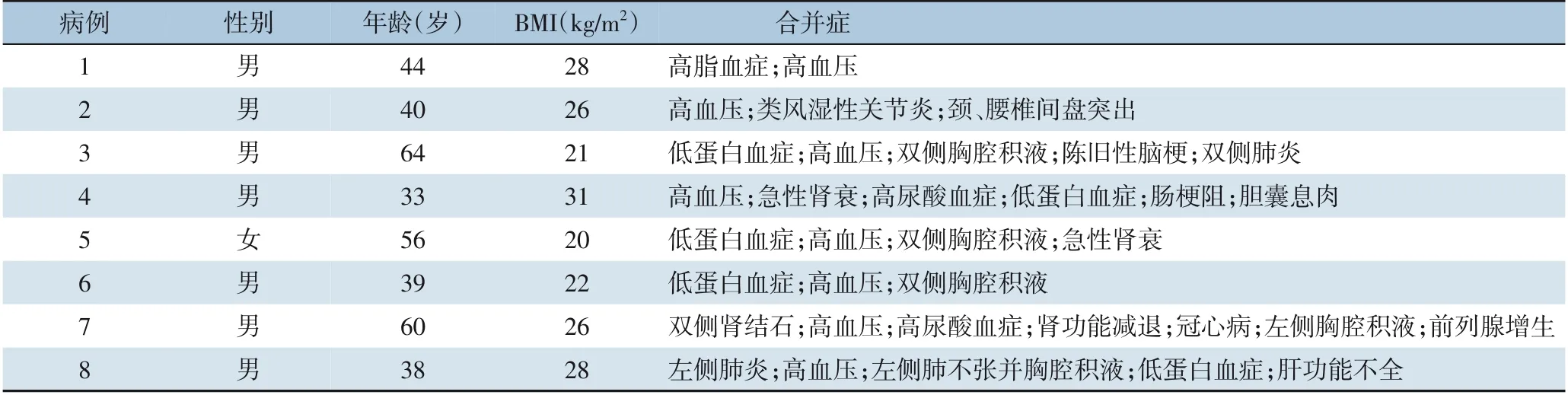
表1 8例患者一般资料Table 1 The general information of the 8 patients
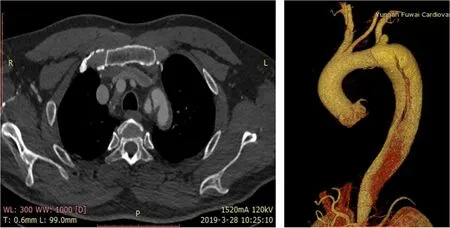
图1 术前CTA显示夹层累及LSA开口,与左颈总动脉(LCCA)开口相距约1.8 cmFigure 1 Preoperative CTA showing the dissection involving the opening of the LSA,at distance of 1.8 cm from the opening of the left common carotid artery(LCCA)
1.2 治疗方法
入院后常规控制患者血压120/70 mmHg(1 mmHg=0.133 kPa)以下,心率60~70 次/min,绝对卧床,保持排便通畅,镇静止痛,发病7~10 d后行手术治疗。术前CTA 或DSA 检查,明确病变位置与LSA 的关系,使用重建软件(syngo.via 图像应用处理软件,德国西门子)测量锚定区与LSA开口距离,决定是否需要重建LSA 及使用一体化分支型主动脉覆膜支架。手术过程:全麻,取右腹股沟切口,暴露右股动脉并套带,动脉鞘穿刺,泥鳅导丝配合猪尾导管从动脉鞘插入鞘管,选入主动脉真腔至升主动脉。Seldinger 技术穿刺左肱动脉,泥鳅导丝配合椎动脉管选入LSA 至升主动脉。高压枪造影证实真腔后,测量血管腔直径、破口位置及左椎动脉开口与LSA 距离、内脏动脉等供血情况(图2A)。网篮抓捕器由右股动脉选入,抓捕260 cm 导丝并拉出固定。建立分支导丝通道后,导入Castor®输送系统并释放。术后造影显示Castor®分支型支架精确定位且完全释放,第一破口被有效隔绝,无内漏产生(图2B)。术后1 周,1、3、6 个月及每年行全主动脉CTA 检查,评价主体支架及LSA 分支的通畅情况、是否存在内漏及夹层假腔血栓化情况。所有患者术后阿司匹林100 mg/d,口服,1 个月后复查全主动脉CTA 所显示的分支支架通畅及假腔内血栓形成决定是否继续服用。
2 结果
2.1 手术情况
血管覆膜支架在8 例患者中均成功植入,支架释放成功率100%。平均造影时间(47.5±10)min,造影剂使用(120±20) mL,术中平均失血量(43.4±16.8)mL,所有患者均无脑部并发症、无截瘫,无内漏,无左上肢肌无力(表2)。
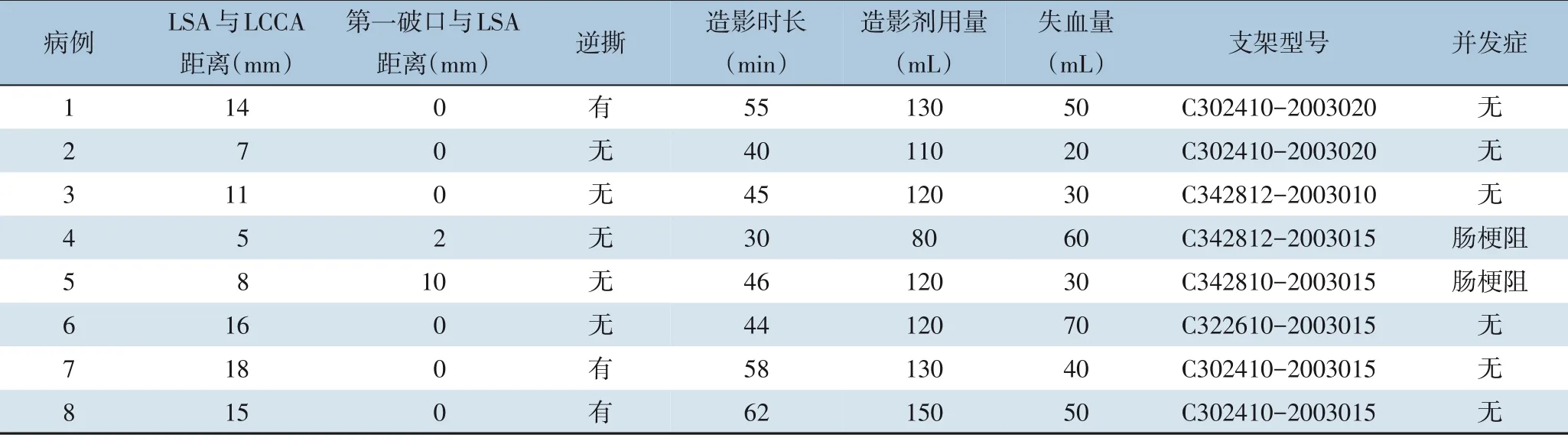
表2 8例患者的影像学及术中情况Table 2 The imaging findings and intraoperative variables of the 8 patients
2.2 术后情况
术后复查CTA 显示主体及分支覆膜支架形态良好,血流通畅。住院时间平均(14.8±3.7) d。1 例轻度贫血,下地活动恢复食欲后贫血好转。3 例术后体温升高,3 d 后自行消退。2 例腹痛,急行腹部立位平片检查,发现急性肠梗阻,结合术前CTA 提示夹层累及肠系膜上动脉。予禁食、胃肠减压及补液对症治疗后好转,术后1 周常规全主动脉CTA 复查提示无肠梗阻后出院。1 例术前因夹层累计左肾动脉导致急性肾功能不全,术后无明显改善,转综合医院治疗。所有病例术后随诊3~13 个月,分支支架通畅,无偏瘫、脑梗等并发症(图3)。
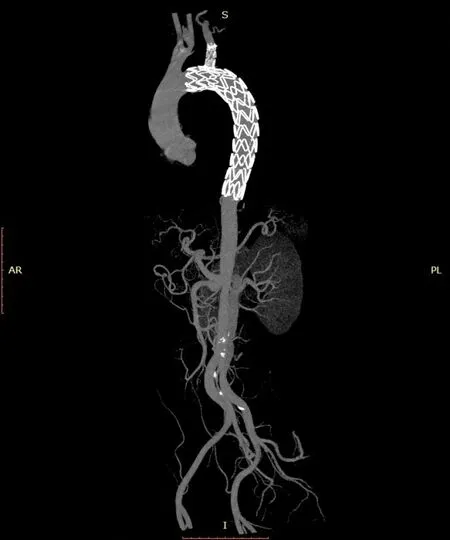
图3 术后1年复查全主动脉CTA,无内漏,分支支架通畅Figure 3 CTA of the whole aorta at 1 year after operation showing patent branch stents and absent of endoleak
3 讨论
3.1 单分支主动脉覆膜支架的发展历程
针对持续疼痛、血压难控、内脏灌注不足及肢体缺血的复杂型急性Stanford B 型主动脉夹层患者而言,接受手术治疗获益更高。传统的TEVAR手术受限于支架材料,要求足够长度的相对健康的血管锚定区,通常为15 mm,否则有逆撕或移位风险[18-19]。因此极大限制了TEVAR 手术在临床的推广,即便该术式已被承认与开放手术的手术获益大致相当,已成为Stanford B 型主动脉夹层的首选术式[16]。当第一破口紧贴LSA 远端开口,甚至累及主动脉弓部远端,传统TEVAR 通常需要通过封堵LSA 来获得足够长度及健康的血管壁作为近端锚定区。而牺牲LSA 则会增加左上肢缺血、脑卒中及截瘫的风险[17]。因此,美国血管外科协会2009年指南指出,治疗破口累及LSA 的B 型夹层,需常规行LSA 重建[20]。重建LSA 涉及锚定区向弓上前移,即锚定Z0~Z3 区域。重建方法也很多,如:复合手术、开槽技术、开窗技术、烟囱技术及分支支架技术等。经研究证实,杂交手术存在阻断颈部血管、术后吻合口狭窄甚至闭塞导致脑卒中等风险。而开窗、烟囱、潜望镜等技术导致I 型内漏风险[21-26]。由此,一体化分支型主动脉覆膜支架现世以来,用于治疗急性Stanford B 型夹层伴不良锚定区的患者。
单分支型主动脉覆膜支架及输送系统是国内第一款用于完全腔内治疗累及LSA,伴第一破口与LSA 距离<15 mm 的分支型覆膜支架系统。设计理念在于主体与分支支架缝合,一次性导入并先后释放,其分支支架对重要分支动脉的保护,有效避免了分支动脉开口被移植物覆盖所带来的并发症,延长了锚定距离,由此解决了锚定区不足,分支支架移位或闭塞等难题。适应证为Z2~Z3 区,甚至可扩展到Z1 区。主动脉弓部病变一些回顾性研究表明,根据其合理和准确的释放方法,全腔内重建主动脉及LSA 这种新方法,复合操作带来的优势包括减少I 型内漏的发生率,而这种并发症在烟囱技术中较为常见[27-30]。本研究中6 例患者左椎动脉优势,5 例患者从事重体力劳动,8 例患者平均年龄46.8 岁。鉴于此,对生活质量及术后工作左上肢肌力恢复要求较高。重建LSA 及保持其远期通畅性与修复主动脉的重要程度等同。术后随访左上肢血压同术前,患者无头晕、左上肢发凉、无力等情况。总体而言,短期随访疗效肯定。
3.2 保持单分支支架的通畅
胸主动脉覆膜支架修复主动脉夹层之后,由于假腔或远端破口依然存在,需要在随访期观察假腔血栓化及远端破口是否仍有活动性血流。因此,TEVAR 术后一般不主动抗凝、抗血小板治疗。但随着小直径的分支支架一体化植入后,为保持其通畅,避免要保护的左椎动脉闭塞,抗血小板治疗成了必需。有学者[31]认为,TEVAR 并同期置入左颈总动脉支架或左锁骨下动脉支架需要抗血小板治疗:共8 例患者接受治疗后,氯吡格雷(75 mg/d) 1 个月,阿司匹林(325 mg/d) 长期服用,短期随访结果支架通畅,但并未报道长期服用抗血小板药物是否有胃肠道出血情况。本组患者术后均服用阿司匹林(100 mg/d),术后1、3、6、12 个月复查全主动脉CTA 左锁骨下动脉支架均通畅,支架无内漏。2 例患者因腹主动脉仍有破口,考虑远期成瘤于术后1 个月停用。其余患者术后3 个月停用。本疗法的远期通畅率有待于长期密切随访和更大样本的研究。
3.3 单分支覆膜支架治疗主动脉夹层的技术陷阱及解决方案
网篮抓捕器抓捕分支支架导丝时,若主动脉夹层解剖复杂,甚至累及髂动脉,可考虑抓捕器至升主动脉抓捕,有效规避导丝入假腔风险。该单分支型主动脉覆膜支架及输送系统在主动脉推进的过程中需同时经左肱动脉牵引出分支导丝,由此产生导丝缠绕现象。反复解缠绕可能带来一定风险,尤其是降主动脉扭曲明显时。因此,在支架推送至降主动脉近弓水平时,观察标记点位置,通过缓慢旋转输送器解除导丝缠绕。一旦输送系统进入主动脉弓部,不可再旋转输送器,需退至降主动脉后再做调整,必要时调整机头位置确定是否已解除缠绕。本组病例中,有1 例降主动脉扭曲严重,输送器反复退回降主动脉,仍然无法解除缠绕,透视下调整机头,旋转输送器,最终成功解除。释放分支支架时,如果LSA 基底部较宽,可能导致主体支架部分被“拉入”LSA 中,造成整体支架变形,出现内漏。此时,可利用三叶球囊,贴附支架近端,重塑支架形态。本组病例中出现1 例拉线后主体“凸入”LSA 中,采用上述方法后,内漏消失(图4)。
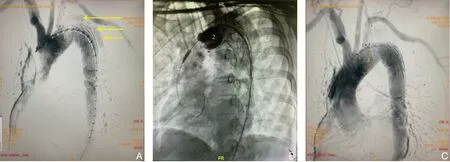
图4 1例LSA基底部较宽患者术中影像A:释放单分支一体化支架后造影,可见内漏(黄色箭头示内漏;1:单分支一体化支架因LSA基底部较宽,形态改变);B:三叶球囊重塑支架形态(2:三叶球囊);C:再次造影,内漏消失(3:塑形后的一体化支架)Figure 4 The intraoperative imaging data of one patient with a wide LSA baseA:Angiography after deployment of the unibody stent showing the endoleak(the yellow arrows showing the endoleak; 1: morphological change of the stent due to wide LSA base);B:The stent form reshaped by trilobe balloon(2:trilobe balloon);C:Subsequent angiography showing absence of the endoleak(3:the unibody stent after shaping)
总结我院单中心腔内隔绝术中,累及LSA,锚定区不足15 mm,左椎动脉优势的病例,使用单分支覆膜支架安全有效。TEVAR 术后并不提倡抗凝、抗血小板治疗。然后分支支架植入后是否常规抗凝或抗血小板,抗栓治疗的时限、强度与风险收益之间的关系等,仍需进一步研究。本组病例中分支远期通畅率、夹层的整体塑形等,需要更大样本的研究及长期随访。
