物质结构和元素周期律考点探究
2022-01-17王晓波张燕萍
■王晓波 张燕萍
物质结构和元素周期律是中学化学重要的基本理论之一,在高考中占有重要的地位,题型以选择题为主,涉及原子结构、元素周期表、元素周期律和化学键等内容,命题形式多以文字叙述或结合表格的形式出现。
一、应试技巧
1.性质与位置互推是解题的关键。熟悉元素周期表中同周期、同主族元素性质的递变规律,主要包括:①元素的金属性、非金属性;②气态氢化物的稳定性;③最高价氧化物对应水化物的酸碱性;④金属与H2O 或酸反应的难易程度。
2.结构和性质的互推是解题的要素。主要包括:①最外层电子数是决定元素原子的氧化性和还原性的主要原因;②同主族元素最外层电子数相同,性质相似;③根据原子结构判断元素金属性和非金属性强弱。
注意:“位—构—性”推断的核心是“结构”,即根据结构首先判断其在元素周期表中的位置,然后根据元素性质的相似性和递变性预测其可能的性质;也可以根据其具有的性质确定其在周期表中的位置,进而推断出其结构。
二、典例分析
例1 短周期元素W、X、Y、Z 的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z 的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol·L-1r溶液的pH 为2,s通常是难溶于水的混合物。上述物质的转化关系如图1所示。下列说法正确的是( )。
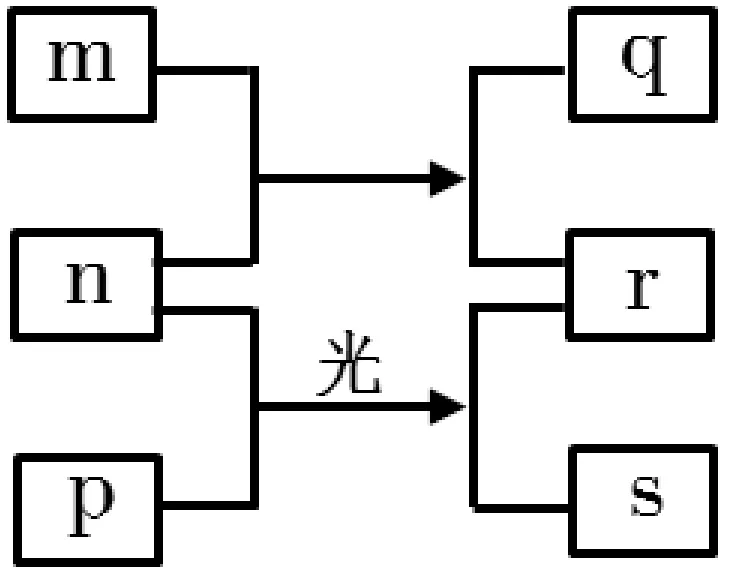
图1
A.原子半径的大小:W<X<Y
B.元素的非金属性:Z>X>Y C.Y 的氢化物常温常压下为液态
D.X 的最高价氧化物的水化物为强酸
短周期元素W、X、Y、Z 的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n 是元素Z的单质,通常为黄绿色气体,则Z是氯元素,n是Cl2;0.01mol·L-1r溶液的pH 为2,说明r是一元强酸,Cl2与两种元素组成的化合物反应会产生两种化合物,其中一种r是HCl,另一种物质q的水溶液具有漂白性,则说明W 是H 元素,m 是H2O,q是HClO;两种元素组成的化合物p 与Cl2光照反应产生HCl,同时产生s,s通常是难溶于水的混合物,根据转化关系图可知p是甲烷,则s可能是CH3Cl、CH2Cl2、CHCl3、CCl4中的几种物质。因此X 是碳元素,Y 是氧元素。
A 项错误,根据元素周期律的原子半径变化规律:同一周期的元素,原子序数越大原子半径越小,同一主族的元素,原子核外电子层数越多,原子半径越大,则原子半径的大小:W<Y<X。
B项错误,同周期元素随着原子序数的增大,自左向右元素的非金属性逐渐增强,则非金属性Y>X,最高价氧化物对应的水化物酸性越强,相应元素的非金属性越弱,高氯酸的酸性大于碳酸的酸性,则非金属性Z>X,氯元素与氧元素组成的常见化合物如次氯酸等,氯元素显正价,氧元素显负价,由此可判断非金属性Y>Z,因此元素的非金属性Y>Z>X。
C项正确,Y 元素的氢化物有H2O 和H2O2,二者在常温常压下都为液态。
D 项错误,X 的最高价氧化物的水化物是碳酸,该物质是二元弱酸,不是强酸。
答案:C
名师点睛:元素周期表、元素周期律是学习化学的工具和基本规律。元素周期表反映了元素的原子结构、元素的性质及相互转化关系的规律,是元素周期律的具体表现形式;元素周期律是元素周期表排布的依据。元素的原子半径、元素的化合价、元素的金属性和非金属性、原子核外电子排布都随着原子序数的递增而呈周期性的变化。同一周期的元素原子核外电子层数相同,从左到右原子序数逐渐增大;同一主族的元素,原子最外层电子数相同,从上到下原子核外电子层数逐渐增大。原子核外电子排布的周期性变化是元素周期律变化的原因,掌握元素的单质及化合物的结构、反应条件、物质的物理性质和化学性质等是进行元素及化合物推断的关键。本题难度较大,常由于物质的某个性质未掌握好而导致失误、失分。
例2 a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和C+离子的电子层结构相同,d与b同族。下列叙述错误的是( )。
A.a与其他三种元素形成的二元化合物中其化合价均为+1
B.b与其他三种元素均可形成至少两种二元化合物
C.c的原子半径是这些元素中最大的
D.d和a形成的化合物的溶液呈弱酸性
a的原子中只有1 个电子,则a为氢元素,a、b、c、d 为短周期元素,b2-和c+离子的电子层结构相同,则b为氧元素,c为Na元素,d 与b 同族,则d为硫元素,据此解答。
A 项错误,H 分别与O、S 形成化合物H2O 和H2S,氢元素的化合价为+1,而NaH中氢元素的化合价为-1价。
B项正确,氧元素与其他三种元素能形成H2O、H2O2、SO2、SO3、Na2O、Na2O2。
C项正确,同周期主族元素,从左到右原子半径逐渐减小,电子层数越多,原子半径越大,原子半径:Na>S>O>H。
D 项正确,d和a形成的化合物为H2S,硫化氢的溶液呈弱酸性。
答案:A
名师点睛:在短周期元素中,能形成电子层结构相同的b2-和c+离子的元素只能位于第二、第三周期,所以b为氧元素,c为Na元素,H 原子的核外只有一个电子,则a为H元素,d与b同族,则d为S元素,然后根据元素及其化合物的基础知识解答即可。
