牦牛UCP1基因生物学特性及组织表达分析
2022-01-17华永琳岳永起熊显荣字向东
赵 丹,熊 燕,华永琳,岳永起,郭 玉,熊显荣,字向东,殷 实,李 键
(1.西南民族大学畜牧兽医学院,四川 成都 610041;2.西南民族大学青藏高原动物遗传资源保护与利用教育部重点实验室,四川 成都 610041;3西南民族大学青藏高原动物遗传资源保护与利用四川省重点实验室,四川 成都 610041)
青藏高原(Qinghai-Tibet Plateau)被称为“世界屋脊”和地球“第三极”,氧分压很低,年平均气温常处于0 ℃以下,七八月的平均气温也不足10 ℃,这种极端环境成为高原动物面临的主要生存挑战[1].牦牛(Bosgrunniens)作为该区域特有畜种及遗传资源,可适应低温、低氧、强辐射、昼夜温差大的严酷环境[2],造就了牦牛耐低氧耐寒的生理特性[3].但是目前关于牦牛耐低氧耐寒的分子遗传机制尚不完全清楚.
解偶联蛋白(Uncoupling proteins, UCPs)属于线粒体负离子载体家族成员,位于线粒体内膜.UCPs几乎在所有的真核细胞中被确认,包括哺乳动物、鸟类、爬行动物、鱼类、昆虫、植物、真菌等[4-5].已知的解偶联蛋白家族成员包括UCP1、UCP2、UCP3、UCP4和UCP5,其具有不同的组织分布以及功能特征.其中,UCP2组织分布广泛,在不同的组织中有不同的作用,例如在肝以及棕色脂肪组织中主要调节产热和能量代谢,在脑组织中会减少自由基的产生,与氧化应激对脑细胞损伤作用有关[6].UCP4和UCP5主要在动物的脑部高表达,在其它组织中也有分布,具有调节能量代谢、保护神经以及调节体温的作用[7].在牦牛中,UCP3主要分布在骨骼肌中,并在胸肌和腿肌中高表达,与能量代谢有关[8-9].UCP1是产热脂肪细胞的标志基因,大多位于棕色脂肪以及白色脂肪中,参与维持机体体温的恒定[10].牦牛具有极强的抗寒适应性,UCP1是否参与牦牛体温调节尚不清楚.
研究显示UCP1通过解偶联作用进行产热,维持动物体温的恒定、调节体重以及能量平衡[11-12].当动物遭受寒冷刺激时,解除了正常生理状态下UCP1与嘌呤核苷酸的结合,使UCP1质子通道打开,导致氧化磷酸化解偶联而产热[13].然而在缺乏UCP1的情况下,机体会通过肌酸循环的机制,维持体温的稳定[14].最近的证据表明,线粒体解偶联的诱导不仅影响线粒体呼吸,会诱导线粒体解偶联导致氧化磷酸化减少[15],而且会调节多种细胞生物学过程,包括自噬、活性氧产生、蛋白质的分泌等[16-17].在家畜研究中,牛UCP1基因的多态性研究发现(C+G)%的含量高低与动物适应环境温度成正比,证明了UCP1与牛抗寒性存在关联[18].在敲除小鼠UCP1基因时,小鼠不能在棕色脂肪中产生热量,推测非颤栗性产热依赖于UCP1蛋白的功能[19-20].以上研究推测UCP1基因与动物的抗寒适应性密切相关.目前UCP1基因的功能研究主要集中在人及小鼠等模式动物,而牦牛UCP1基因序列未知,并且其是否参与牦牛的高原适应性尚不清楚.
因此,本实验以牦牛皮下脂肪cDNA为模板,克隆获得牦牛UCP1基因序列,并利用生物信息学分析方法对UCP1蛋白的理化性质、蛋白质结构及物种间的同源性进行了详细的分析,利用qPCR方法检测了UCP1在牦牛各个组织中的表达差异,丰富了牦牛UCP1基因的功能研究数据,并为进一步研究牦牛UCP1功能提供参考依据.
1 材料与方法
1.1 试验动物
由四川省阿坝羌族藏族自治州金川县庆林乡牦牛养殖场提供的4~5岁金川公牦牛和4~5岁麦洼公牦牛各3头为实验动物.将牦牛清晨空腹屠宰后,用无菌剪刀分别取其心、肝、脾、肺、肾、肌肉和皮下脂肪组织,快速置于液氮中,运回实验室,立即置于-80 ℃保存备用.
1.2 主要试剂及仪器
Trizol、qPCR试剂盒、DL 5000 DNA Marker、氨苄青霉素、及LA Taq酶均购自TaKaRa公司.琼脂糖、酵母提取物、胰蛋白胨均购自Biowest公司.胶回收及质粒提取试剂盒、pGM-T载体与大肠杆菌DH5α感受态细胞全部购自成都擎科梓熙生物技术有限公司.PCR仪(C1000)以及电泳仪均购自Bio-Rad公司.
1.3 方法
1.3.1 引物的设计及合成
根据NCBI数据库GenBank中牦牛UCP1的预测序列(GenBank注册号:XM_005895812)以及牦牛内参基因PPIA的序列(GenBank注册号:NM_178320),利用Primer premier 5.0软件进行引物设计,然后送成都擎科梓熙生物技术有限公司合成,引物序列信息如表1所示.

表1 引物信息
1.3.2 RNA提取及cDNA合成
经典Trizol法提取牦牛心、肝、脾、肺、肾、肌肉和皮下脂肪等组织的总RNA,利用微量核酸浓度分析仪(Nanodrop ND-1000美国)测定RNA浓度和纯度,其中将OD260/OD280比值在1.8~2.0的样品按照TaKaRa反转录试剂盒说明书合成cDNA,置于-20 ℃保存备用.
1.3.3 PCR扩增和目的片段胶回收
PCR反应体系为15 μL:PCR Mix 7.5 μL,上、下游引物各0.5 μL,cDNA1 μL,ddH2O5.5 μL.反应程序为:94 ℃5 min,94 ℃30 s,61 ℃40 s,72 ℃1 min,设置35个循环,72 ℃延伸5 min,4 ℃保存.
配制1.5%的琼脂糖凝胶电泳检测PCR产物,将长度符合的目的片段切下装入新的EP管中称量,参照胶回收试剂盒说明书进行胶回收.
1.3.4UCP1基因T载体构建及测序
将纯化后的产物与pGM-T载体连接并置于16 ℃过夜,后将10 μL连接产物加入100 μL DH5α感受态细胞,转化后加入300 μL LB液体培养基震荡摇匀后培养45 min,使得菌体复苏.将复苏后的菌液涂布于含0.1 mg/mL氨苄的LB固体培养基表面,37 ℃培养12~16 h.在长出菌落的固体培养基中挑3个单克隆分别加入到3个装有含氨苄的液体培养基的离心管中37 ℃、200 rmp、摇4~6 h.进行菌液PCR,反应体系及反应程序同1.3.3.用1.5%琼脂糖凝胶电泳检测PCR产物,若得到目的条带,将阳性克隆送至成都擎科梓熙生物技术有限公司进行双向测序,得到UCP1基因的序列.
1.3.5 荧光定量PCR
试验以PPIA为内参基因,qRT-PCR的反应体系:7.5 μLSYBR©Premix Ex Taq酶、上下游引物各0.5 μL(10 μM)、3.5 μL ddH2O、最后加入3 μLcDNA(20 ng/μL).反应程序为:95 ℃ 4 min;(95 ℃ 10 s,60 ℃ 30 s,72 ℃ 45 s)40个循环;72 ℃延伸5 min,检测UCP1基因在牦牛各个组织中的表达情况.
1.4 生物信息学分析
先在NCBI的ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)寻找开放阅读框,获得氨基酸序列;ProtParam(https://web.expasy.org/protparam/)在线分析牦牛UCP1基因的理化性质;Prot Scale(https://web.expasy.org/protscale/)在线进行亲疏水预测;TMpred(https://embnet.vital-it.ch/software/TMPRED_form.html)在线对跨膜结构进行预测;NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)在线进行磷酸化位点分析;SPOMA(https://npsaprabi.ibcp.fr/cgibin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)在线进行蛋白二级结构预测;SWISS-MODEL(https://swissmodel.expasy.org/interactive)在线进行蛋白三级结构预测;NCBI在线BLAST进行序列比对;最后利用MEGA 5.05软件进行进化树的构建.
1.5 数据统计分析
荧光定量PCR数据利用2-ΔΔCt法进行数据处理,结果采用GraphPad Prism 8分析软件中的 ANOVA 程序进行单因素方差分析以及多重比较.
2 结果与分析
2.1 牦牛UCP1基因序列分析
本实验以牦牛皮下脂肪CDNA为模板,进行PCR扩增,获得UCP1基因目的条带为954 bp(图1A).将菌液送往公司测序,利用NCBI ORF Finder 在线获得UCP1序列的开放阅读框,得到UCP1基因ORF全长为942 bp,编码313个氨基酸,结果与预期实验相符(图1B),并将所获得的UCP1基因序列提交到NCBI数据库,其GenBank登录号为MW345537.
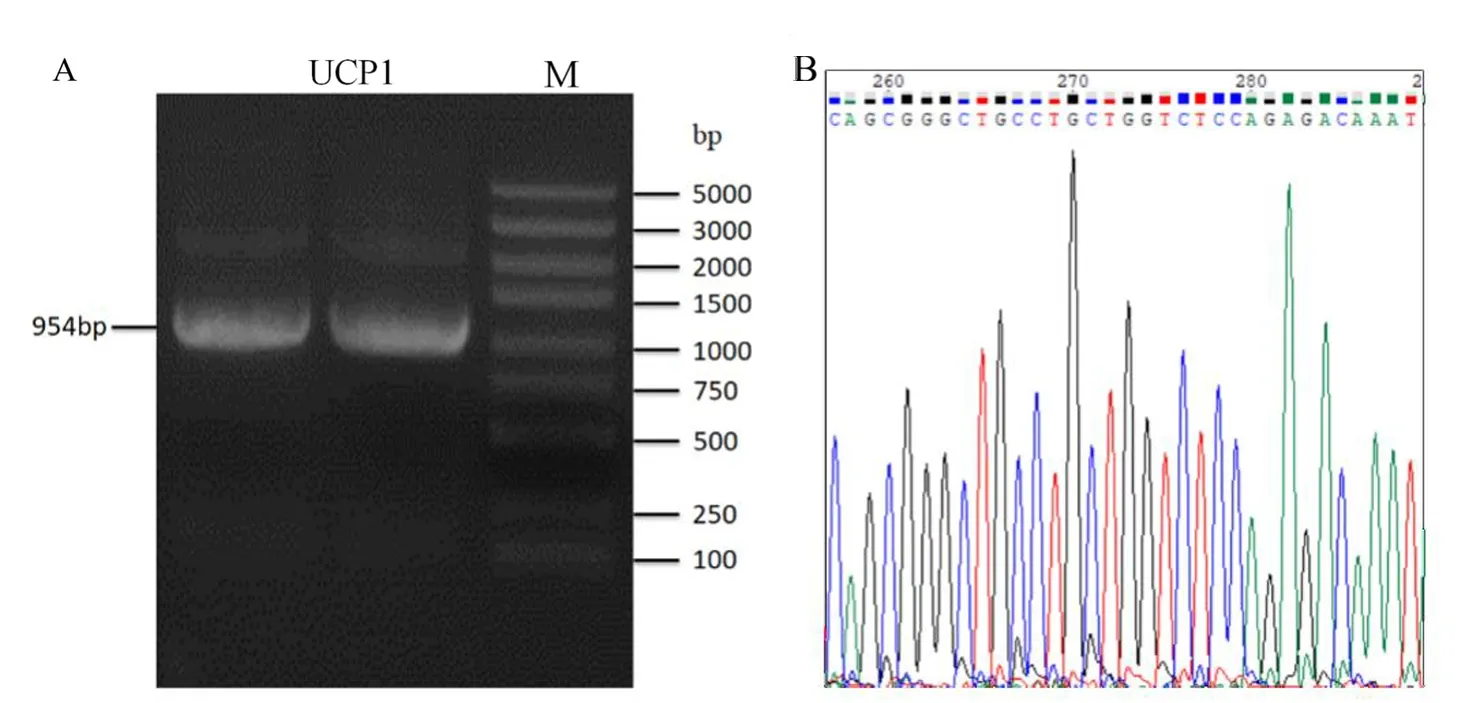
图1 牦牛UCP1基因克隆
2.2 牦牛UCP1基因生物信息学分析
2.2.1 蛋白理化性质分析
利用ProtParam在线分析UCP1的理化参数,结果显示UCP1蛋白的氨基酸数目为313个,相对分子质量为33 952.48,理论pI值为8.94.由20种氨基酸组成,带有25个负电荷残基数,18个正电荷残基数(表2).UCP1蛋白的不稳定系数为34.62.第62位的氨基酸的分值最高(2.311),疏水性最强;309位的氨基酸分值最低(-3.033),亲水性最强.经过计算得到总平均亲水性系数为0.134,则推测该蛋白为不稳定疏水性蛋白(图2).
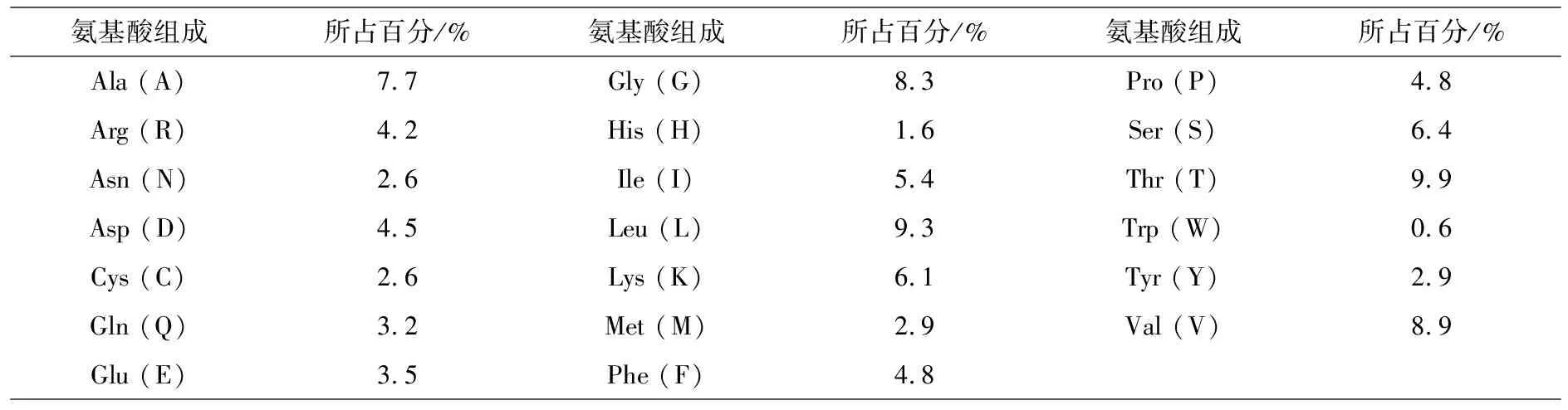
表2 牦牛UCP1蛋白的氨基酸组成
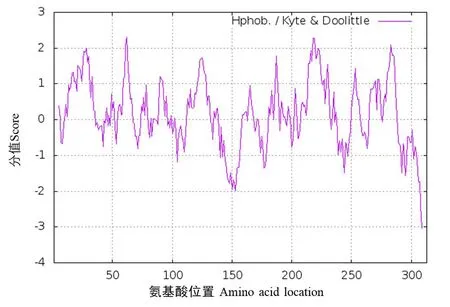
图2 牦牛UCP1蛋白亲疏水性分析
2.2.2 蛋白跨膜结构及磷酸化位点分析
利用TMpred软件在线分析发现UCP1蛋白在第14~32、115~135、214~231、271~291位氨基酸之间分别存在19、18、21、20个由膜内向膜外跨膜的氨基酸,在第12~34、115~135、214~234、268~287位氨基酸之间分别存在23、21、21、20个由膜外向膜内跨膜的氨基酸(图3A).磷酸化位点预测,UCP1蛋白一共有31个苏氨酸(Thr)磷酸化位点(第5、12、31、36、49、61、64、68、98、104、105、120、121、132、153、155、164、165、169、175、176、180、188、192、224、225、236、247、258、300、305位),20个丝氨酸(Ser)磷酸化位点(第7、19、50、51、76、87、90、110、113、116、143、216、228、229、241、242、248、263、272、278位),9个酪氨酸(Tyr)磷酸化位点(第55、75、96、152、156、159、193、246、307位).结果见图3B.
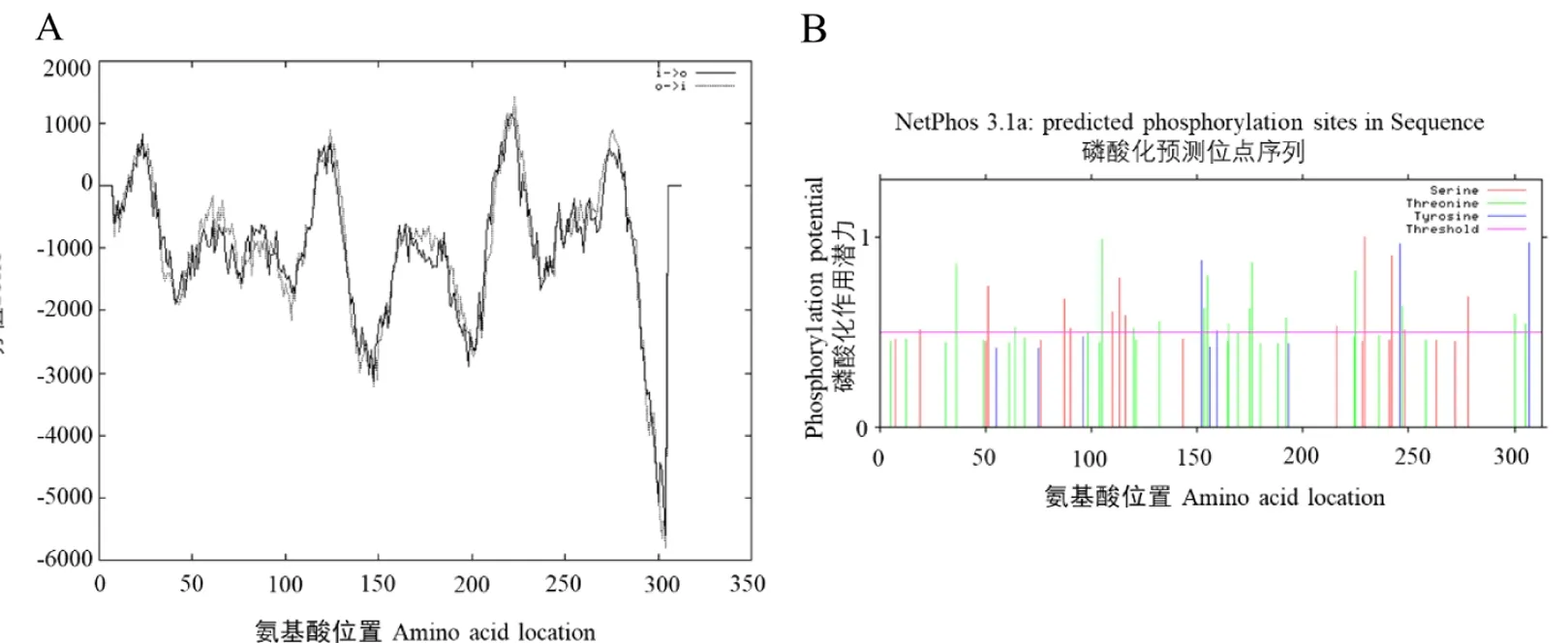
图3 UCP1蛋白质跨膜结构域以及磷酸化位点分析Fig.3 Transmembrane domain and phosphorylation site analysis of UCP1 protein
2.2.3 蛋白结构与功能预测
根据SOPMA进行预测,牦牛UCP1蛋白的二级结构主要由46.33%的α螺旋(Hh)、32.59%的无规卷曲(Cc)组成和15.34%延伸链(Ee)组成,而β转角(Tt)仅占5.75%(图4A,4B).UCP1蛋白的三级结构预测结果与二级结构预测一致,由无规则卷曲、α螺旋和延伸链三者交替出现,并且预测得到线粒体解偶联蛋白1(UCP1)寡聚状态为单体(图4C).
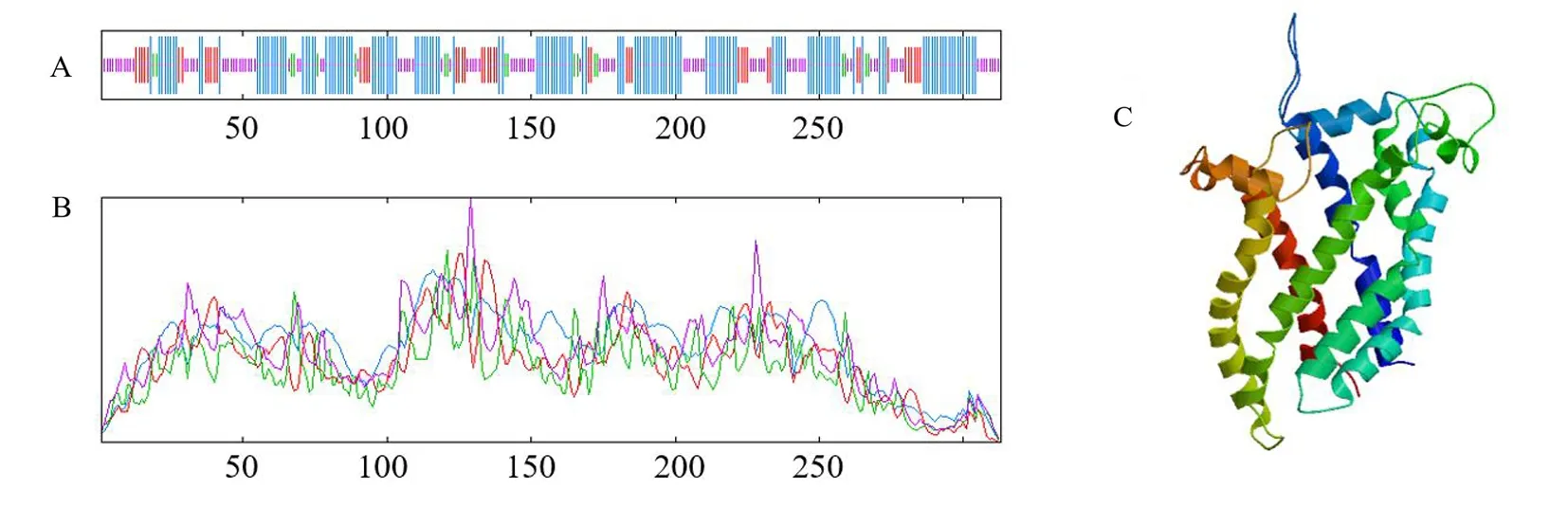
图4 UCP1蛋白质序列二级结构及三级结构预测A-B.蓝色线表示α螺旋、紫色线表示无规则卷曲和红色线表示延伸链.C.UCP1蛋白的三级结构
2.3 牦牛UCP1基因在不同物种之间的同源性对比
利用在线BLAST对牦牛和其他物种的UCP1基因的核苷酸和氨基酸序列进行了比对(表3),发现牦牛与普通牛、山羊及绵羊的核苷酸序列和氨基酸序列相似度最高,与斑马鱼的核苷酸序列和氨基酸序列相似度较低,仅分别为62.58%和64.29%.基于UCP1基因序列利用MEGA 5.05对牦牛与其他物种进行了系统进化树的构建,结果与序列结果比对一致,牦牛与普通牛的亲缘关系最近,其次是山羊和绵羊,与斑马鱼的亲缘关系最远(图5).
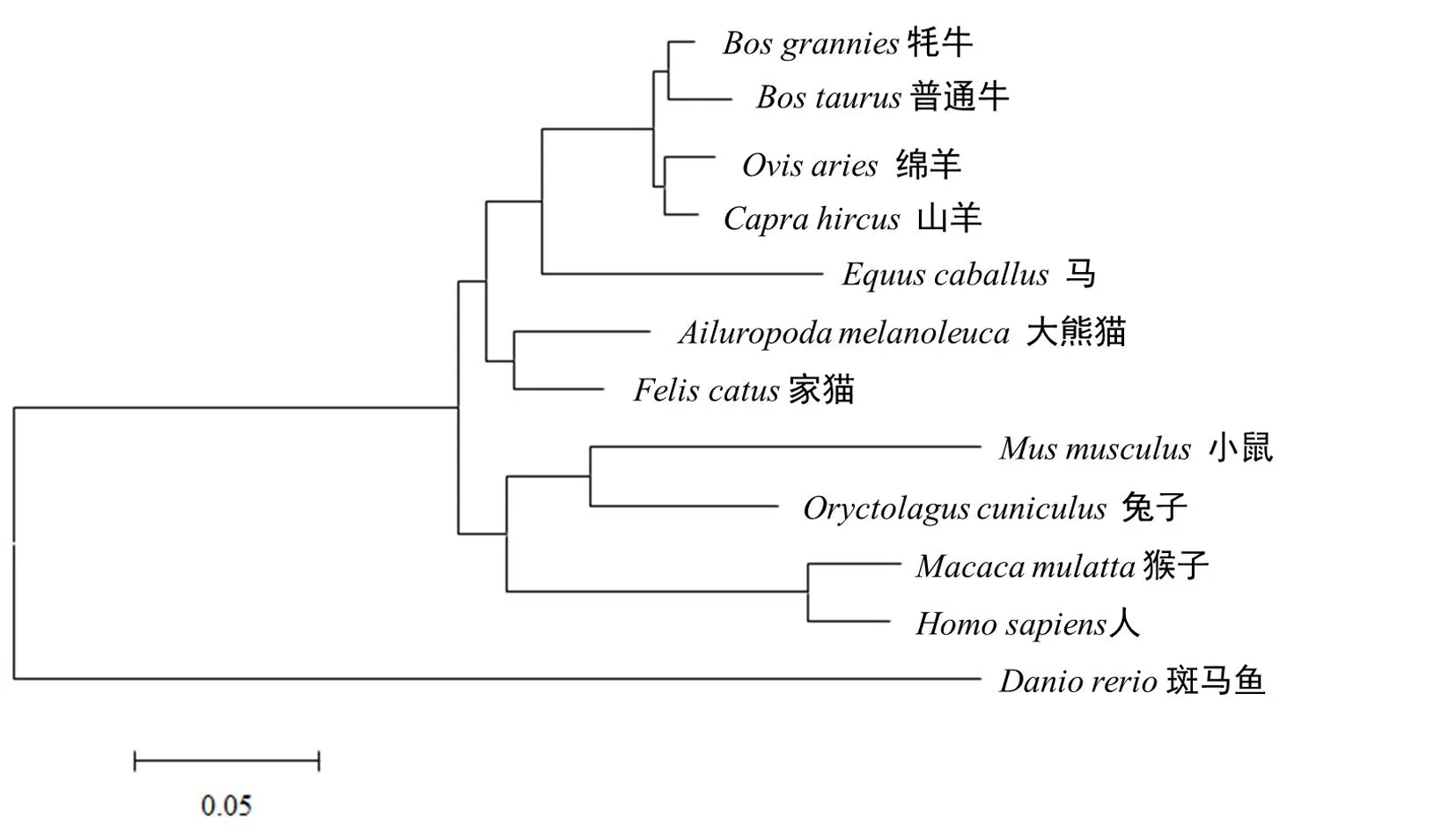
图5 牦牛与其他物种的UCP1基因系统进化树
2.4 牦牛UCP1基因组织表达分析
利用qRT-PCR方法检测出了UCP1基因在牦牛不同组织中的相对mRNA的表达量.结果显示,UCP1在牦牛各个组织中均有表达(图6A),在肾中的表达量最高,并显著高于其他组织(P<0.05),除肾之外其他组织之间没有差异显著性.由于金川牦牛与麦洼牦牛肌内脂肪以及肉质有一定程度的差异[21],于是我们进一步研究了UCP1基因在金川牦牛和麦洼牦牛的肝、脂肪、半腱肌、背最长肌中的表达量(图6B),发现UCP1基因在金川与麦洼牦牛的脂肪、半腱肌中没有差异,在背最长肌中的表达量麦洼牦牛显著高于金川牦牛(P<0.05),并且UCP1基因在麦洼牦牛肝中的表达量极显著高于金川牦牛(P<0.0001).
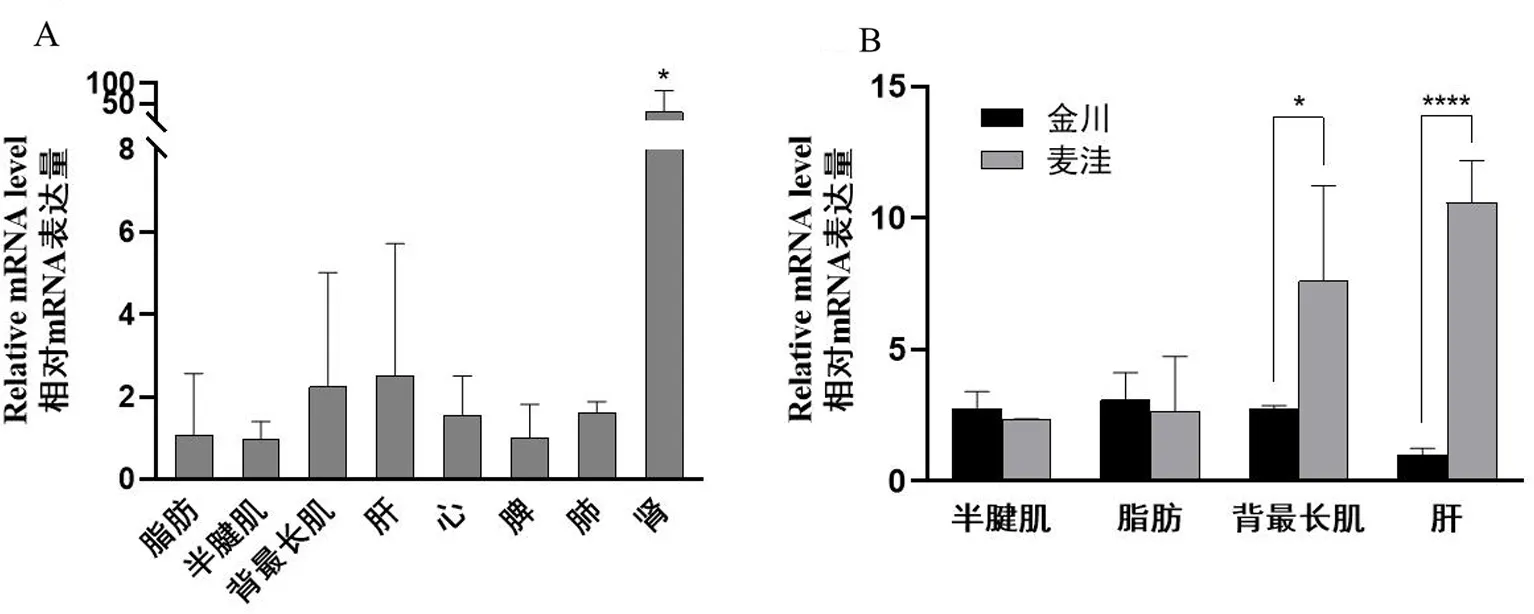
图6 牦牛UCP1基因的组织表达分析
3 讨论
UCP1属于解偶联蛋白家族成员,可以激活线粒体的解偶联呼吸而产生热量(非颤栗产热),维持动物体温的恒定[22].在模式动物中,关于UCP1基因的功能研究较为深入,但对于UCP1基因在牦牛上的研究目前尚未见报道.此次试验以牦牛皮下脂肪CDNA为模板,利用PCR克隆获得UCP1基因的全长954 bp,ORF全长为942 bp,编码313个氨基酸.生物信息学预测得到,牦牛UCP1蛋白为一种不稳定疏水性蛋白,具有跨膜结构域及多个磷酸化位点.与前人研究结果一致,UCP1已经证实有6个疏水区存在跨膜结构[23].UCP1蛋白的二级结构主要由α螺旋,无规卷曲以及少数延伸链组成.同源比较发现牦牛UCP1基因与普通牛的同源性最高,虽与其他物种之间也有一定的同源性,但同源性较低,因此推测UCP1基因在不同物种间可能具有特异性.
之前大多数研究UCP1基因主要集中在脂肪组织中表达,最近的研究发现UCP1在小鼠的胸腺中也有表达[24].孙国权等研究发现,UCP1基因在肉牛的睾丸、肾、肋间肉、心、胰、背膘、肩肉、肝、网脂、肠脂、脾、肺、背最长肌和淋巴等很多组织中均有表达,但在背膘中的表达高于其他组织,并认为UCP1与产热和维持体温有关[25].在绵羊研究中发现UCP1在肾周脂肪中的基因表达明显高于其他组织,而浅表脂肪中的基因表达低于深层脂肪,在2月龄绵羊肾周围脂肪组织中的mRNA表达量最高,然后随着年龄的增加呈现下降趋势[26].在本研究中我们发现,UCP1基因在牦牛心、脾、肺、肾、脂肪、肝、背最长肌和半腱肌中均有表达,在肾中的表达量最高,并且肾与其他组织之间差异显著(P<0.05),这可能是由于UCP1参与肾小管上皮细胞的氧化应激.研究报道UCP1位于肾脏的肾小管上皮细胞,在肾间质纤维化过程中呈时间依赖性下调.UCP1的缺失会增加小鼠肾脏的氧化应激,UCP1过表达会减少缺氧处理的肾小管上皮细胞中线粒体活性氧(Reactive oxygen species, ROS)的产生和凋亡,并且小鼠肾脏中过氧化物酶体增殖物激活物受体PPARγ调节会影响UCP1的表达[27].因此推测这种表达模式可能是因为UCP1参与肾的抗氧化功能,关于UCP1在牦牛肾脏中的具体功能还需进一步的探究.
目前在牦牛中已有UCP3被克隆[28],并有研究发现解偶联蛋白家族中的UCP2和UCP3基因可作为家畜胴体生长与肉质性状的候选基因[29].在牛中,UCP1基因在骨骼肌中的表达显著低于棕色脂肪组织,并且定位研究发现UCP1蛋白在骨骼肌中高表达,但在骨骼肌中的肌内脂肪细胞未检测到[30].在绵羊的多态性检测研究中发现,UCP1基因内含子5区和外显子6区共有8个核苷酸突变,内含子5区变异对绵羊的生长速度存在性别差异,同时对胴体性状具有一定影响.含有等位基因C1的公羔群体较其他群体有更高的断尾重,缺失等位基因A1的母羔群体具有更高的初生重[31].之前有研究表明金川牦牛肉肌肉剪切力低,肉质相对于麦洼牦牛较细嫩,并且肌内脂肪含量较高[32],因此我们比较研究了金川牦牛和麦洼牦牛肌肉中UCP1基因表达的差异,发现UCP1基因在麦洼牦牛背最长肌中的表达量显著高于金川牦牛,推测UCP1基因的表达水平可能与牦牛肌内脂肪沉积有关.
本研究发现UCP1基因在麦洼牦牛肝中的表达量极显著高于金川牦牛(P<0.0001).之前有研究布氏田鼠在低温驯化过程中,肝脏在细胞水平上的呼吸酶活性及蛋白质合成等方面均被激活,表明寒冷环境会促使肝脏代谢活力提高[33].由于麦洼牦牛长期生活的环境与金川牦牛相比海拔较高,温度相对更低,可以推测肝脏基因表达和代谢状态与环境温度有关.在低温环境中,为了满足机体对ATP 的需求,同时通过产热维持体温恒定,肝脏呼吸速率显著增强[34].研究表明脂肪酸激活UCP1解偶联生热,肝脏对脂肪酸的生成和代谢具有重要作用[35-36].在小鼠急性肝损伤后,UCP1蛋白表达减少、活化能力降低,导致棕色脂肪组织功能下降,机体产热减少,从而影响代谢的稳态[37].这进一步说明UCP1基因表达与肝脏的代谢密不可分.
本实验克隆了牦牛UCP1基因并分析其生物学特性,研究了UCP1基因在牦牛各个组织中的表达,推测UCP1可能参与牦牛高原适应性的调节,但对于UCP1参与介导牦牛骨骼肌的能量代谢以及在冷刺激下调控肝脏代谢的作用还需进一步的研究.
4 结论
本试验成功克隆出牦牛UCP1基因全长序列,全长为954 bp(GenBank No. MW345537),ORF全长为942 bp,共编码313个氨基酸.生物学信息分析得到,UCP1蛋白为一种不稳定疏水性蛋白.同源分析表明,牦牛UCP1基因与普通牛UCP1基因的同源性高.通过UCP1基因在牦牛不同组织的表达分析得到,UCP1在牦牛心、肝、脾等各个组织中均有表达,在牦牛肾中的表达量显著高于其他组织.并且UCP1基因在麦洼牦牛背最长肌以及肝中的表达量显著高于金川牦牛.以上研究结果为UCP1蛋白在牦牛的功能研究奠定了基础.
