基于cytb基因分析建昌马和安宁果下马的遗传多样性和起源进化
2022-01-17黄卫平金素钰饶开晴郑玉才
刘 敏,黄卫平,金素钰,黄 林,饶开晴,郑玉才
(1.西南民族大学畜牧兽医学院,四川 成都 610041;2.四川省凉山州畜牧科学研究所,四川 西昌 615042)
马(Equuscaballus)作为最早被驯化的动物之一,在古代农业、军事和交通运输等方面有不可或缺的作用,而目前主要用于马术运动、观赏等方面.建昌马原产于中国四川省凉山州,体型较小,是西南小型山地马的代表品种,有学者认为其是古羌人南下安宁河一带时带来的青海马,曾用于日常生活和军事.同样分布在四川省凉山州的安宁果下马是20世纪80年代在安宁河谷附近发现的体高在100 cm以下的马品种[1].关于安宁果下马的起源存在着两种观点:一是认为安宁果下马是古代果下马在相对封闭的环境中的孑遗小群,二是认为它是当地的建昌马受到环境影响而矮化的结果,但迄今未有定论.
在开展家畜的遗传育种改良工作中,家畜的起源进化研究非常重要,其中线粒体DNA(mtDNA)和Y染色体遗传标记分别是分析哺乳动物母系起源和父系起源的重要分子标记.在哺乳动物中,mtDNA是雌性动物传递给下一代的遗传物质,它主要包括编码区和非编码区,编码区由13个蛋白质编码基因、22个tRNA基因和2个rRNA基因组成,其中细胞色素b(cytb)基因的结构与功能最清楚.cytb基因序列相对保守,进化速率适中,在一定进化尺度内不受饱和效应的影响,在核苷酸组成上有偏好性,具有种间的差异,适合分析种间或种内的差异,因此被作为分子遗传标记广泛应用于物种的起源进化研究[2]和种群遗传结构的分析[3].目前的研究均表明家马mtDNA具有丰富的遗传多样性并显示多母系起源[4-5],而家马的父系遗传多样性低[6-7].从相关文献分析来看,家马的mtDNA D-loop区和cytb基因都具有丰富的遗传多样性,在考古学与现代分子生物学的结合下,Cai等[8]分析了来自河南、山东、内蒙古等7个遗址的古代马样本的mtDNA的多态性,发现中国古代马在中国现代马的7个单倍群中均有分布,且母系遗传具有高度的多样性,此外还发现现代的蒙古马与中国古代马亲缘关系近.
为更加清晰地阐述建昌马的系统进化,Ling等[9]、周凡莉等[10]和刘敏等[11]分别对建昌马的mtDNA D-loop区和Y染色体遗传标记进行研究,发现相对于建昌马的mtDNA D-loop高变区丰富的遗传多样性并有多个母系起源,其Y染色体遗传多样性低且父系起源少;此外,杨乐等[12]对4匹安宁果下马的mtDNA D-loop区序列初步分析,发现安宁果下马的D-loop区也具有丰富的多态性,但并未对其进行进化分析.本研究以建昌马和安宁果下马的cytb基因作为研究切入点,通过PCR扩增两个品种cytb基因的全序列并直接测序,为阐明建昌马和安宁果下马的分子遗传特征、系统进化等提供资料.
1 材料与方法
1.1 试验动物及样品的采集
本研究的试验动物建昌马(n=40;21公,19母)和安宁果下马(n=4;2公,2母)饲养于四川省凉山州西昌市近郊,均为成年健康马匹,个体间无亲缘关系.
通过颈静脉采血于含EDTA的一次性抗凝管中,置于冰盒内尽快运回实验室,分装后于-80 ℃保存.
1.2 主要仪器和试剂
主要仪器:Eppendorf Minispin plus微型离心机,Bio-Rad C1000梯度PCR仪,Bio-Rad VersaDoc 1000凝胶成像系统,Bio-Rad POWER/PAC 3000电泳仪,Biochrom WPA Biowave核酸蛋白检测仪.
主要试剂:QIAGEN DNeasy Blood& Tissue Kit,Golden Star T6 Super PCR Mix,Solarbio GoldView Ⅰ型核酸染色剂,天根DL-2000 Marker.
1.3 马基因组DNA的提取
采用QIAGEN公司的DNeasy Blood& Tissue Kit从建昌马和安宁果下马的抗凝全血中提取基因组DNA,用核酸蛋白检测仪检测DNA的纯度和浓度,置于-20 ℃冰箱保存.
1.4 PCR引物的设计和合成
本研究参考安丽萍[13]设计的引物:F: 5′-TGGAATCTAACCACGACCAA-3′,R: 5′-TAGGGGAAGAAATCAAGGAA-3′,扩增产物长度约1370 bp,包括cytb基因全序列.引物由生工生物工程(上海)股份有限公司合成.
1.5 马cytb基因的PCR扩增和测序
以建昌马和安宁果下马基因组DNA为模板扩增cytb基因全序列,PCR扩增体系为25 μL:2 μL基因组DNA,上、下游引物各1 μL,21 μL Golden Star T6 Super PCR Mix;扩增程序:94 ℃预变性4 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸3 min,共35个循环;72 ℃延伸10 min;4 ℃保存.
PCR产物用2%的琼脂糖凝胶电泳检测,将单一、清晰的目的条带送生工生物工程(上海)股份有限公司进行双向测序.
1.6 数据统计
通过DNAMAN 5.2.2软件对PCR产物测序结果进行拼接,得到完整的cytb基因序列,用MEGA 7.0.26软件统计分析cytb基因序列的碱基组成,利用DnaSP 5.10.01软件统计cytb基因的变异位点、单倍型数、单倍型多样性(Hd)、核苷酸多样性(Pi)、平均核苷酸变异数(K)和Tajima’s D值.将获得的单倍型用MEGA 7.0.26软件进行系统进化分析.引用NCBI中的21个马品种的cytb基因序列(表1)通过MEGA软件以Kimura双参数法计算各品种间的遗传距离并进行系统进化分析,用NETWORK 10.1.0.0软件对上述21个及本试验的2个马品种的cytb基因进行网络单倍型聚类分析.
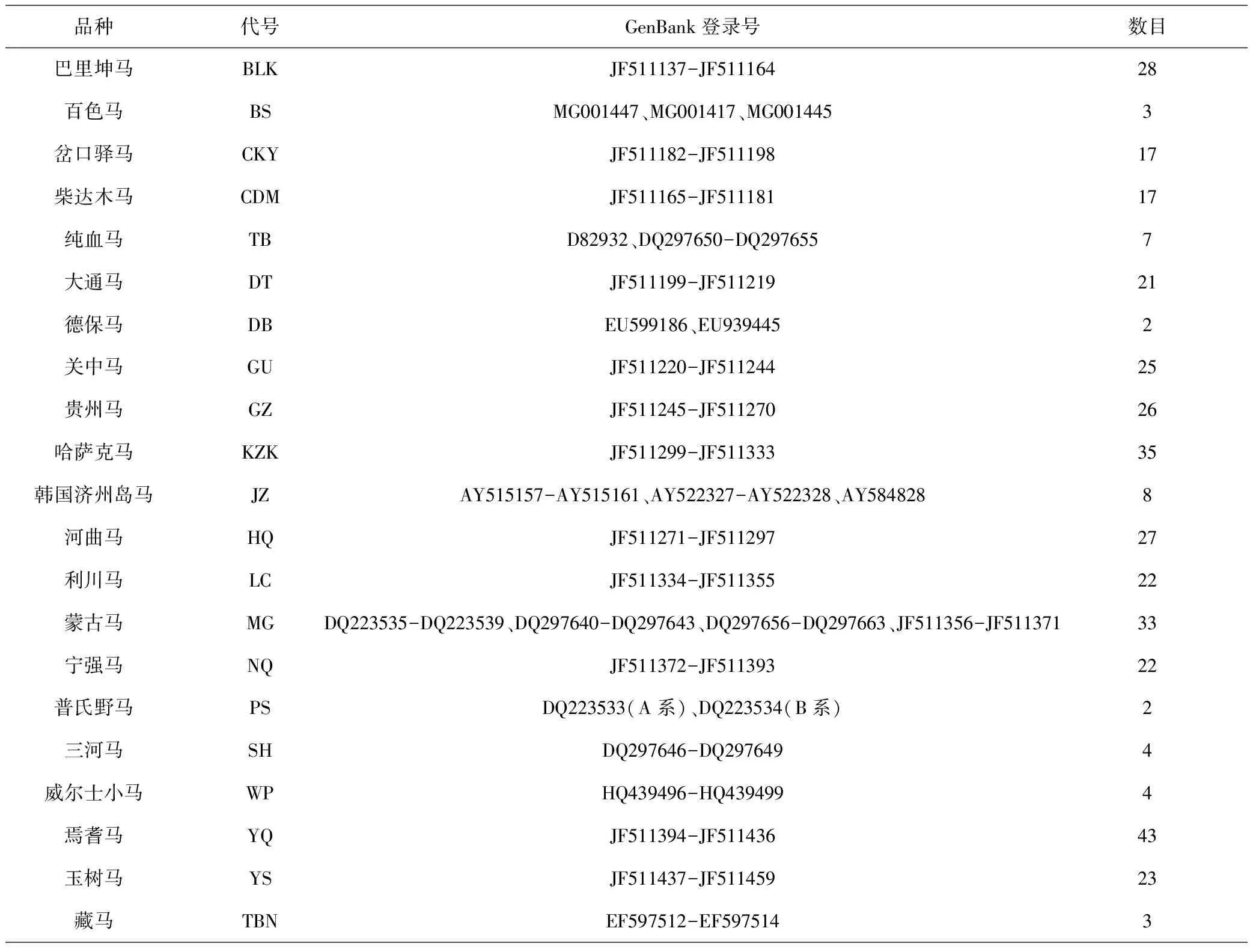
表1 21个品种马的cytb基因参考序列信息
2 结果
2.1 建昌马和安宁果下马cytb基因的PCR扩增结果
通过2%的琼脂糖凝胶电泳检测两个马品种的cytb基因PCR扩增产物(图1),图中的特异性条带大小在1 000 bp和2 000 bp之间,条带清晰,与预期产物大小相符,可用于后续的直接测序.
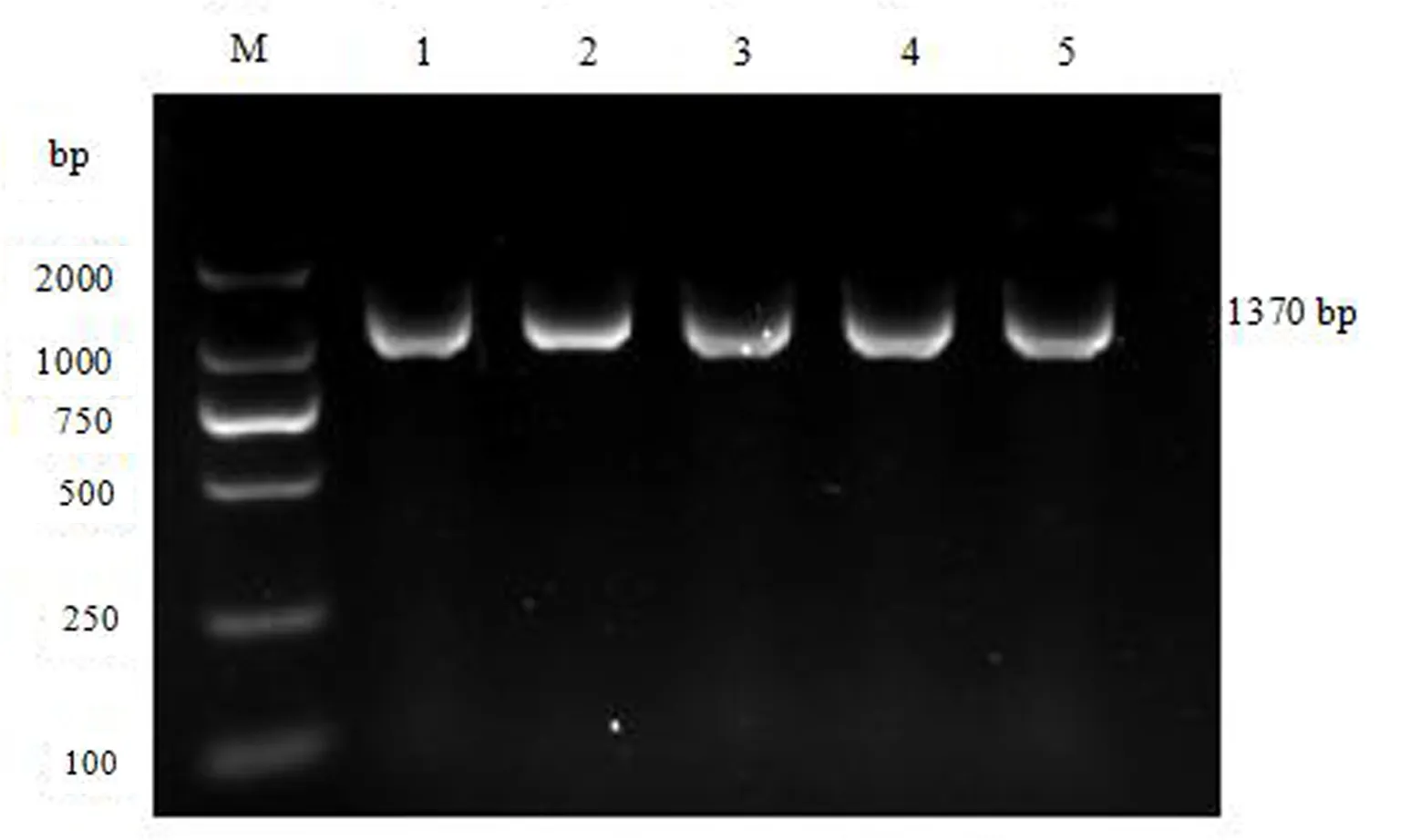
图1 马cytb基因PCR扩增结果
2.2 建昌马和安宁果下马cytb基因遗传多样性分析
对40匹建昌马和4匹安宁果下马的44个PCR产物测序结果进行拼接,得到的cytb序列大小均为1 140 bp,未发现碱基的插入或缺失.共检测到20种单倍型,每种单倍型碱基组成相差甚微(表2),平均核苷酸组成的比例从大到小依次排列为C(32.2%)>A(28.1%)>T(U)(26.5%)>G(13.2%),C+G的比例为45.4%.在密码子的第一位~第三位含量最高的分别为:A(29.0%)、T(42%)、C(44.4%).

表2 马cytb基因20个单倍型平均核苷酸组成(%)
通过DnaSP 5.10.01软件分析44匹试验马的cytb基因序列,检测到45个变异位点(表3),约占全序列的3.95%,其中28个为简约信息位点,17个为单一变异位点.45个变异位点中7个位点为颠换,其它均为转换.有5个变异位点导致氨基酸的变化(表4),其它均为同义突变.

表3 两个马品种的cytb基因单倍型变异位点

表4 Ctyb的氨基酸变化
23个马品种的单倍型多样性(Hd)、核苷酸多样性(Pi)、平均核苷酸变异数(K)和Tajima’s D值的比较见表5.本研究中建昌马和安宁果下马中共存在20个单倍型,其中7个为共享单倍型(H1、H6、H7、H8、H9、H11和H12),13个为单一单倍型(仅1匹马),H1是最主要的单倍型(13匹马).40匹建昌马分布在H1-H19的19个单倍型中,4匹安宁果下马分别分布在单倍型H1、H6、H12和H20中,安宁果下马存在一个特有的单倍型H20.通过计算得到建昌马和安宁果下马的Tajima’s D值分别为-1.59086和-0.15360,差异均不显著,属于中性突变.

表5 23个马品种cytb基因的遗传多样性
2.3 建昌马和安宁果下马的遗传进化分析
将确定的建昌马和安宁果下马20种单倍型采用Kimura-2模型,以邻接法(Neighbor-Joining)构建系统发育树(图2),显示为两大支和7小支,单倍型最多的是包含7个单倍型的A支系,最少的是H8单独形成的C支系.安宁果下马的单倍型分布于A、F和G支系中,其特有的单倍型H20分布于A支系.
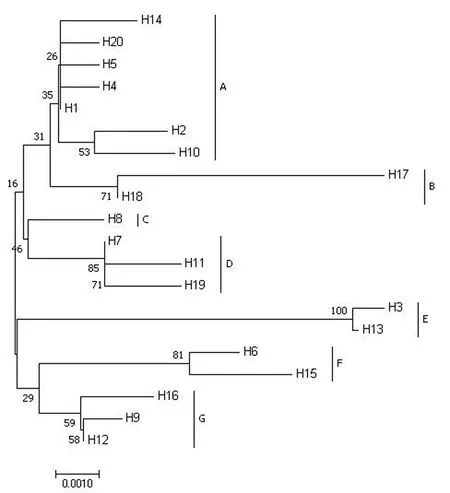
图2 建昌马和安宁果下马20个单倍型的系统进化树Fig. 2 Phylogenetic tree of 20 haplotypes in Jianchang horse and Anning pony
基于Kimura双参数法计算23个马品种之间的平均遗传距离(表6),数值在0.0023~0.0069之间,宁强马与柴达木马的遗传距离最小(0.0023),纯血马与普氏野马的遗传距离最大(0.0069).建昌马和安宁果下马与柴达木马遗传距离均最小(分别为0.0036、0.0029),二者与普氏野马的遗传距离均最大(分别为0.0062、0.0055).建昌马与安宁果下马的遗传距离为0.0043.

表6 23个品种马cytb基因的遗传距离
基于品种间遗传距离构建NJ系统进化树(图3).23个马品种分成了7大支,建昌马与利川马、蒙古马、安宁果下马、藏马、焉耆马和关中马聚为一大支.

图3 基于23个马品种遗传距离构建的NJ系统进化树
对23个品种马的416条cytb序列分析发现共存在100个单倍型,其中Hap1单倍型占优势(20.19%),其次是Hap2(12.74%)、Hap3(7.69%)和Hap15(6.97%),且这几个单倍型都存在建昌马的个体;Hap71-Hap78共8个单倍型是建昌马特有的单倍型.安宁果下马特有的单倍型H20与3匹巴里坤马、1匹贵州马、3匹哈萨克马、3匹威尔士小马、1匹蒙古马和1匹纯血马共同形成单倍型Hap4.通过NETWORK 10.1.0.0软件对23个马品种的cytb基因序列构建Median Joining网络聚类图(图4),其中Hap1是主要单倍型.单倍型分布以Hap1为中心,以星状向外扩散使家马分布在7个不同的单倍群里(A-G),提示不同的单倍群对家马的起源有贡献,进一步证明家马有多个母系起源.
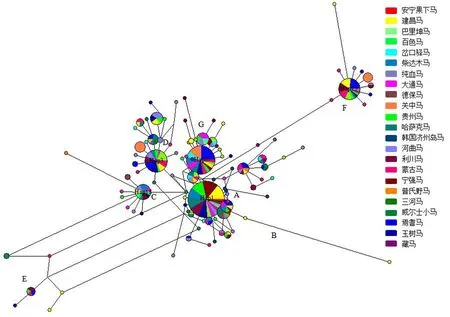
图4 23个品种cytb基因的网络聚类图
3 讨论
3.1 建昌马和安宁果下马cytb基因多态性
mtDNA是哺乳动物唯一的核外遗传物质,具有进化速度快、无组织特异性、遵循母系遗传、在种间和种内都有丰富的遗传多样性的特点.研究发现,与mtDNA D-loop区的变异速度快相比,cytb基因的变异速度适中,可作为研究物种间遗传进化[14]的合适标记.
遗传多样性是群体内不同个体的变异总和,是生物多样性的重要组成部分,而单倍型多样性和核苷酸多样性是衡量一个群体变异程度的重要指标,也能反映出群体对环境的适应能力.本研究在44匹马的cytb基因中发现45个变异位点,无插入缺失,大部分为转换,A+T含量高于C+G,具有一定的偏倚性,符合cytb基因进化的特点.在40匹建昌马和4匹安宁果下马中分别鉴定出19个和4个单倍型,其中7个为共享单倍型.在西南马系统中,建昌马的单倍型多样性(0.894)和核苷酸多样性(0.00499)处于一个较高的水平,说明建昌马具有较大的群体多态性,而相对于巴里坤马、蒙古马、大通马和哈萨克马略低,提示中国家马北方品种cytb基因多样性高于南方品种.总体而言,从单倍型多样性和核苷酸多样性来看,建昌马和安宁果下马都具有丰富的遗传多样性.
3.2 建昌马和安宁果下马母系遗传进化分析
对关中马、贵州马、哈萨克马和矮马等品种cytb基因[15-16]分析发现,它们都是多母系起源,与mtDNA D-loop区[17-18]的分析结果一致.本研究以两个品种cytb基因界定的20个单倍型构建系统发育树,可将20个单倍型分布在7个支系中,其中A支系存在7种单倍型共19条序列,约占总样品数的43.18%,安宁果下马特有的单倍型H20也在A支系中.通过分析建昌马和安宁果下马与其他21个品种的遗传距离发现,建昌马与青海马类群(柴达木马、玉树马)和西南马类群(宁强马和安宁果下马)的遗传距离较小.与大通马的遗传距离较近可能是由于大通马在西南山地马的改良工作中有重要作用有关;建昌马与柴达木马的遗传距离最小(0.0036),提示建昌马和柴达木马亲缘关系近,在体型上柴达木马和建昌马都是体型较小的马品种,同属于山地马种,推测建昌马在进化过程中受到青海马的影响,或许有共同的母系起源,这可能与西南马来源于青海马有关[19].建昌马与安宁果下马的遗传距离为0.0043,处于一个较近的亲缘关系范围,这与周凡莉等[10]对建昌马的mtDNA D-loop区研究结果相似;不同的是,本研究发现建昌马与关中马的遗传距离相对较大,而周凡莉等[10]在建昌马mtDNA D-loop区的结果表明建昌马与关中马遗传距离最小,这或许与分析时选择的关中马mtDNA D-loop参考序列的数量有关.
23个马品种cytb序列的网络聚类图显示,100个单倍型分别以Hap1、Hap2、Hap3、Hap15和Hap18为中心发散形成不同的单倍群,建昌马分布在A-G共7个单倍群中,与单倍型系统进化树结果一致,提示建昌马有多个母系起源,其中B单倍群只包含建昌马的两个单倍型,也是建昌马特有的单倍型,而安宁果下马只分布在A、F和G三个单倍群中,这可能与试验的样品数少有关.A单倍群在整个分布中占主要部分,是家马广泛存在的类型,除B单倍群外,其余单倍群都由不同品种的马构成,提示不同品种的马之间存在基因交流.本研究出现1匹建昌马的cytb序列与NCBI中1匹普氏野马(DQ223534)的序列完全相同,此外,在河曲马、利川马、焉耆马和蒙古马中也有相同发现,这使建昌马和上述马与普氏野马共同分布在A单倍群中;除个别参考序列少的品种,其他品种均拥有Hap1单倍型,推测Hap1可能是家马古老的单倍型.综上,建昌马和安宁果下马均具有多个母系起源,二者可能有较近的亲缘关系.
4 结论
建昌马和安宁果下马mtDNAcytb基因具有丰富的遗传多样性,且建昌马有多个母系起源.通过不同品种间遗传距离分析发现建昌马与柴达木马的亲缘关系最近,与安宁果下马的亲缘关系较近;从母系角度分析,推测建昌马与柴达木马有共同的母系起源.
