利用宏基因组学分析壬基酚对剩余污泥厌氧发酵产酸的影响
2022-01-16冯雷雨陈银广
段 旭,冯雷雨,周 琪,陈银广
(同济大学环境科学与工程学院,上海200092)
污泥处理是我国水污染防治行业的重点,同时也是污水处理的短板[1]。厌氧发酵兼具废物减量和资源回收的双重优势,成为我国优先推荐的污泥处理技术。其中,厌氧发酵产酸因可获得用于脱氮除磷、产油、产电、产可降解塑料的短链脂肪酸(SCFAs)而逐渐成为备受关注的发酵方式[2-5]。
部分工业废水携带持久性有机污染物进入城市污水处理厂[6],这些有机污染物如壬基酚(NP)、多环芳烃(PAHs)等在污水处理过程中被吸附并积累于污泥上[7-8]。NP为一种可模仿人体内雌激素作用并具内分泌干扰性质的有机污染物,毒性较高且难以降解,早在2000年便被指定为优先控制污染物[9]。NP在剩余污泥中的含量可高达上千mg·kg-1干污泥[10-12]。剩余污泥中大量持久性有机污染物为污泥厌氧发酵产酸过程增加了不确定性。
污泥厌氧发酵是各司其职的微生物利用复杂底物通过一系列反应最终生成所需产物的微生物发酵过程[13]。采用基因组学等分子生物学手段研究NP对污泥厌氧发酵的影响可在微生物种群结构和功能方面深度理解污泥厌氧发酵影响机理。研究了NP对污泥厌氧发酵产酸的影响,在此基础上,利用宏基因组学技术,从有机物转化、信号转导和物质转运方面揭示NP对污泥厌氧产酸的影响机制。
1 实验材料和方法
1.1 实验材料
实验所用剩余污泥取自上海市某污水处理厂的回流污泥泵房。实验过程中,先将取回的新鲜剩余污泥于4℃下沉降24 h,弃去上清液,再经2.0 mm×2.0 mm筛过滤去除其中的大颗粒杂质。沉降过筛后污泥的主要性质如表1所示。

表1 剩余污泥性质Tab.1 Characteristics of waste activated sludge
实验所用NP(正壬基酚,纯度为98%)购置于阿达玛斯试剂公司(上海),将NP溶解于甲醇(色谱级)中配制成1 000 mg·L-1的储备液,在棕色试剂瓶中4℃避光保存并待用。
1.2 实验装置与运行
NP影响污泥厌氧发酵实验的原料为NP储备污泥,具体制备过程如下:在相同规格的6个5 L玻璃瓶中加入相同体积的浓缩沉淀后剩余污泥,向各瓶中加入不同体积的NP储备液,并用甲醇补足NP储备液加入后的体积差,使得各瓶中NP含量分别为0、50、100、200、500、1 000 mg·kg-1干污泥。将污泥与NP混合体系置于机械搅拌器上以150 rpm的转速搅拌24 h,使NP均匀吸附于污泥之上,然后在4℃下保存备用。
污泥厌氧发酵产酸反应器为规格相同的600 mL血清瓶,瓶中分别加入NP含量为0、50、100、200、500、1 000 mg·kg-1干污泥的储备污泥240 mL,控制厌氧发酵产酸系统中的pH值为10.0。氮气吹扫2 min以排出瓶中氧气保证厌氧条件,用橡胶塞密封后,将血清瓶置于恒温空气摇床中,于150 rpm、(35±1)℃条件下振荡反应。反应过程中,每日从厌氧产酸反应器中排出30 mL发酵液,并补充相同体积的新鲜储备污泥,控制产酸反应器中的污泥停留时间为8 d。反应器长期运行,每隔2 d取样测定反应器中的SCFAs产量,待SCFAs产量基本稳定后(20 d)取污泥样品进行宏基因组测序分析,每一实验条件下设置3组平行实验。
1.3 测试指标与方法
TSS、VSS、COD的检测依据《水和废水分析检测方法》[14-15];蛋白质含量采用Folin-酚试剂法进行测定;多糖采用蒽酮比色法测定;采用索式提取法提取脂类,仪器为FOSS全自动索氏抽仪(Soxtec 2050);采用岛津GC-2014型气相色谱仪测定SCFAs,毛细管色谱柱型号为DB-WAXETR(30 m×530μm×1.0μm),氮气体积流量为30 mL·min-1,空气体积流量为400 mL·min-1。
1.4 宏基因组测序
利用E.Z.N.A.®Soil DNA Kit(Omega Biotek,美国)试剂盒、TBS-380、NanoDrop200、1%琼脂糖凝胶电泳进行样品DNA抽提以及浓度、纯度、完整性检测。将DNA片段化,筛选约400 bp的片段用于构建宏基因组文库。使用NEXTFLEX®Rapid DNA-Seq(Bioo Scientific,美国)建库,构建完成后进行桥式聚合酶链反应和测序,宏基因组测序使用Illumina NovaSeq/Hiseq Xten(Illumina,美国)测序平台,使用软件SeqPrep(https://github.com/jstjohn/SeqPrep)对reads 3’端和5’端的adapter序列进行质量 剪 切;使 用 软 件Sickle(https://github.com/najoshi/sickle)去除剪切后长度小于50 bp、平均碱基质量值低于20以及含N碱基的reads,保留高质量的pair-end reads和single-end reads;使用基于succinct de Bruijn graphs原理的拼接软件MEGAHIT(https://github.com/voutcn/megahit)对优化序列进行拼接组装。在拼接结果中筛选≥300 bp的contigs作为最终的组装结果。使用MetaGene(http://metagene.cb.k.u-tokyo.ac.jp/)对拼接结果中的contigs进行开放阅读框预测。选择核酸长度≥100 bp的基因,并将其翻译为氨基酸序列。使用SOAPaligner软件(http://soap.genomics.org.cn/)分别将每个样品的高质量reads与非冗余基因集进行比对(95%identity),统计基因在对应样品中的丰度信息,在此基础上进行物种与功能注释。
2 结果与讨论
2.1 NP对污泥厌氧发酵反应器产酸性能的影响
污泥厌氧产酸发酵反应器运行约20 d后进入稳定期,稳定后反应器中SCFAs产量随NP含量变化如图1a所示。在NP含量范围内(0~1 000 mg·kg-1干污泥),实验组产酸量较之于空白组整体表现为促进作用,但促进程度不同。随NP含量的升高,SCFAs产量呈现先升高后降低的趋势,在0、50、100、200、500、1 000 mg·kg-1干污泥NP反应器中的SCFAs积累量分别为2 856、3 687、4 575、5 620、4 867、4 013 mg COD·L-1。当NP含量为200 mg·kg-1干污泥时,SCFAs积累量达到最大值,约为空白组SCFAs积累量的2倍。作为雌激素类物质,NP对生物细胞、组织和器官的影响多有报道,通常呈现剂量效应关系。如低剂量NP可促进小鼠子宫和土壤白符跳的生长,NP剂量进一步提高后其毒性增强[16-17]。与NP影响生物的规律类似,其对产酸过程的影响同样与含量相关,低含量NP对发酵产酸具有较高的促进作用,随NP含量的提高促进作用降低。
进一步分析发酵系统中SCFAs的组成(见图1b,图中数值为反应器运行稳定后长期所测得的各SCFA的平均浓度)发现,乙酸、丙酸和异戊酸为3种主要SCFA,尤其是乙酸,占到总SCFAs浓度的50%。随NP含量的改变,乙酸在不同NP反应器中的浓度较之于空白组发生了不同程度的变化,而丙酸、丁酸和戊酸浓度并无显著差异。空白反应器中,乙酸浓度为1 310 mg COD·L-1,NP含量为200 mg·kg-1干污泥时,乙酸浓度提高为3 790 mg COD·L-1,约为空白反应器的3倍。经计算,乙酸浓度较之于空白反应器的提高量为2 480 mg COD·L-1,SCFAs浓度较之于空白反应器的提高量为2 764 mg COD·L-1。因此,NP反应器中SCFAs浓度的提高主要来自于乙酸浓度的提高。

图1 SCFAs浓度及组成随NP含量的变化Fig.1 Change of SCFAs concentration and composition with different NP contents
综上,NP促进污泥厌氧发酵产酸,促进作用随NP浓度的提高先增后减;NP含量为200 mg·kg-1干污泥时,SCFAs浓度达最大值,为空白反应器的2倍之多;NP反应器中SCFAs浓度的提高主要归因于乙酸浓度的提高。为深入探讨NP影响污泥厌氧产酸发酵的机理,下文将选取空白反应器和NP含量为200 mg·kg-1干污泥的反应器(下文统称NP反应器)进行宏基因组测序分析。
2.2 NP对污泥厌氧发酵产酸微生物种群结构的影响
污泥厌氧发酵产酸由多种功能微生物协同完成,因此研究该系统中微生物种群结构的变化对于揭示NP影响污泥发酵产酸的机理极为必要。由图2a可知,在域分类学水平上,空白和NP反应器中细菌相对丰度分别为95.15%、98.81%,古菌相对丰度分别为4.35%、0.66%。值得一提的是,水解酸化菌属于细菌,而消耗乙酸的产甲烷菌属于古菌。因此,NP反应器中产酸量的提高可能与该反应器中细菌丰度的提高和古菌丰度的降低有关。
在门分类水平上,由图2b可知,空白和NP反应器中检测到的主要微生物为Firmicutes(厚壁菌门)、Bacteroidetes(拟杆菌门)、Proteobacteria(变形菌门)、Chloroflexi(绿弯菌门)和Actinobacteria(放线菌门)。隶属Firmicutes的微生物具有降解复杂有机物、蛋白质、脂质的能力,在空白和NP反应器中的相对丰度分别为58.52%和50.79%。对Firmicutes组成进一步分析发现,该门在NP存在下丰度降低的属为产乙醇食蛋白菌(Proteiniborus ethanoligenes),其为消耗底物大量产生醇类物质的微生物属[18]。Bacteroidetes通常具有水解发酵大分子有机物,使之生成乙酸及H2、CO2气体的功能[19-20],其在NP反应器中的相对丰度为25.18%,显著高于空白反应器(14.28%)。Proteobacteria能以葡萄糖、丙酸、丁酸和乙酸为底物,为耗乙酸菌[21],其在空白和NP反应器中的相对丰度无显著差异(10.74%和10.33%)。Chloroflexi在空白反应器中的相对丰度为6.58%,高于其在NP反应器中的数量(5.53%),该菌与产甲烷菌互营生长,主要在发酵产甲烷过程中发挥作用[22]。Actinobacteria可代谢产生抗生素,大量存在会抑制其他产酸菌的生长和代谢,其在空白和NP反应器中的相对丰度分别为2.70%和2.32%[23]。以上分析表明,NP直接或间接地使消耗乙酸的细菌数量有所削减,产乙酸菌数量增加,即NP存在使微生物种群结构向有利于污泥厌氧发酵产酸的方向进行。

图2 域和门水平微生物种群结构Fig.2 Microbial community structure at domain and phylum level
2.3 NP对厌氧发酵产酸微生物功能的影响
NP对微生物种群结构有显著影响,而这些微生物在污泥厌氧发酵过程中执掌不同功能,分工合作最终产生了SCFAs,了解NP作用下发酵系统中微生物的功能可进一步揭示NP影响污泥发酵产酸的机理。以宏基因组测序技术为手段,基于京都基因与基因组百科全书(KEGG)数据库进行注释和分析,与空白反应器相比,NP反应器中显著提高的微生物功能主要包括3类(见图3):①有机物降解及乙酸生成,与单糖、氨基酸降解及乙酸生成相关的代谢,如缬氨酸、亮氨酸和异亮氨酸降解以及脂肪酸降解;②物质运输,与腺嘌呤核苷三磷酸(ATP)水解和有机物主动运输相关的ABC转运蛋白;③信号转导,与细菌间信息交流相关的群体感应和与细菌感知、响应和适应环境以及细胞状态变化相关的双组分信号转导系统。
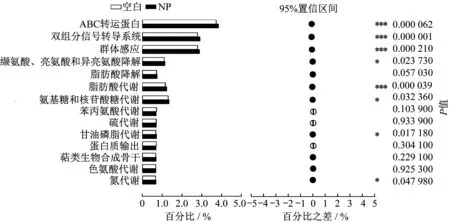
图3 Level 3水平代谢通路相对丰度Fig.3 Relative abundance of pathway on Level 3 level
(1)有机底物降解及乙酸的生成
厌氧发酵产生的乙酸由葡萄糖、氨基酸和脂肪酸等物质转化而来。涉及的主要代谢途径为以葡萄糖为底物的糖酵解、以氨基酸为底物的脱氨基作用(氨基酸代谢)和以脂肪酸为底物的β氧化。糖酵解是将葡萄糖转化为丙酮酸并产生少量ATP(能量)和还原型辅酶I(还原力)的过程,是产生重要前体代谢产物丙酮酸的主要途径[24]。生成的丙酮酸经丙酮酸代谢过程转化为乙酸。除葡萄糖外,氨基酸也可经转氨基或脱氨基等生化反应转化为丙酮酸。例如,丙氨酸在氨基转移酶(基因:GPT、alaA、AGXT2和AGXT)的作用下转化为丙酮酸,天冬氨酸在天冬氨酸脱羧酶(基因:asdA)催化下可先转化为丙氨酸后经由丙氨酸形成丙酮酸。脂肪水解为脂肪酸后,脂肪酸经β氧化逐级变为比上一级少2个碳原子的脂肪酸,最终形成SCFAs。由图4可知,NP存在下有机底物降解过程涉及的主要相关功能基因,包括pgm、pgi、pfk、fba、gap、pyk等(虚线箭头标记途径上的所有基因),其相对丰度较之于空白反应器大幅提高。

图4 有机物降解及乙酸生成途径相关功能基因及其相对丰度Fig.4 Functional genes related with organic substrates degradation and acetic acid production and their relative abundances
(2)物质运输
ABC转运蛋白将ATP水解与离子、糖、蛋白质、肽、氨基酸、脂质、固醇等底物主动运输结合[25]。其中,向内转运蛋白可将底物和营养物质从外界环境转移至细胞内,而向外转运蛋白则可将不利于细胞生长的脂肪酸、抗生素等物质排出至细胞外,将细胞内非必需的外源物质和次级代谢产物保持在较低的浓度[26]。NP存在下,与氨基酸(谷氨酸、天冬氨酸、精氨酸、赖氨酸和甲硫氨酸)和单糖(木糖、鼠李糖、阿拉伯糖和核糖等)运输相关的ABC转运蛋白功能基因相对丰度较之于空白组均有不同程度的提高(>10%)。此外,游离脂肪酸在细胞内的大量积累将对细胞膜的完整性和细胞生长产生不利影响,NP反应器中,与短链脂肪酸外排相关的ABC转运蛋白功能基因acrB在NP存在下的相对丰度为空白组的1.1倍,即NP促进了游离脂肪酸的外排功能。各功能基因在空白和NP反应器中的相对丰度如图5所示。
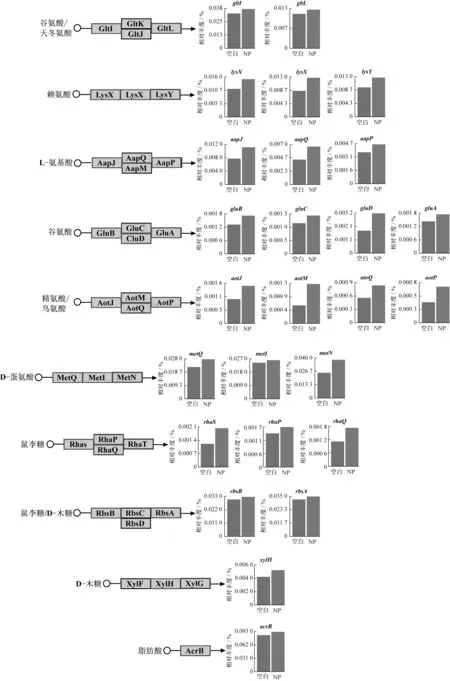
图5 ABC转运蛋白功能基因及其相对丰度Fig.5 Functional genes related with ABC transporter and their relative abundances
(3)信号转导
双组分信号转导系统是细菌感知、响应并适应外界环境或细胞内状态变化的调控系统。每个双组分信号转导系统均由传感器蛋白-组氨酸激酶(HK)和应答调节蛋白(RR)组成。HK接收并响应环境中的信号,将其自身的保守His残基磷酸化[27]。随后,HK携带磷酸基团并将其转移到下游的RR上,使RR转变为激活状态。活化的RR通过调节基因表达进而影响细胞生理变化。该功能中,与SCFAs代谢和细菌生物膜、细胞膜形成途径(迁移和生物膜形成,蹭行运动,鞭毛马达转动和细胞外被膜蛋白折叠和降解)相关的功能基因相对丰度在NP存在下均有较大程度的提高(见图6)。

图6 双组分信号转导系统相关功能基因及其相对丰度(p:磷酸;e:作用域)Fig.6 Functional genes related with two-component system and their relative abundances(p:phosphate;e:effector domain)
群体感应(QS)是细菌共享有关细胞密度的信息并相应地调节基因表达的调控系统,QS调控的过程包括毒力因子产生、生物发光、抗生素合成、细胞运动、孢子和生物膜形成等[28]。环境胁迫因子诱发细菌分泌信号分子,当信号分子积累到一定阈值时,将启动菌体中特定基因的表达。NP存在下,生物膜的形成对于保护细胞免受NP侵害,增加其对环境压力的抗性和耐受性极为重要[29]。生物膜的形成与细菌的鞭毛运动、胞外聚合物(EPS)分泌、胞间黏附和增殖过程密切相关,涉及这些过程的功能基因相对丰度如图7所示。可以看到,调控生物膜形成的特定功能中的合成蛋白、感应蛋白和应答蛋白基因相对丰度在NP反应器中较之于空白组提高。因此,NP的存在将促进细胞生物膜形成进而有利于微生物的生存。
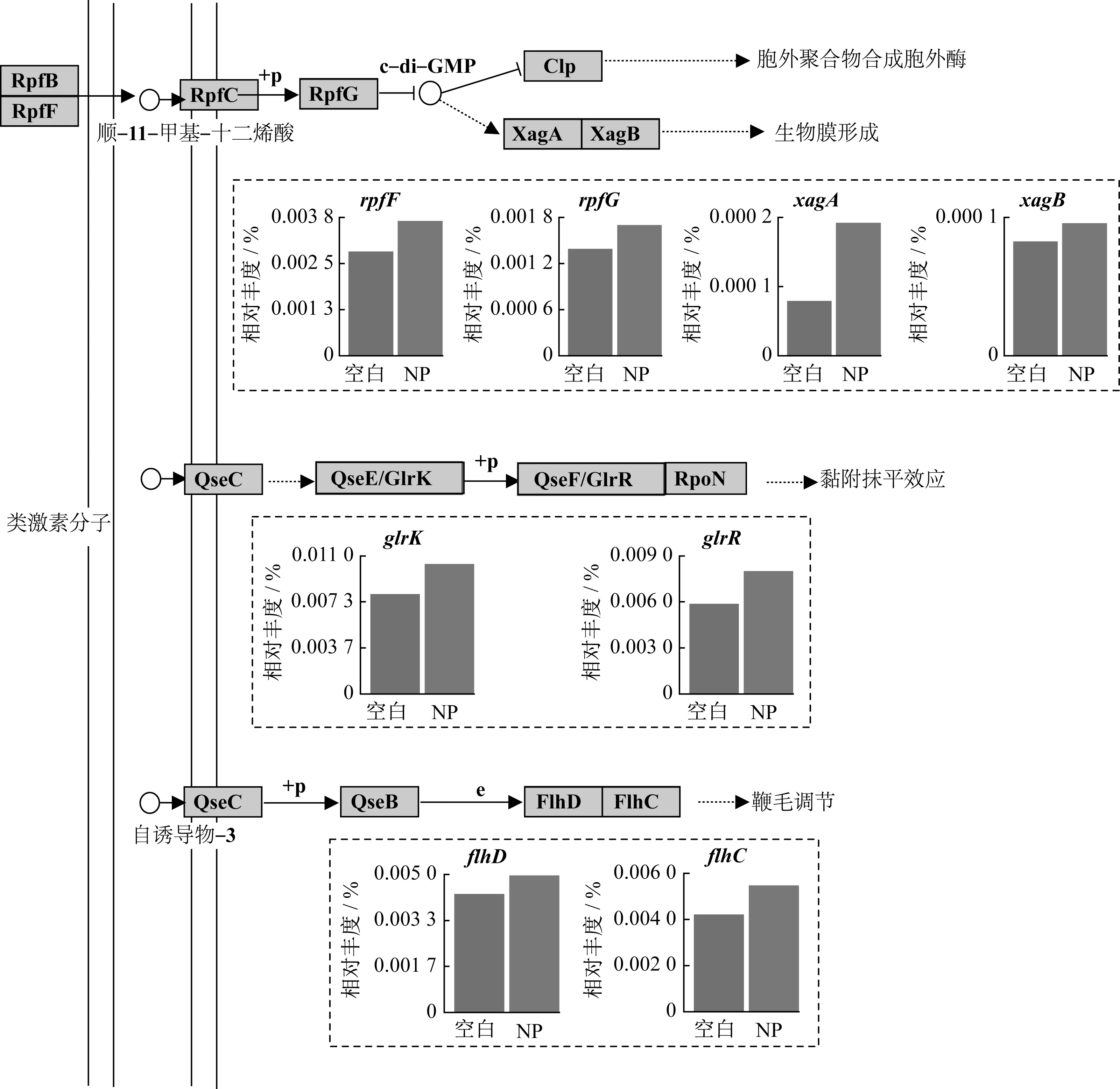
图7 群体感应功能基因及其相对丰度Fig.7 Functional genes related with quorum sensing and their relative abundances
有机底物运输进入细胞内的ABC转运蛋白基因、有机底物进入细胞后转化为SCFAs代谢过程的功能基因以及产物SCFAs外排的ABC转运蛋白功能基因的相对丰度在NP刺激下提高。除产SCFAs的代谢功能外,NP促进了与细胞生长和保护机制密切相关的双组分信号转导和群体感应系统调控的生物膜和细胞膜合成相关的功能基因。
3 结语
研究了NP对剩余污泥厌氧发酵产酸的影响。结果发现,NP促进了污泥厌氧发酵产酸过程,并且随NP含量的提高,该促进作用呈现出先增加后减少趋势。当NP含量为200 mg·kg-1干污泥时,NP反应器中的SCFAs浓度达到峰值,为空白反应器SCFAs产量的2倍,乙酸浓度为空白组的3倍。基于宏基因组测序发现,NP导致不利于SCFAs积累的古菌及耗酸微生物有所削减,产酸微生物大量积累。微生物代谢过程中,NP改变了与产酸相关的功能代谢。有机物的糖酵解等过程功能基因丰度显著提升;葡萄糖、氨基酸和脂肪酸等有机底物由胞外向胞内运输的ABC转运蛋白、运输至胞内的有机底物向SCFAs代谢转化的双组分系统以及胞内产生的SCFAs外排转运蛋白的相关基因丰度大幅提高。此外,NP引起了与细胞生长和保护机制密切相关的群体感应调控的生物膜合成相关基因丰度显著增加。
