模拟降水量变化对荒漠草原土壤酶活性的影响及其相关因素分析
2022-01-14许艺馨余海龙李春环王晓悦黄菊莹
许艺馨,余海龙,李春环,韩 翠,王晓悦,黄菊莹*
(1 宁夏大学 生态环境学院, 银川 750021; 2 西北土地退化与生态恢复国家重点实验室培育基地, 银川 750021; 3 西北退化生态系统恢复与重建教育部重点实验室, 银川 750021; 4 宁夏大学 地理科学与规划学院, 银川 750021; 5 宁夏大学 农学院, 银川 750021)
在全球变暖背景下, 水资源的时空分布受到很大影响, 各区域的降水格局也发生了明显变化, 主要表现为降水总量增加、季节分配不均以及极端事件频发(如单次降水量大小、降水事件间隔和极端降水事件发生频率)等特点[1]。有大气循环模型预测, 随着全球气温上升, 水循环也将加快, 未来极端降水事件发生的强度和频率将显著增加, 导致旱季更旱、雨季更湿[2]。自20世纪80年代中期以来, 中国降水的区域分布格局也发生了改变[3]。就中国西北地区而言, 区域降水格局表现出西部生态区降水增多、东部生态区降水减少以及夏秋两季降水增多的时空分异特征[4-5]。作为西北干旱半干旱区生态系统的关键环境因子, 降水通过调节植物—微生物—土壤之间的关系, 驱动生态系统的演变, 对维持生态系统稳定性的意义重大[6]。而气候变化中极端降水事件的发生可对生态系统关键过程产生影响, 且其影响程度在干旱半干旱区尤为明显[7]。因此, 在干旱半干旱区开展降水量变化的相关研究有助于深入了解脆弱生态系统如何应对降水格局改变。
土壤酶作为土壤有机体的代谢动力和生态系统的生物催化剂[8], 其活性的大小表征了土壤中物质代谢的旺盛程度[9], 是土壤有机物转化的执行者和植物营养元素的活性库[10], 也是生态系统变化的预警和敏感指标[11]。其中, 蔗糖酶是植物和微生物的直接营养源, 其活性的强弱与植物的生长状况密切相关, 能够反映土壤有机C的转化[12]; 脲酶主要参与土壤中N素的循环, 能促进土壤中含N有机物如尿素分子酰胺肽键的水解, 生成可被植物根系吸收利用的铵[13]; 磷酸酶能将土壤有机P转化为可被植物直接吸收利用的无机P, 从而缓解土壤P限制[14]。研究表明, 土壤酶活性受到植被特征、土壤微生物活力和土壤理化性质等生物和非生物因素的综合影响。一方面, 土壤酶主要来源于植物根系和微生物的分泌物及其残体的分解物。降水量变化下植物生长发育和微生物活性的改变将直接作用于土壤酶活性[15-16]。另一方面, 降水量通过改变土壤水分和养分等理化性质调控土壤中养分的吸收与淋失以及矿化与分解之间的平衡[17], 进而对土壤酶活性产生重要影响[18]。因此, 了解降水量变化下土壤酶活性及其与植物生物量、微生物生物量以及土壤性质的关系, 可为深入探讨降水格局改变下土壤酶活性的响应机理提供科学依据。
荒漠草原大多位于生态脆弱带, 是草原向荒漠过渡的旱生化草地类型, 其结构和功能易受到气候变化的干扰, 特别是极端降水事件的影响[19]。降水作为荒漠草原植物生长发育和微生物活动的主要限制因子, 对生态系统稳定性的维持起着关键作用[20]。那么, 降水格局改变如何影响荒漠草原土壤酶活性, 植物生长和微生物活性能否解释土壤酶活性的改变等问题值得深入探讨。目前, 国内在降水量变化下草地土壤酶活性的研究方面已积累了丰富的成果[16,21-23], 但这些研究主要集中在草甸草原和典型草原, 尚缺乏针对荒漠草原的相关研究, 尤其是极端干旱和湿润条件下。因此, 本研究以宁夏荒漠草原为研究对象, 探讨降水量变化下(极端和适宜)土壤酶活性的响应规律, 分析其与植物生物量(群落和种群水平)、微生物生态化学计量特征(可表征其活性)以及土壤理化因子的关系, 为科学预测全球气候变化下干旱半干旱区草原生态系统的反应与适应性提供数据支撑。
1 材料和方法
1.1 研究区概况
本试验于宁夏回族自治区吴忠市盐池县柳杨堡乡杨寨子村围栏草地内开展(37.80°N, 107.45°E, 海拔为1 367 m)。该地属鄂尔多斯台地, 北与毛乌素沙地相连, 南靠黄土高原, 属典型的过渡带。区域气候干燥, 风沙活动频繁, 属于中温带大陆性气候: 年平均气温7.7 ℃, 1月平均气温-8.9 ℃, 7月平均气温22.5 ℃; 降水年变率较大。年平均降水量289.7 mm, 大部分集中在5-9月(表1), 且多大雨; 年平均蒸发量2 136 mm, 约为降水量的6~8倍。土壤类型以灰钙土为主。土壤质地以砂壤、粉砂壤和砂土为主。试验地植被类型为荒漠草原, 群落结构简单, 物种组成以一年生和多年生草本为主, 优势种为牛枝子(Lespedezapotaninii)和草木樨状黄芪(Astragalusmelilotoides), 常见物种包括猪毛蒿(Artemisiascoparia)、针茅(Stipacapillata)、白草(Pennisetumcentrasiaticum)、苦豆子(Sophoraalopecuroides)和阿尔泰狗娃花(Heteropappusaltaicus)等[24-25]。
1.2 试验设计
依据野外实地考察, 于2014年在围栏草地内选择地势平坦、植被均匀有代表性的区域作为试验样地, 采用遮雨棚和喷灌装置相结合的方法, 模拟降水量变化处理[24]。降水量处理以近50年来中国西北地区西部降水量增加而东部减少的趋势为主要依据[26]。降水处理时间以研究区降水的季节分布特征(超过70%的降水集中在5-9月, 表1)和植物的生长规律(4月下旬进入返青期, 7月下旬进入旺盛期)为主要依据。降水频度参考国内同类研究[27], 同时兼顾了野外试验的可操作性。采用随机区组设计, 设置了5个降水量处理: 减少50% (减雨145 mm, W1)、减少30% (减雨87 mm, W2)、自然降水(对照, W3)、增加30% (增雨87 mm, W4)和增加50% (增雨145 mm, W5)。每个处理5次重复, 共25个小区。每个小区面积为8 m×8 m, 小区间留有2 m宽的缓冲带, 小区四周垂直上栽20 cm宽的彩钢板、下埋1 m宽的塑料布, 以防止降水时雨滴溅入、减少地表径流和地下渗漏干扰。
降水量处理时间为每年的5-8月。降水量减少处理使用自制的遮雨棚(高约1.5 m)进行遮雨。遮雨棚上覆透光率大于95%的聚氯乙烯薄膜, 晴天敞开通风以降低棚内温度, 雨天依据遮雨频率敞开或覆盖。试验处理前, 对研究区2008—2013年5-8月降水情况进行了统计, 依据分析结果将W1处理的遮雨频率初步确定为每3次降雨中遮雨2次、W2处理的遮雨频率初步确定为平均每5次降雨中遮雨2次。实地操作中, 密切关注每日天气情况, 采用降水降尘收集器(ISC-8)收集、记录每日降水量并统计5-9月的总降水量(表1), 依据每次的降雨情况和已遮掉的降雨量, 对后期遮雨频率进行了微调。2014年W1处理实际遮雨149.4 mm, W2处理实际遮雨90.4 mm。2015年W1处理实际遮雨153.6 mm, W2处理实际遮雨92.6 mm。2016年W1处理实际遮雨148.3 mm, W2处理实际遮雨89.4 mm。降水量增加处理(W4和W5)以试验区多年平均降水量289.7 mm计算, 将需要补给的降水量换算成浇水量, 采用自制的装有水表的喷灌装置实现。于2014年4月, 在增加降水量的每个小区内均匀铺设3条孔径为1.2 mm的微喷带(每隔2 m铺设1条), 以保证增加的水量能均匀喷洒在小区内。喷水时, 微喷带的末端用铁丝固定以防移位。喷水结束后, 收起微喷带。喷水频率为每2周喷水1次。其中, W4处理每次喷水0.696 m3(相当于10.9 mm降水量), W5处理每次喷水1.160 m3(相当于18.1 mm降水量)。
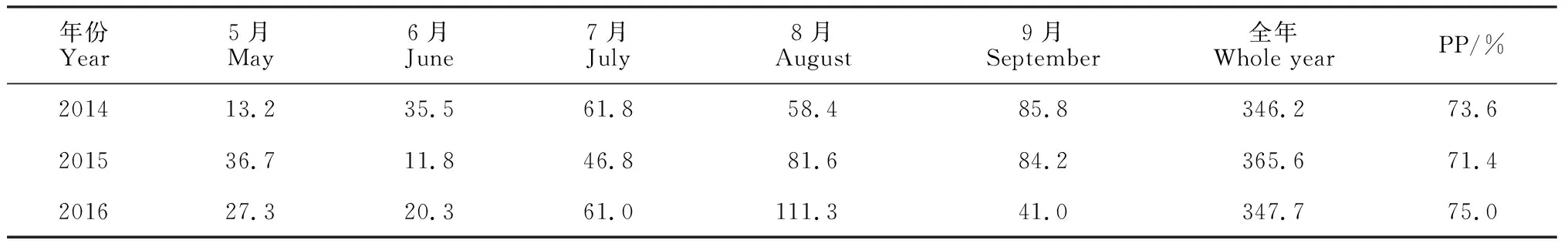
表1 研究区2014-2016年5-9月降水量
1.3 样品收集与测定
于2016年5-7月份每月下旬采用直径为5 cm的土钻收集0~20 cm土壤样品。3个月共计75个土壤样品。采集时, 在每个小区内随机取3钻, 充分混匀合并为1个样品, 从中取10 g左右鲜土放入铝盒中用于土壤含水量的测定, 剩余部分再分为两部分。一部分低温冰箱中4 ℃下保存, 2周内完成酶活性、pH、NO3--N浓度、NH4+-N浓度、速效P浓度和微生物生物量的测定。另一部分自然风干后过筛, 用于有机C、全N以及全P含量的测定。其中, 蔗糖酶活性采用3, 5-二硝基水杨酸比色法, 脲酶活性采用苯酚—次氯酸钠比色法, 磷酸酶活性采用磷酸苯二钠比色法[28]; 含水量和pH分别采用烘干法和酸度计法; 有机C、全N和全P分别采用重铬酸钾容量法-外加热法、凯氏定氮法和HClO4-H2SO4法。NO3--N和NH4+-N采用连续流动分析仪(Auto Analyzer 3, SEAL Analytical GmbH, Hanau, Germany)。速效P浓度采用0.5 mol·L-1NaHCO3法; 微生物生物量C、N、P分别采用氯仿熏蒸-K2SO4浸提-碳分析仪器法、氯仿熏蒸-K2SO4提取-流动注射氮分析仪器法以及氯仿熏蒸-K2SO4提取-磷酸(Pi)测定-外加Pi矫正法测定。
同期, 在每个小区内选取1个1 m×1 m的样方, 采用剪刀齐平地面剪下样方内所有植物地上部分。研究区植被覆盖度低、物种稀少, 各小区物种组成单一, 尤其降水量减少处理中。为使所选植物种在每个小区中均有分布, 本研究将样方内剪下的植物样品按牛枝子(优势种)、草木樨状黄芪(优势种)和其他物种归为3类, 每类共计75个样品。收集好的样品分装入牛皮纸袋带回实验室, 烘箱中65 ℃下烘48 h后, 称重记录生物量。植物群落生物量为所有物种生物量之和。
1.4 数据处理与分析
采用Excel 2016软件对数据进行初步整理。运用SPSS 19.0对数据进行统计分析: 采用两因素方差分析(Two-way ANOVA)研究降水量、月份以及二者的交互作用对土壤酶活性、植物生物量以及微生物生物量C∶N∶P生态化学计量特征的影响, 采用单因素方差分析(One-way ANOVA)中最小显著性差异法(LSD)进行指标间的多重比较。采用SigmaPlot 12.5进行图的绘制, 并采用线性回归方程进行土壤酶活性与植物生物量以及微生物生物量C∶N∶P生态化学计量特征关系的拟合。采用Canoco 5.0进行土壤酶活性与土壤理化因子对应关系的冗余分析(Redundancy analysis, RDA)。分析前, 先对数据进行Log转换, 以减少数据间差异。以全部土壤因子作为解释变量, 以土壤酶活性作为响应变量, 依据解释变量前向选择, 并通过蒙特卡洛置换检验(Monte Carlo Test)得出每个土壤因子的条件效应。
2 结果与分析
2.1 降水量对土壤酶活性的影响
图1显示, 减少降水量对3种酶活性的影响较小, 增加降水量的影响较大。与自然降水量处理相比, 仅减少50%降水量处理对蔗糖酶活性产生显著降低(P< 0.05); 增加30%和50%降水量可显著提高蔗糖酶和磷酸酶活性(P< 0.05), 但对脲酶活性没有显著影响(P> 0.05)。
表2表明, 降水量对蔗糖酶和磷酸酶活性产生极显著影响(P< 0.01), 不同月份脲酶和磷酸酶活性差异极显著(P< 0.01), 二者仅对磷酸酶活性有极显著的交互作用(P< 0.01)。
2.2 降水量对植物生物量和微生物生物量生态化学计量特征的影响
图2显示,与自然降水量相比, 减少降水量处理对植物生物量没有显著影响(P> 0.05); 增加30%和50%降水量处理不同程度地提高了植物生物量, 尤其牛枝子生物量。
两因素方差分析表明(表3), 降水量和月份均对群落、牛枝子、草木樨状黄芪及其他物种生物量有极显著影响(P< 0.01), 二者交互作用对群落、牛枝子和草木樨状黄芪生物量有显著影响(P< 0.05)。
由图3可以看出,与自然降水量相比, 减少降水量处理不同程度地降低了微生物生物量C、N和P、提高了生物量C∶N和C∶P, 对生物量N∶P没有显著影响(P> 0.05); 增加降水量处理不同程度地提高了微生物生物量C、N和P, 对其他3个指标没有显著影响(P> 0.05)。
表4显示,降水量对微生物生物量C、N、P、C∶N和C∶P有显著(P< 0.05)或极显著(P< 0.01)影响, 月份对各指标均有极显著影响(P< 0.01), 二者的交互作用对生物量C、N、P、C∶N和C∶P有显著(P< 0.05)或极显著影响(P< 0.01)。
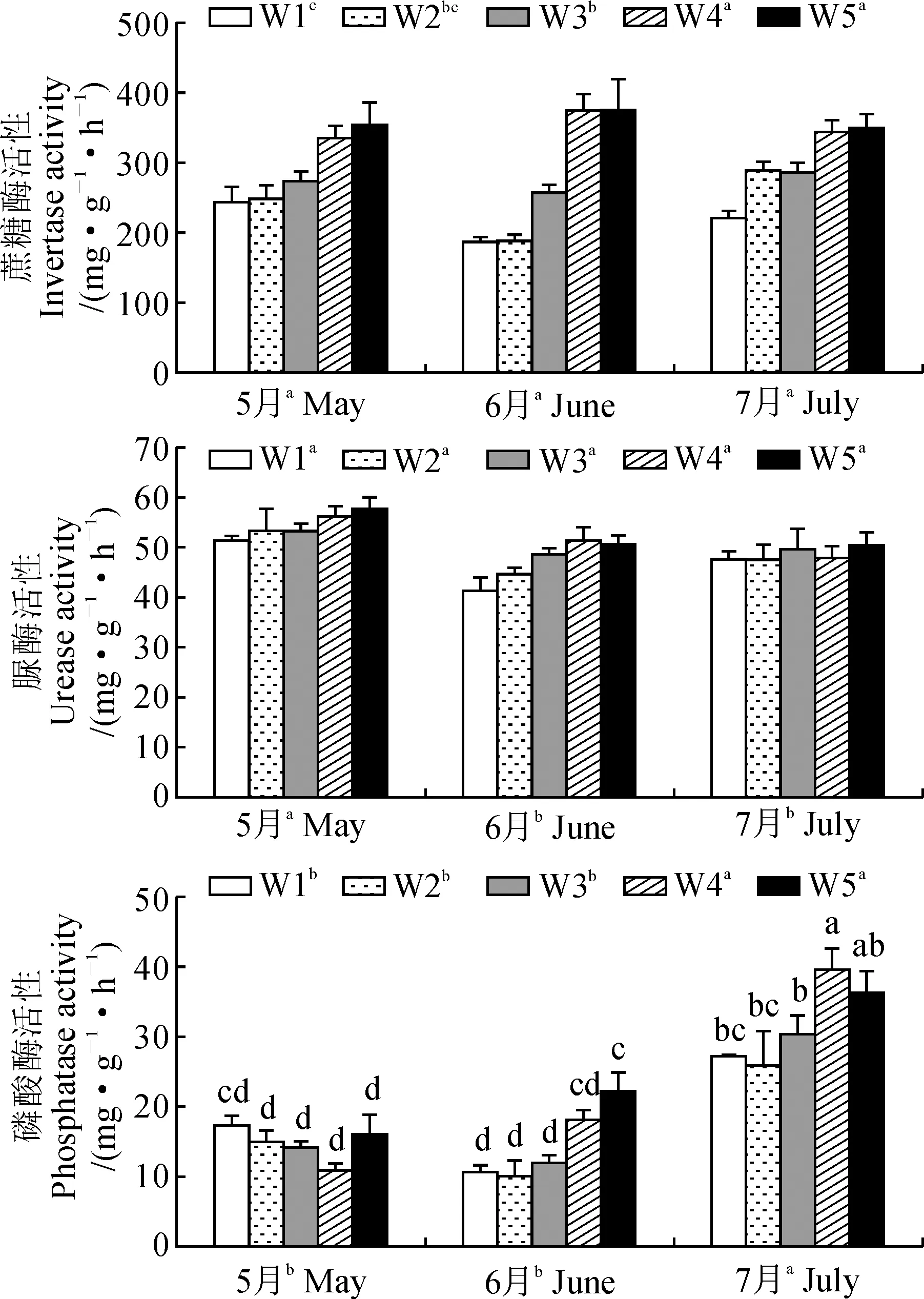
W1.减少50%降水;W2.减少30%降水;W3.自然降水(对照);W4.增加30%降水;W5.增加50%降水;不同小写字母表示降水量处理或月份间存在显著性差异(P < 0.05); 下同图1 降水量对5-7月土壤酶活性的影响W1.50% reduction; W2. 30% reduction; W3. Control(CK); W4. 30% increase; W5. 50% increase; Different normal letters indicate significant differences among precipitation treatments or months (P < 0.05) The same as belowFig.1 Effects of precipitation on soil enzyme activities in May, June and July
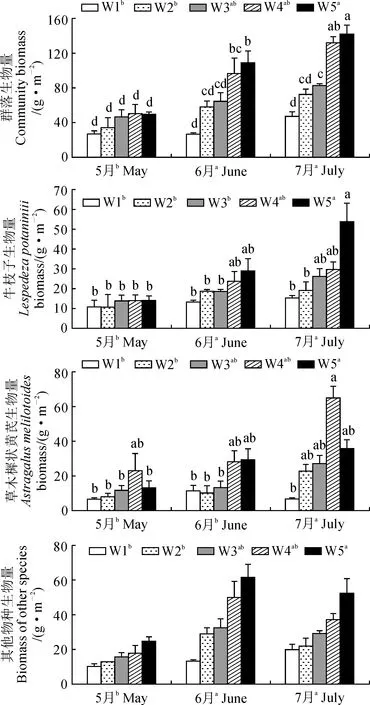
图2 降水量对5-7月植物生物量的影响Fig.2 Effects of precipitation on plant biomass in May, June and July
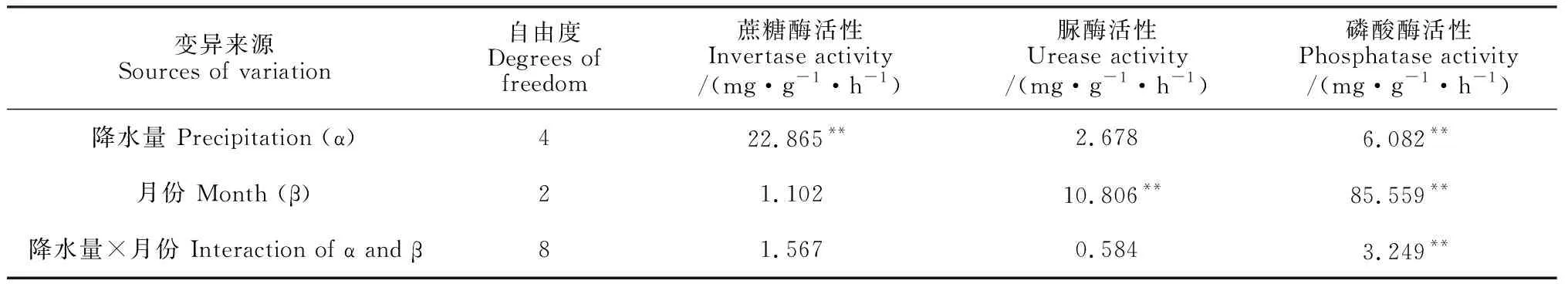
表2 土壤酶活性两因素方差分析
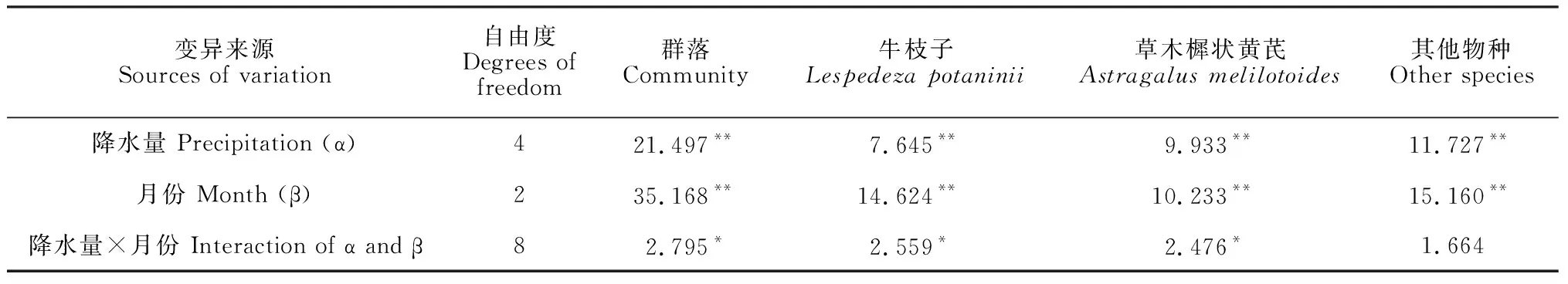
表3 植物生物量的两因素方差分析
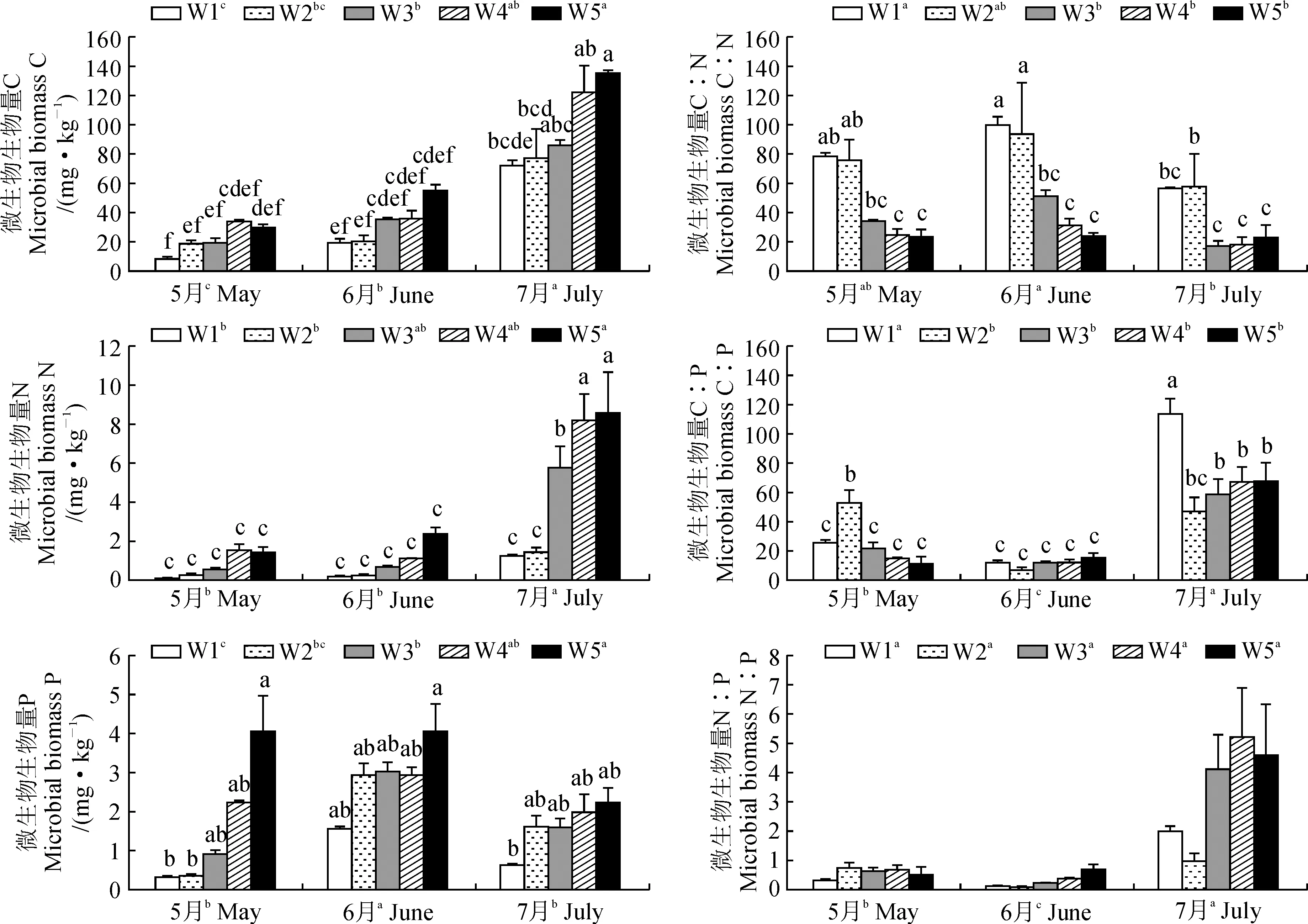
图3 降水量对5-7月微生物生物量C∶N∶P生态化学计量特征的影响Fig.3 Effects of precipitation on microbial biomass C∶N∶P ecological stoichiometry in May, June and July
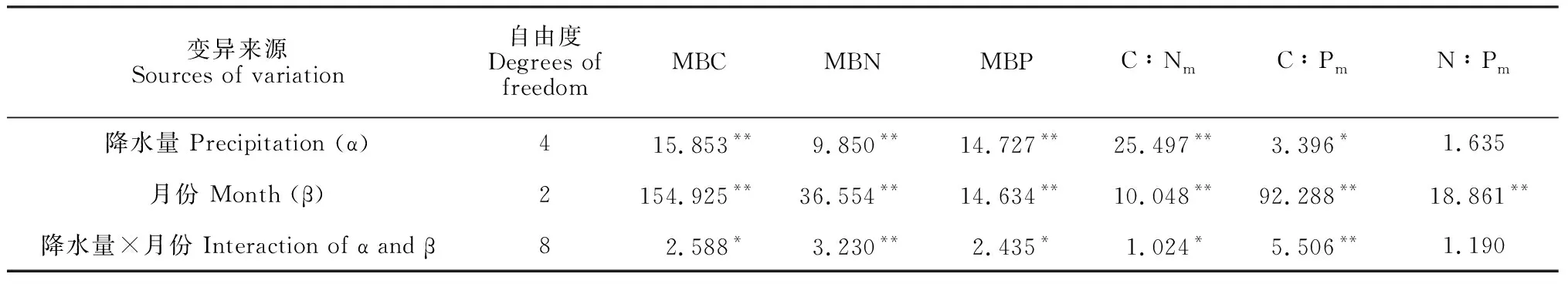
表4 微生物量C∶N∶P生态化学计量特征的两因素方差分析
2.3 土壤酶活性与植物生物量及微生物生态化学计量特征的关系
图4表明, 土壤蔗糖酶活性随着群落、草木樨状黄芪及其他物种生物量的增加而显著提高(P< 0.05); 土壤脲酶活性随着牛枝子生物量的增加而显著降低(P< 0.05); 土壤磷酸酶活性随着群落、牛枝子、草木樨状黄芪以及其他物种生物量的增加而显著增加(P< 0.05)。
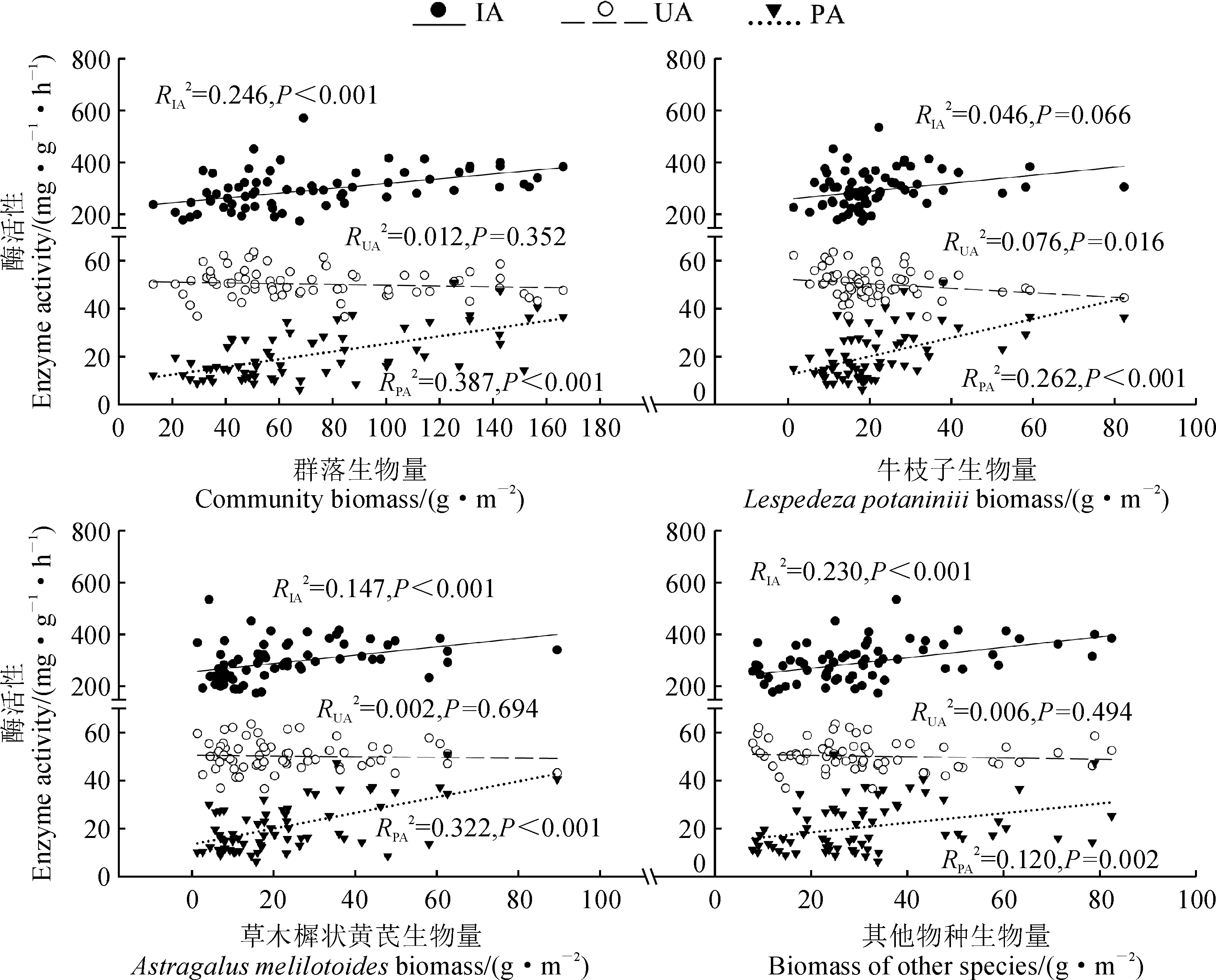
IA、UA和PA分别代表蔗糖酶、脲酶和磷酸酶活性; 下同图4 土壤酶活性与植物生物量的关系IA, UA, and PA represent invertase, urease and phosphatase activities, respectively; The same as belowFig.4 The relationships between soil enzyme activities and plant biomass
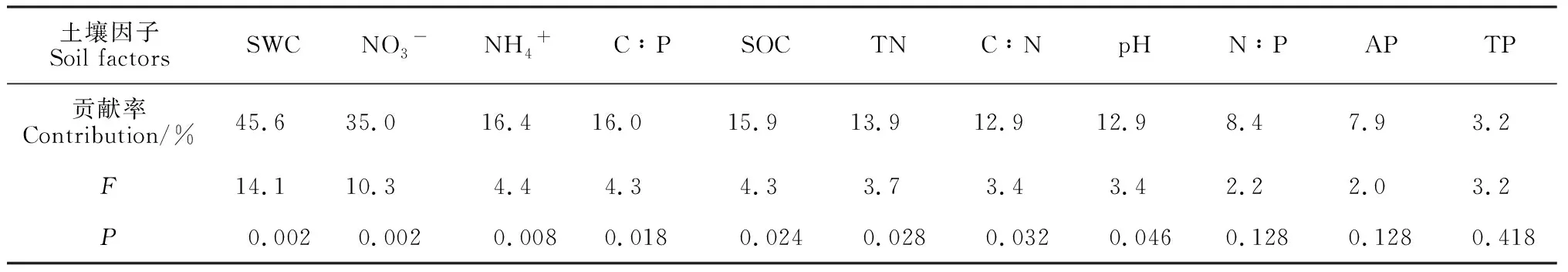
表5 冗余分析中各土壤理化因子的条件效应
图5表明, 土壤蔗糖酶活性随着微生物生物量C、N、P的增加而提高, 随着生物量C∶N的增加而显著降低(P< 0.05); 脲酶活性随着微生物生物量C∶N的增加而显著降低(P< 0.05);磷酸酶活性随着微生物生物量C、N、C∶P和N∶P的增加而增加, 随着生物量C∶N的增加而显著降低(P< 0.05)。
2.4 土壤酶活性与土壤理化性质的关系
表5表明,对土壤酶活性影响显著的土壤因子包括含水量、NO3--N、NH4+-N、C∶P、有机C、全N、C∶N和pH。其中, 土壤蔗糖酶活性与土壤含水量、N∶P、全N呈较强的正相关关系; 土壤脲酶活性与土壤速效P呈较强的正相关, 与含水量、有机C和C∶P呈较强的负相关; 土壤磷酸酶活性与土壤有机C、C∶P和C∶N呈较强的正相关, 与速效P、全P及NO3--N呈较强的负相关(图6)。
3 讨 论
3.1 土壤酶活性对降水量变化的响应
本研究中, 增加降水量在一定程度上提高了蔗糖酶和磷酸酶活性, 与已有研究结果一致[29]; 相比之下, 减少降水量对3种酶活性影响较小, 仅减少50%降水量对蔗糖酶活性有显著影响(图1)。这可能是因为增加降水量可以提高土壤水分含量、增强土壤养分有效性, 进而促进植物地下部分生长和微生物活性, 从而刺激了酶的分泌[30]。同时, 随着微生物可作用的底物增多, 酶活性相应增强[31]。而在降水量减少条件下, 一方面荒漠草原植被生长和微生物代谢产酶能力会受到水分的限制, 导致土壤有机质含量低下, 蔗糖酶活性也随之降低[32]; 另一方面, 荒漠草原植物和微生物长期适应了干旱环境, 对短期降水量减少反应不敏感[21]。因而, 相比增加降水量, 短期减少降水量对土壤酶活性影响较小[33]。此外, 与蔗糖酶和磷酸酶相比, 降水量对脲酶活性影响较小, 与闫钟清等[34]的研究结果不同。这可能是因为不同生态系统所处地理位置在气候条件(气温和降水)、植物群落结构、土壤状况(养分和质地)等方面存在差异, 导致降水量变化下各异的土壤酶活性响应格局[35]。
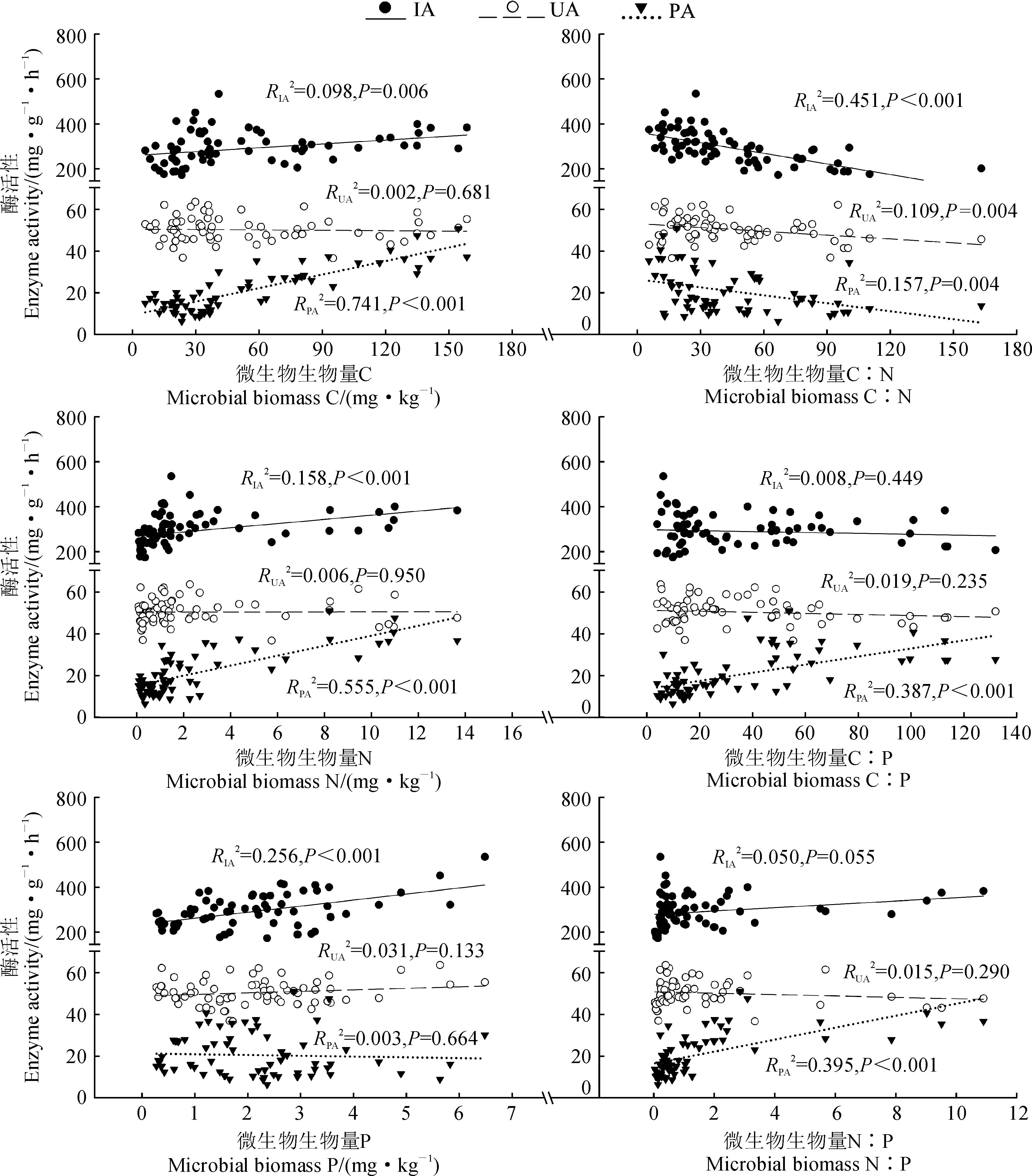
图5 土壤酶活性与微生物生物量C∶N∶P生态化学计量特征的关系Fig.5 The relationships between soil enzyme activities and microbial biomass C∶N∶P ecological stoichiometry
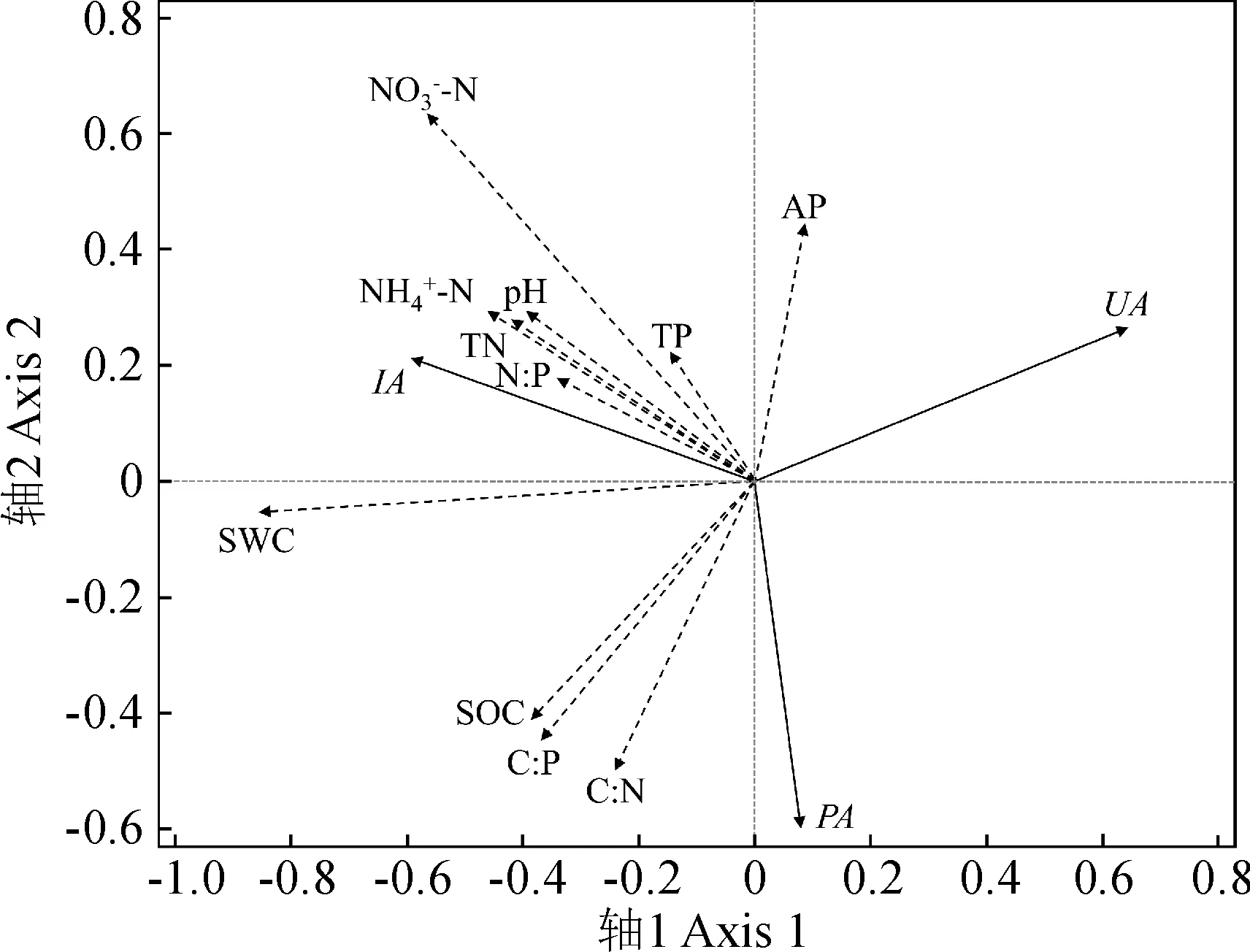
图6 土壤酶活性与土壤理化因子的RDAFig.6 RDA of soil enzyme activities and soil physicochemical factors
3.2 土壤酶活性与植物生物量及微生物生态化学计量特征的关系
降水量可通过调控土壤含水量, 影响植物地上部分的生长以及地下根系的生命活动, 从而对酶活性产生重要影响[36]。本研究中, 降水量变化下蔗糖酶和磷酸酶活性与植物群落和部分物种生物量存在正的线性关系(图4)。这可能是因为增加降水量可以提高荒漠草原土壤水分和养分有效性, 从而促进植物地下部分养分摄取和地上部分光合作用, 有利于植被生物量积累[37]。而植物生物量的积累可为土壤酶的合成提供丰富的底物, 促进蔗糖酶和磷酸酶的产生[38]。此外, 降水量增加50%处理提高了牛枝子生物量, 而脲酶活性与牛枝子生物量呈负的线性关系。可能原因在于两方面。其一, 作为豆科植物, 牛枝子可与菌根真菌形成共生关系以促进其根系对N素的吸收, 而这种菌根真菌对脲酶的主要生产者存在一定程度的抑制作用[39]。其二, 增加降水量刺激了牛枝子生长、提高了牛枝子优势种地位。此时, 牛枝子对其他植物的竞争抑制程度增强, 使得其生物量升高时其他物种生物量下降或增加幅度降低(图2), 而酶活性与群落生物量直接正相关(图4)。
降水量变化下地上植被、土壤含水量和pH等因素的变化, 会对微生物与植被、土壤之间的养分转化产生重要影响, 从而改变微生物代谢过程、群落结构以及C∶N∶P生态化学计量特征[40], 直接或间接地影响到土壤酶的分泌及活性。大量研究证实微生物生物量与酶活性有着密切联系[16,34-36]。本研究结果显示, 与自然降水量相比, 减少降水量降低了微生物生物量C和N, 增加降水量则表现出相反的效应(图3); 随着微生物生物量C和N的增加, 蔗糖酶和磷酸酶活性呈线性增加(图5)。这说明, 减少降水量限制了微生物生长, 从而抑制了蔗糖酶和磷酸酶的分泌; 增加降水量可以缓解土壤水分和N限制, 从而提高了微生物活性、加速了微生物繁衍周期、增加了微生物生物量C和N的积累, 进而促进了蔗糖酶和磷酸酶的分泌[41]。但也有研究表明, 过高的降水量会导致土壤养分淋溶损失, 抑制微生物生长和生物量积累, 从而对酶活性产生负影响[42-43]。
3.3 土壤酶活性与土壤理化性质的关系
在所有土壤理化因子中, 含水量是影响酶活性最主要的因子, 其值过高或过低都会影响酶的活性[44]。本研究中, 土壤含水量、NO3--N和NH4+-N与蔗糖酶活性正相关, 与脲酶活性负相关。一方面, 降水量的增加提高了水分和N的有效性, 导致C相对受限, 从而刺激微生物分泌较多的C获取酶以促进有机C矿化[45]。另一方面, 一定程度的水分胁迫会刺激酶活性[46], 因而脲酶活性随降水量降低而增加(图6)。尽管研究表明, 随着土壤N有效性增加, 植物和微生物P受限性增强, 植物根系和微生物会分泌较多的磷酸酶以促进有机P的矿化[47-48], 但本研究中磷酸酶活性与有机C和C∶P正相关, 而与全N、全P和速效P负相关。这一结果与以往研究类似[49], 表明降水量变化下研究区磷酸酶活性主要受土壤C有效性的正调控。此外, 脲酶活性与全N以及N∶P负相关, 与速效P正相关, 与已有研究结论一致[50]。这进一步意味着, 高的N有效性抑制了脲酶活性; 而当P有效性升高、N相对P受限时, 脲酶活性相应增加, 反映了植物和微生物在土壤养分限制类型发生转变时通过积极分泌相应的酶来保证稳定的土壤生物学过程的应对机制[36]。
4 结 论
综合以上分析, 减少降水量对3种酶活性的影响较小, 增加降水量的影响较大。其中, 与自然降水量处理相比, 仅减少50%降水量处理对蔗糖酶活性有显著影响(降低), 增加30%和50%降水量不同程度地提高了蔗糖酶和磷酸酶活性; 大多情况下, 蔗糖酶和磷酸酶活性随植物(群落和种群)及微生物生物量(C、N、P)的增加而增加, 脲酶活性与二者关系较弱; 对酶活性影响显著的土壤理化因子包括含水量、NO3--N、NH4+-N、C∶P、有机C、全N、C∶N和pH。
本研究结果意味着, 减少降水量对研究区土壤酶活性影响较小, 尤其在减少30%降水量条件下; 增加降水量提高了土壤水分和N有效性, 刺激了植物生长和微生物繁殖, 从而提高了蔗糖酶活性。随着植物生物量增加, 土壤有机C输入增多、微生物P受限性增强, 磷酸酶活性相应增强以促进有机P的矿化。本研究中, 野外模拟试验处理在真实反映降水量变化上存在一定的局限性(如降水强度和持续时间等)。考虑到酶种类的多样性和专一性, 且其活性易受到众多外部环境因子(植物群落组成和土壤性质等)综合作用的影响, 今后还需在改进降水量控制试验装置的基础上, 结合多种酶活性的变化规律, 并通过较长时间尺度的原位试验, 深入探讨降水量变化下对酶活性的影响机制。
