石生茶藨茎段快繁体系的建立
2022-01-14冯琳骄褚佳瑶由佳辉艾克热木伊力哈木
高 林,冯琳骄,褚佳瑶,由佳辉,艾克热木·伊力哈木,周 龙,陆 彪
(1.新疆农业大学 园艺学院,新疆 乌鲁木齐 830052;2.新疆维吾尔自治区伊犁哈萨克自治州特克斯县林业和草原局,新疆 伊犁 835500)
石生茶藨Ribes SaxatilePall.是茶藨子科Grossulariaceae茶藨子属Ribes的一种落叶低矮灌木,在我国仅分布于新疆的阿尔泰山及特克斯北山等区域,其果实营养丰富,具有较高的经济价值[1-2]。组织培养是快速繁殖种苗的有效途径,具有取材少、能保持良种优势、全年都可生产等优点[3]。目前有关茶藨子属植物组织培养的研究报道较多:方鹏等[4]在研究华茶藨组培繁殖体系时发现,最适宜的诱导培养基是MS+0.40 mg·L-1NAA+0.40 mg·L-1ZT+1.80 mg·L-12,4-D+35 g·L-1蔗糖,最适宜的不定芽增殖培养基是MS+0.50 mg·L-1ZT+0.10 mg·L-1NAA;焦荟颖等[5]研究发现,黑穗醋栗‘布劳德’组培苗经过1~2 d的暗培养后其生根率可达95%。然而,前人有关茶藨子属植物组培快繁体系的研究对象多为栽培种,而关于石生茶藨组培体系的研究却尚未见诸报道。石生茶藨作为西天山野果林中极具特色的伴生种,其对西天山野果林的生态稳定具有重要作用。但是,旅游和放牧等人为活动使得石生茶藨的自然生境受到了严重破坏,其生存现状不容乐观。为给石生茶藨的引种与繁殖提供技术支持,以石生茶藨的带腋芽茎段为试材,采用不同配方的培养基、不同浓度的植物生长调节剂进行组培试验,以筛选出最适宜石生茶藨腋芽萌发的培养基及其生根培养基配方,从而建立一套较为成熟的石生茶藨组织培养体系。
1 材料与方法
1.1 试验材料
将2019年采集于特克斯北山的石生茶藨种子,经4 ℃低温河沙层积处理后,于2020年3月播种培育于新疆农业大学果树种质资源实验室中,以其3月龄幼苗的带腋芽茎段为接种材料。
1.2 试验方法
1.2.1 外植体的消毒
选择生长健壮、长势一致的幼苗,采集带腋芽的茎段,将所采茎段修剪为长约2 cm的外植体,然后用流水冲洗30 min,清洗掉其表面污物。将清洗好的外植体置于超净工作台上进一步消毒处理,先用75%的乙醇浸泡30 s,再用0.10%的升汞消毒10 min,最后用无菌水冲洗干净,置于接种盘中以备用。
1.2.2 初代培养试验
分别选择MS、B5和WPM培养基作为基本培养基,再在其中分别添加0.50 mg·L-1的IBA、1.50 mg·L-1的6-BA进行初代培养试验,以筛选出最适宜的初代培养基。初代培养基中的蔗糖浓度为30 g·L-1、琼脂浓度为7 g·L-1,pH值为5.8。接种时,将受损的外植体组织去除掉,保留长为1.50 cm的带芽茎段进行接种,每种培养基各接种15瓶,每瓶各接种3个外植体。初代培养期间,培养温度保持为(24±2)℃,光照强度保持为1 500~2 000 Lx,光照周期为12 h·d-1[6]。培养30 d后统计污染率和萌发率。
腋芽萌发率=(萌芽数/接种数)×100%;
污染率=(污染数/接种数)×100%。
1.2.3 基于二次回归正交旋转组合设计的增殖培养试验

选用二次回归正交旋转组合方法设计增殖培养方案,增殖培养试验因素分别为6-苄基腺嘌呤(6-BA)、吲哚丁酸(IBA)和赤霉素(GA3)这3种植物生长调节剂,增殖培养试验共设23个处理组。参照董瑞等[7]的二次回归正交旋转组合方法进行试验设计,建立的二次回归方程为:式中:Y代表增殖系数;X代表增殖培养中每个处理各种植物生长调节剂的处理浓度,X1、X2、X3分别代表6-BA、IBA、GA3的处理浓度;B0为常数项,B1、B2、B3分别为X1、X2、X3浓度一次方项的回归系数,B12、B13、B23分别为X1X2、X1X3、X2X3交互项的回归系数,B11、B22、B33分别为X1、X2、X3浓度二次方项的回归系数。
植物生长调节剂6-BA、IBA、GA3的处理浓度范围分别设定为1.00~3.00、0.00~1.00、0.00~1.50 mg·L-1。采用二次回归正交旋转组合方法设计试验方案时,要求每个因素各取5个水平进行组合设计,其中,最高浓度水平记为Z2j,其编码值为γ(1.682);最低浓度水平记为Z1j,其编码值为-γ(-1.682);中间浓度水平记为Z0j,其编码值为0,中间浓度水平(Z0j)的计算公式为:Z0j=(Z1j+Z2j)/2;其他2个水平分别记作上浓度水平和下浓度水平,其数值根据植物生长调节剂浓度的范围来计算,将从Z2j到Z0j的单位编码值的连续变化区间记作Δj,其计算公式为:Δj=(Z2j-Z0j)/γ。上浓度水平为Z0j+Δj,其编码值为1;下浓度水平为Z0j-Δj,其编码值为-1。3种植物生长调节剂的5个浓度水平的编码值与其对应的处理浓度详见表1。
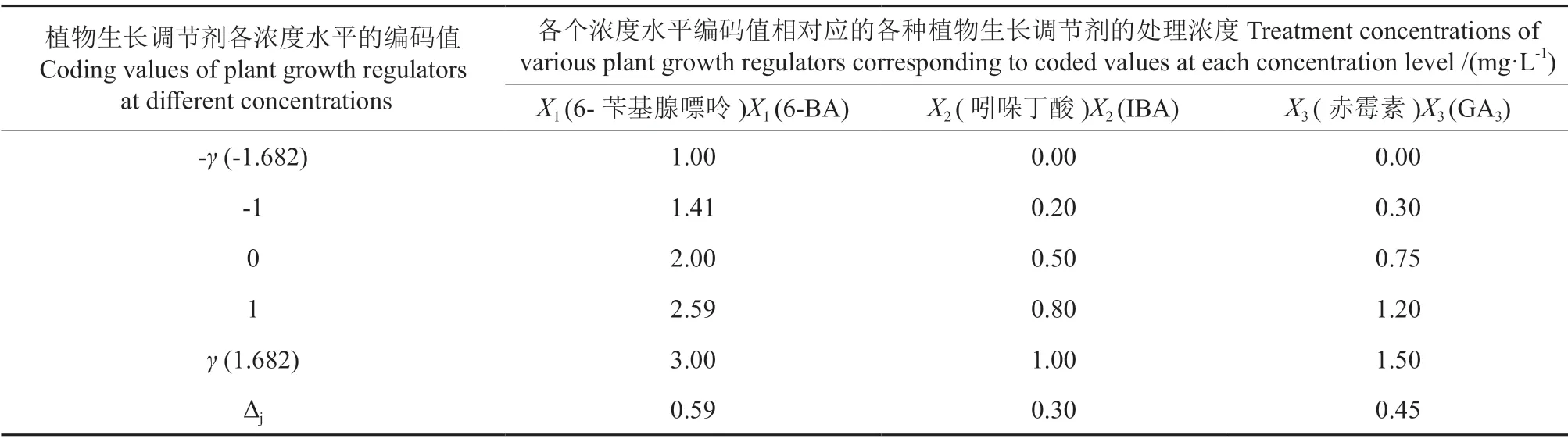
表1 基于二次回归正交旋转组合设计的6-BA、IBA和GA3的各个浓度水平的编码值及其对应的处理浓度Table 1 The coded values at each concentration level of 6-BA, IBA and GA3 and their corresponding treatment concentrations based on quadratic regression orthogonal rotation combination design
增殖培养的基本培养基为MS培养基,蔗糖浓度为30 g·L-1,琼脂浓度为7 g·L-1,pH值均调至5.8,23个处理组的3种生长调节剂的浓度组合详见表2。
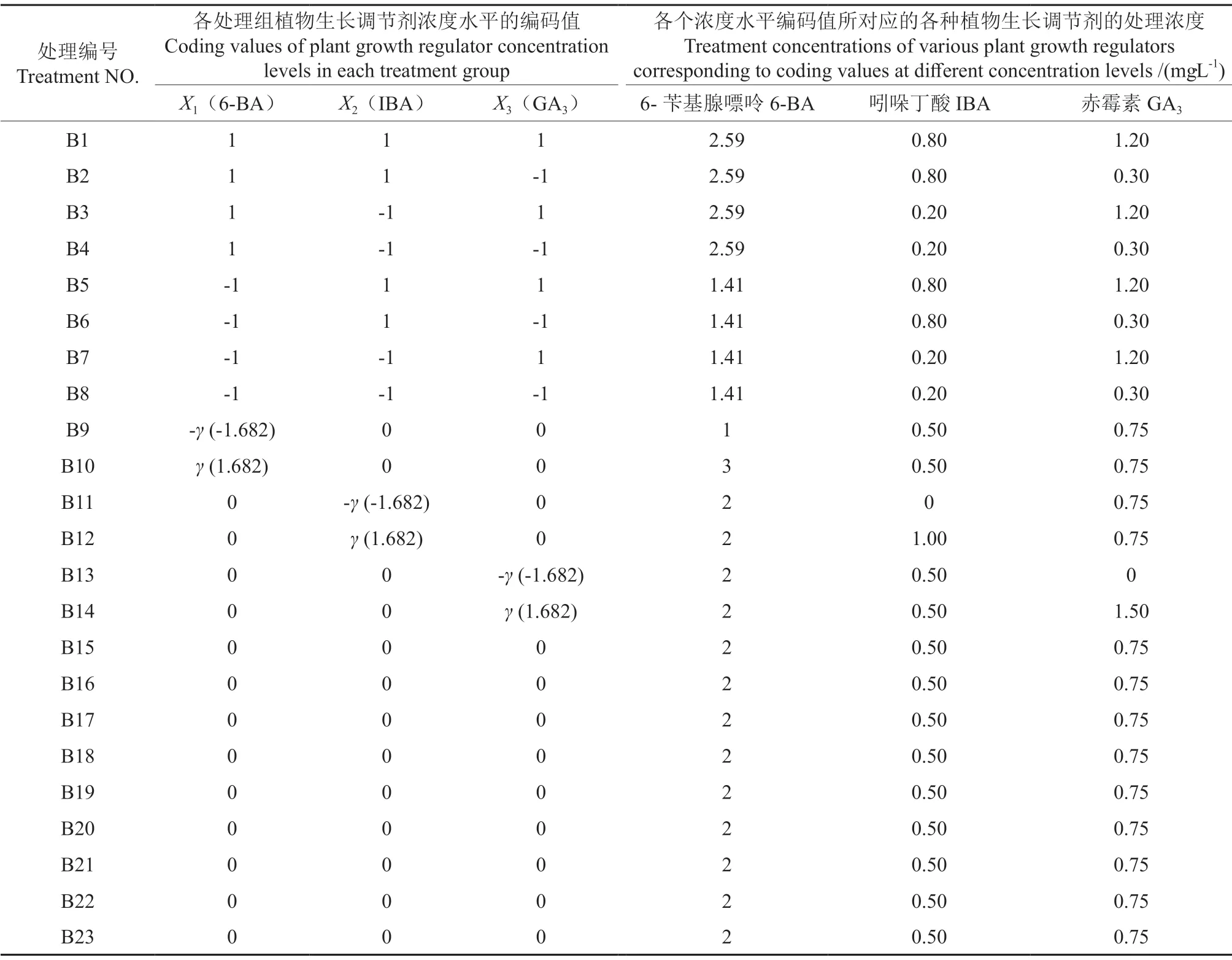
表2 增殖培养的试验方案Table 2 Experimental scheme of proliferation culture
增殖系数=总芽数/接种芽数。
1.2.4 生根培养试验
生根培养的基本培养基为1/2 MS培养基,蔗糖浓度为30 g·L-1,琼脂深度为7 g·L-1,pH值为5.8,在生根培养基中不添加细胞分裂素,只添加浓度分别为0.50、1.00、1.50 mg·L-1的IBA;分别进行0、1、3、5、7 d的暗培养。选择株高在1.5 cm以上、带有4个以上叶片的无根壮苗为试验材料,将其转至生根培养基中进行生根培养,每处理各接种3瓶,每瓶各接种组培苗1株,重复3次,接种40 d后统计生根率。生根培养条件与初代培养条件相同。
生根率=(生根苗数/接种苗数)×100%。
1.3 数据处理与分析
采用Excel 2010、SPSS软件及DPS数据处理系统进行数据处理与单因素方差分析和回归分析。
2 结果与分析
2.1 初代培养基对石生茶藨茎段萌发率的影响
不同培养基处理对石生茶藨茎段萌发的影响情况见表3。从表3中可以看出,3种培养基处理的腋芽萌发率存在显著性差异(P<0.05)。以MS培养基处理的腋芽萌发率最高,为91.11%,且无污染;其次是WPM培养基处理的腋芽萌发率,为80.00%,污染率为2.22%;腋芽萌发率最低的是B5培养基处理的,其腋芽萌发率仅为73.34%。MS培养基中外植体的丛生芽粗壮,B5培养基中外植体的丛生芽弱小,WPM培养基中外植体的丛生芽质量处于前两者之间。因此,MS培养基是促使石生茶藨茎段萌发的最适宜的初代培养基。
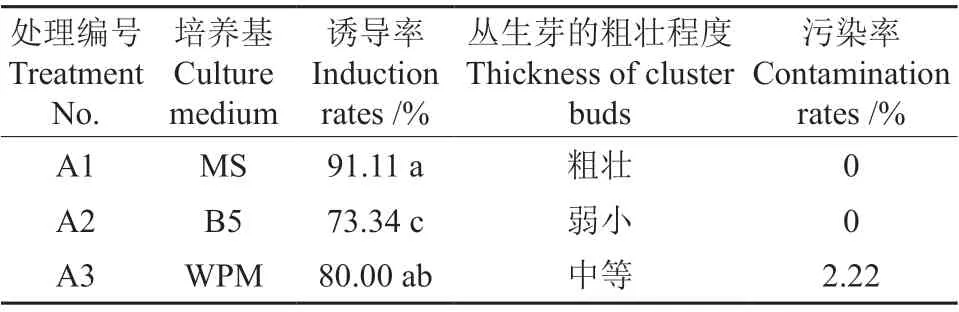
表3 不同培养基处理对石生茶藨茎段萌发的影响†Table 3 Effects of different media on germination rate of R.Saxatile Pall.
2.2 基于二次回归正交旋转组合设计的增殖培养效果
2.2.1 回归方程的确立
增殖培养的试验结果见表4,对增殖培养试验结果的方差分析结果见表5。
根据表4的数据,采用DPS数据处理系统用二次回归正交旋转组合设计方法进行拟合,得到的回归方程为:

表4 增殖培养的试验结果Table 4 Test results of proliferation culture

为了检验回归方程的有效性,结合表5的方差分析结果及查询F分布临界值表可以得知:
F1=0.44<F0.05(5,8)=3.69。
这一计算结果说明,回归方程的失拟性不显著,因此可以认为,所选用的数学模型是适当的,模型未受到其他因子的影响。方程回归显著性检验结果为:
F2=5.60>F0.05(9,13)=2.71。这一计算结果说明,回归方程的回归性显著。增殖系数和6-BA、IBA、GA3的相关系数的计算式为:
R2=回归平方和/总平方和=0.80。
这一相关系数说明根据该模型预测的结果其准确度可达80%。因此,剔除α=0.10时的不显著项,得到优化后的方程为:

2.2.2 单种激素的影响效应与两种激素交互作用的影响效应的比较分析
由表5的均方值可知,影响石生茶藨茎段增殖培养效果的3种植物生长调节剂的主次顺序是:IBA>6-BA>GA3。由于二次回归正交旋转组合设计具有正交性,各变异来源之间相互独立,所以可采用“降维法”将任意2种植物生长调节剂的浓度水平固定为零,得到第3种植物生长调节剂浓度与增殖系数的关系,结果如图1所示。图1显示了3种植物生长调节剂对石生茶藨茎段增殖培养效果的影响趋势,其中IBA和6-BA对石生茶藨茎段的增殖培养效果均呈现先降低后上升的变化趋势。当IBA和6-BA的浓度低于中间浓度水平(即IBA为0.50 mg·L-1、6-BA为2.00 mg·L-1)时,6-BA的增殖效果高于IBA的增殖效果;而当IBA和6-BA浓度高于中间浓度水平时,IBA的增殖效果高于6-BA的增殖效果;且两者在最高浓度水平时的增殖效果均最好。GA3的增殖效果呈现先上升后降低的变化趋势,其在中间浓度水平(即0.75 mg·L-1)时的增殖效果最好。
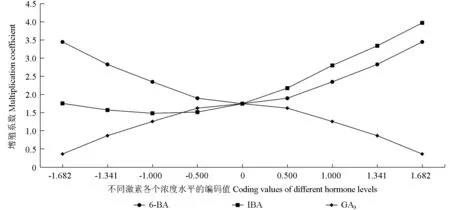
图1 单种激素试验效果的比较Fig.1 Comparison of effects of single hormone test
由表5可知,回归方程中X1X2的交互作用在α=0.1时显著,而X1X3和X2X3的交互作用在α=0.1时不显著。对3组激素交互作用的影响效果进行比较分析,结果如图2~4所示。从图2中可以看出,在6-BA最低浓度水平与IBA最高浓度水平处,增殖系数达到最高。从图3中可以看出,增殖系数最大值出现在GA3中间浓度水平与6-BA最高和最低浓度水平处。从图4中可以看出,增殖系数在GA3中间浓度水平与IBA最高浓度水平处达到最大值。
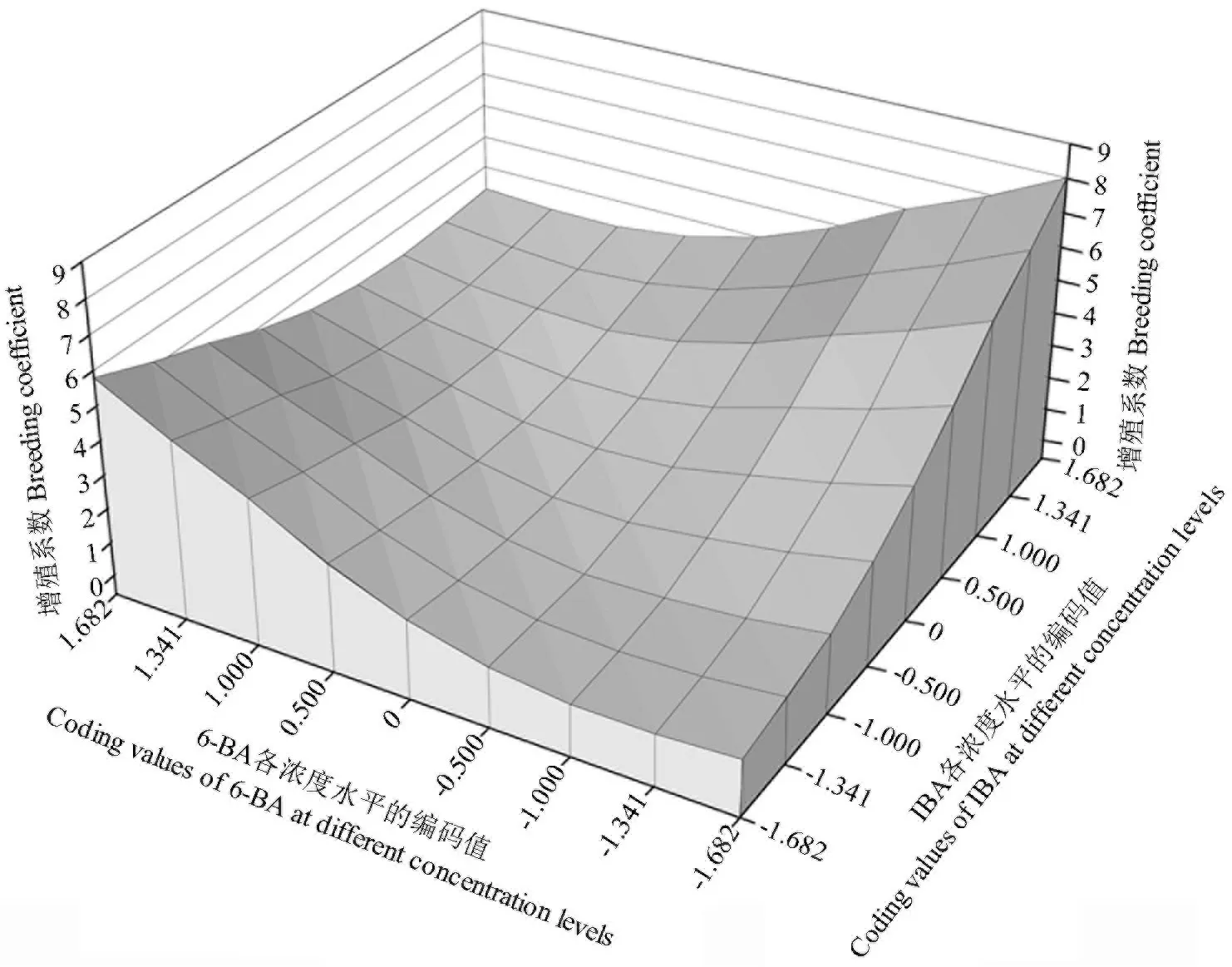
图2 6-BA与IBA的交互作用对增殖系数的影响Fig.2 The effect of interaction between 6-BA and IBA on proliferation coefficient

图3 6-BA与GA3的交互作用对增殖系数的影响Fig.3 The effect of interaction between 6-BA and GA3 on proliferation coefficient
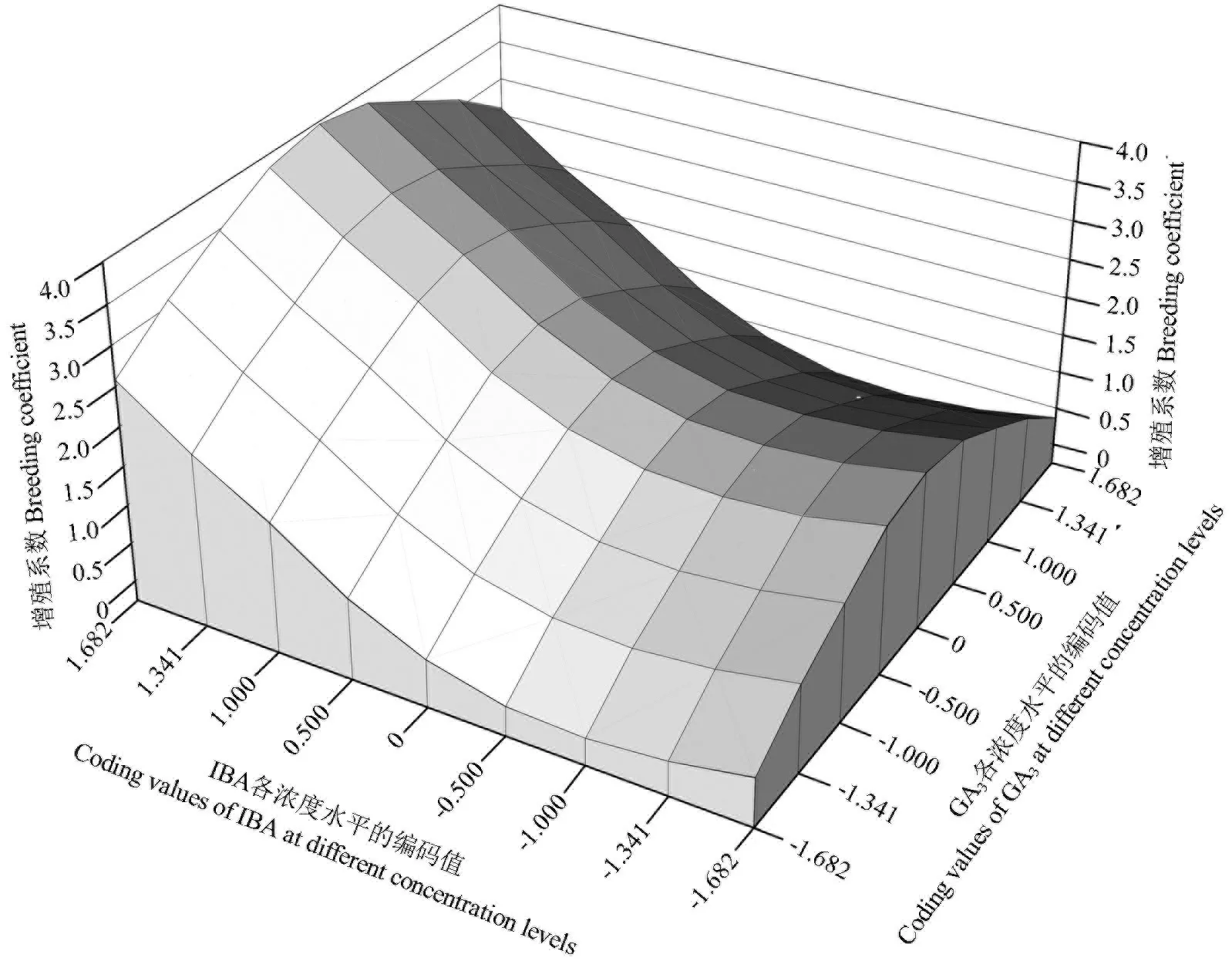
图4 IBA与GA3的交互作用对增殖系数的影响Fig.4 The effect of interaction between IBA and GA3 on proliferation coefficient

表5 对增殖培养试验结果的方差分析结果Table 5 Analysis of variance on results of proliferation culture test
2.2.3 以频率分析法模拟增殖培养效果最优值
优化方案中各变量取值的频率分布情况见表6。由表6可知,增殖系数大于2.04的处理方案有70个,在其95%的试验方案中,6-BA、IBA、GA3的适宜浓度范围分别为1.93~2.31、0.54~0.71、0.45~0.87 mg·L-1,取其平均值为最适浓度,即当6-BA、IBA、GA3的浓度分别为2.12、0.63、0.66 mg·L-1时,增殖培养的效果最佳。
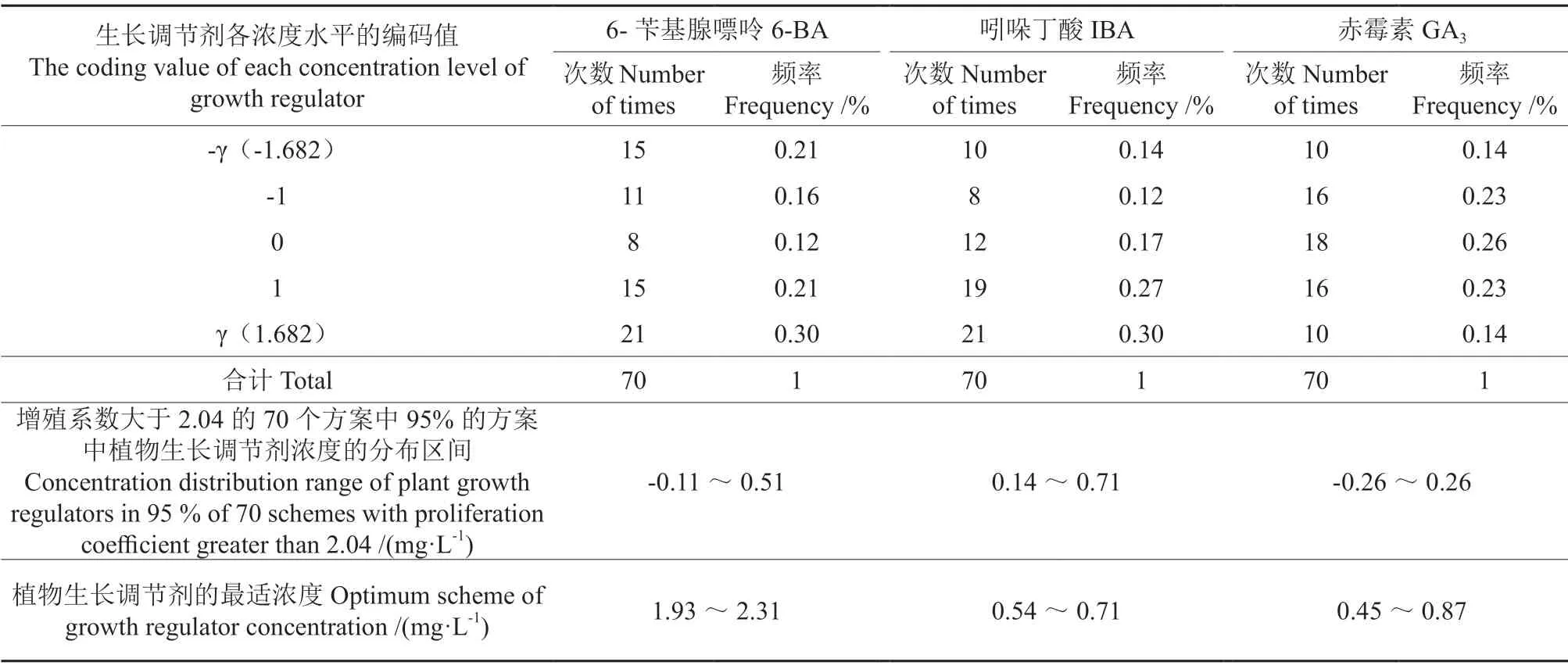
表6 优化方案中各变量取值的频率分布情况Table 6 Frequency distribution of variable value in optimization scheme
2.3 植物生长调节剂浓度及暗处理时间对石生茶藨组培苗生根效果的影响
不同植物生长调节剂的处理浓度及暗处理时间对石生茶藨生根率的影响情况见表7。由表7可知,不同浓度的IBA和暗处理时间对石生茶藨组培苗生根的影响程度不同,各处理间存在显著性差异(P<0.05)。从IBA的浓度来看,添加有1 mg·L-1IBA的培养基处理的生根效果最好,其次是添加有1.50 mg·L-1IBA的培养基处理的,生根效果最差的是添加有0.50 mg·L-1IBA的培养基处理的;从暗处理时间来看,暗处理3 d的生根效果最好。由此得出,最适宜石生茶藨生根的培养基为1/2 MS+1 mg·L-1的IBA,以此培养基暗培养3 d的生根效果最好,其生根率为86.67%。
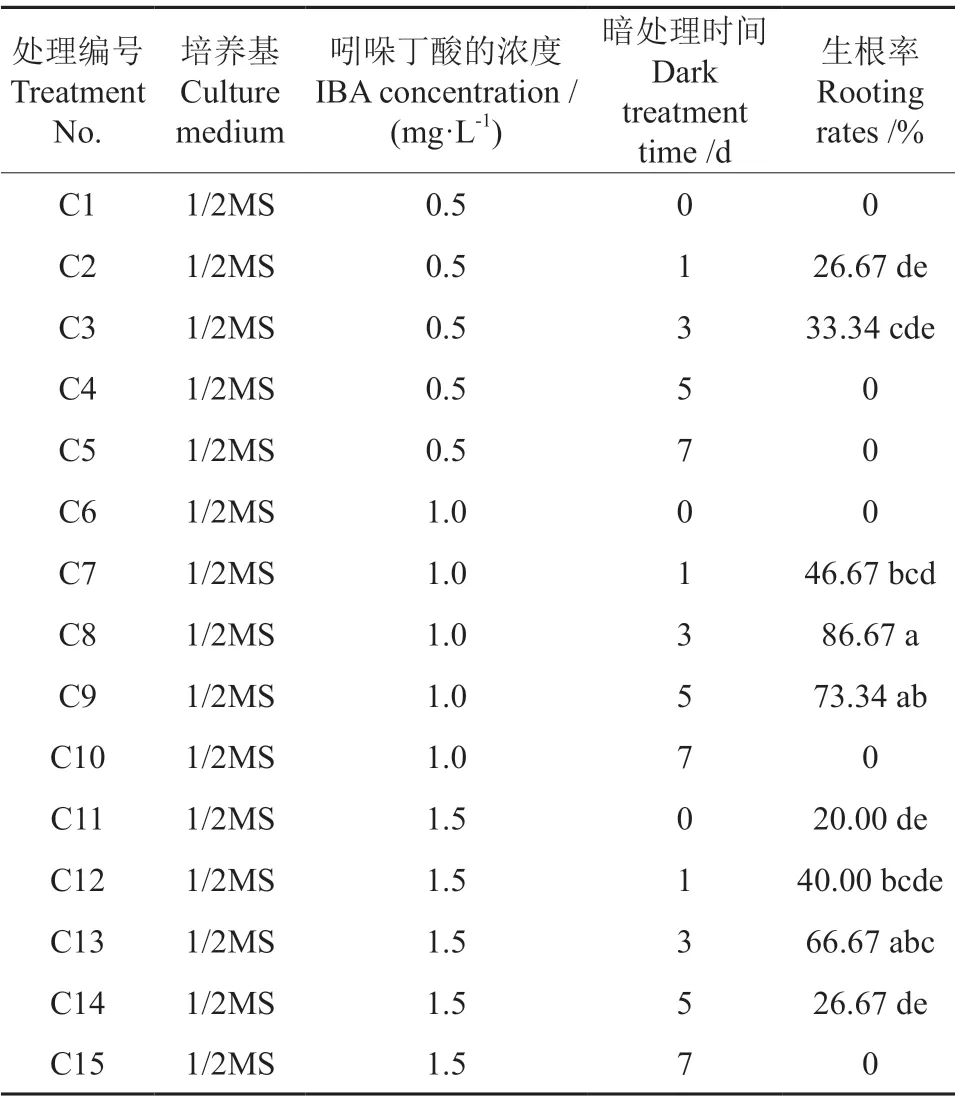
表7 不同浓度的吲哚丁酸及暗处理时间对石生茶藨生根率的影响Table 7 Effects of different IBA concentrations and dark treatment time on rooting rate of R.Saxatile Pall.
3 讨 论
3.1 初代培养基对腋芽萌发效果的影响
在植物的组织培养中,外植体生长发育所需的营养物质来源于基本培养基[8],因此选择适宜的基本培养基进行初代培养,这对植物组织培养的成败至关重要。在木本植物的组织培养中,常常选用MS、B5和WPM培养基作为基本培养基[9-10]。试验中发现,石生茶藨最适宜的初代培养基为MS培养基,其腋芽萌发率比B5与WPM培养基处理的分别高17.77%和11.11%。这一试验结果与前人的相关研究结果相似:邹薇薇等[11]使用MS、1/2MS、B5和WPM培养基进行香茶藨组织培养试验,结果发现,MS培养基是最适宜于香茶藨组培快繁的基本培养基;张馥茜[12]研究发现,适于穗醋栗‘黑金星’‘早生黑’和‘大粒甜’诱导培养的培养基是MS培养基。作为同科同属的石生茶藨、香茶藨和穗醋栗(‘黑金星’‘早生黑’和‘大粒甜’)在MS培养基中均表现出较好的状态,这可能与MS培养基无机盐含量较高而微量元素及有机成分齐全有关[13],其能较好地满足茶藨子属植物在组培时对各种营养元素的需求。李金英等[14]研究发现,黑穗醋栗‘寒丰’的组培苗在含有全量大量元素的MS培养基中生长较好;除此之外,武爱龙等[15]在对珍珠相思不定芽的诱导时发现,在相同的激素配比下,MS培养基的诱导效果最好,显著优于1/2MS和1/4MS培养基的诱导效果。
3.2 不同植物生长调节剂浓度对腋芽增殖的影响
增殖培养是组培过程中的关键环节,其效果主要受植物生长调节剂种类与浓度的影响[16-17]。研究中发现,3种植物生长调节剂对石生茶藨茎段增殖培养效果的影响的主次顺序是IBA>6-BA>GA3,其中IBA的使用对增殖培养效果的影响显著,IBA与6-BA的交互作用对增殖培养效果的影响也显著。分析IBA与6-BA的交互作用后发现,当IBA浓度为1.00 mg·L-1、6-BA浓度为1.00 mg·L-1时,其增殖效果最好。采用频率分析法分析得知,MS+2.12 mg·L-16-BA+ 0.63 mg·L-1IBA+0.66 mg·L-1GA3是石生茶藨茎段增殖培养的最适培养基。这一研究结果与前人的相关研究结果也相似:李金英等[18]在研究楔叶茶藨组培繁殖体系中发现,适宜于楔叶茶藨继代增殖培养的培养基是MS+1 mg·L-1BA+0.10~0.20 mg·L-1IBA+0.25~0.50 mg·L-1GA3;赵锦等[19]在对黑穗醋栗Ceres品种的组织培养中发现,MS+0.50 mg·L-16-BA+0.50 mg·L-1IBA是最适宜的增殖培养基;叶景丰[20]研究发现,‘坠玉’的最佳增殖培养基为MS+0.50~0.80 mg·L-16-BA+0.20~0.50 mg·L-1IBA,以此培养基进行组培,组培苗的增殖倍数可达5~6倍。在增殖培养阶段,选用适宜的植物生长调节剂种类和配比对组培苗的增殖具有重要作用,通常会在增殖阶段选择2种或3种培养基配合使用,其配方因植物品种及生长环境的不同而有差异[21]。
3.3 植物生长调节剂浓度及暗处理时间对生根诱导的影响
组培苗的生根效果对组培苗的质量与移栽的成活率均有决定性作用[22],一般采用添加植物生长调节剂和暗处理的方法来提高组培苗的生根效果。研究中发现,最适于石生茶藨组培苗生根的培养基为1/2MS+1 mg·L-1IBA。现有研究结果表明,生长素是植物不定根诱导与发育过程中的关键影响因素之一[23-24]。IBA对植物根系的发育具有调节作用,对不定根的形成具有促进作用,其使用浓度因品种而异[25]。李金英等[26]在对黑穗醋栗‘寒丰’和楔叶茶藨的生根培养中发现,适于黑穗醋栗‘寒丰’和楔叶茶藨的生根培养基是1/2 MS+1 mg·L-1IBA,且根的质量较好;刘丹等[27]研究发现,适于附子组培苗的生根培养基为1/2 MS + 0.50 mg·L-1IBA,以此培养基处理的生根率可达100%;王晨等[28]研究发现,在生根培养基中添加0.10 mg·L-1IBA,对提高柳杉组培苗的生根率具有显著效果;王跃华等[29]研究发现,在对杜鹃兰无根苗不定根进行诱导时,IBA的最佳浓度为0.30 mg·L-1。试验中还发现,在使用1/2 MS+1 mg·L-1IBA培养基的基础上再进行3 d的暗处理后,石生茶藨组培苗的生根效果最好,其生根率为86.67%。在组培苗的生根培养阶段,对组培苗进行暗处理,可以促使伤口部位的细胞黄化,进而转化为生根细胞,有利于根系的萌发与生长。这一研究结果与马凤桐等[30]对黑穗醋栗的组培试验结果相似。马凤桐等[30]应用暗培养技术对黑穗醋栗进行生根培养,结果发现,暗培养1~3 d的试管苗其生根率可达83.30%~95.60%,且此方法具有简单、高效、稳定的优点。
3.4 本研究存在的局限性与下一步研究的方向
随着植株的生长发育,植株自身各部分的状态和各种内源激素含量均会发生不同程度的改变。本研究仅采用3月龄幼苗的带芽茎段为试验材料,按照试验结果仅能建立起初步的石生茶藨组培快繁体系。因此,若要建立完善的石生茶藨组培快繁体系,还应采用不同年龄段的石生茶藨植株上的不同部位作为试验材料,进一步开展组培快繁试验,以便建立更加完善的石生茶藨组培快繁体系,为实际生产提供更加可靠的理论依据与技术支持。
4 结 论
本试验以石生茶藨带腋芽茎段为材料,研究了基本培养基的种类和植物生长调节剂的使用对石生茶藨茎段快繁体系的影响情况,并采用二次回归正交旋转组合进行增殖培养方案的设计。试验中发现,最适于石生茶藨初代培养的培养基是MS培养基,在初代培养基MS+0.50 mg·L-1IBA+1.50 mg·L-16-BA中,其腋芽萌发率可达91.11%;经二次多项式回归分析及以频率分析法模拟其最优值后发现,影响石生茶藨茎段增殖培养效果的植物生长调节剂的主次顺序是IBA>6-BA>GA3,其中IBA的使用对其增殖效果的影响显著,且IBA与6-BA的交互作用对其增殖效果的影响也显著,最适宜的增殖培养基为MS+2.12 mg·L-16-BA+0.63 mg·L-1IBA+0.66 mg·L-1GA3,以此培养基进行培养,可以获得最大的增殖率;其最佳生根培养基为1/2 MS + 1 mg·L-1IBA,以此培养基先暗处理3 d,其生根率可达86.67%。
