柚皮苷激活Maxi K对糖尿病心脏的保护作用
2022-01-14肖雯婧邓凯文王婷婷呼永河
肖雯婧,邓凯文,王婷婷,呼永河,侯 君
(1. 中国人民解放军西部战区总医院药剂科,四川 成都 610083;2. 西南交通大学医学院,四川 成都 610031)
柚皮苷(naringin,NA)是一种在柑橘属水果中大量存在的类黄酮化合物,该化合物对高血压、冠心病等多种心血管疾病具有良好的保护作用。柚皮苷心血管保护作用机制复杂,涉及多种细胞靶点及相关信号通路。目前,柚皮苷对细胞钾离子通道的作用机制成为研究其产生心血管保护作用的热点[1]。
糖尿病心肌病(diabetic cardiomyopathy,DCM)是一种由糖尿病引起的心脏疾病,其发病机制与传统心脏疾病不同,起始于高糖微环境通过多种方式导致的心脏病变,临床多采用控制血糖减缓DCM发展,目前亟需依据其病理机制开发针对性治疗方案[2]。国内外已有多篇报道指出NA对DCM具有保护作用,但其作用机制尚未阐明。研究表明NA可通过激活细胞大电导钙激活钾离子通道(The large conductance Ca2+activated K+channels,Maxi K)改善心肌缺血/再灌注损伤以及治疗心肌肥厚等疾病[3-4]。Maxi K是一种在多种细胞膜表达的钾离子通道,具有大电导、对钙离子浓度及电压敏感的特点,参与多种病理生理功能[5-6]。Maxi K在心血管疾病中的作用机制被广泛报道,有学者指出针对Maxi K调节剂的研究是开发心血管疾病防治药物的有效策略[7]。DCM中已经发现心脏血管平滑肌细胞表面Maxi K表达及功能均明显下降,Maxi K β亚基缺失可加剧DCM血管纤维化和重构[8-9],通过逆转Maxi K在DCM中的变化有望产生良好的治疗作用。本研究拟观察Maxi K特异性抑制剂是否可抵消NA对DCM的保护作用,从而激活Maxi K是否为NA保护DCM的重要环节,为NA作为DCM治疗药物转化提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1实验动物 SPF级SD大鼠(雄性,3月龄)(220-240)g,购于成都达硕实验动物有限公司,动物准字:SCXK(川)2020-030。动物实验方案经中国人民解放军西部战区总医院伦理委员会审批通过后进行。饲养过程参照中国动物福利法案,保障动物权益。
1.1.2饲料[10]普通饲料成分(总热量3.2 kcal·g-1):脂肪5%、碳水化合物55%、蛋白质23%、其他成分17%(含纤维素及灰分)。高脂饲料(总热量4.7 kcal·g-1):脂肪50%、碳水化合物17%、蛋白质25%、其他成分8%(含纤维素及灰分)。
1.1.3试剂 柚皮苷(货号:C10392280)购于上海麦克林生化公司、链脲佐菌素(货号:s8050)购于北京索莱宝科技有限公司;HE(货号:C01055)、Masson(货号:T4104)试剂盒购于上海碧云天生物技术有限公司;Maxi Kα(货号:sc-374142)、Slo-β(货号:sc-377023)、Collagen Ⅰ(货号:sc-293182)、Fibronectin(货号:sc-271098) antibody购于Santa Cruz公司。
1.2 仪器多普勒超声诊断仪(Sonos 7500,Philips公司),石蜡切片机(RM2243,Leica公司),数字凝胶成像系统(Flurochem9900-50qAlphaInnotech公司),转移电泳仪(PowerPac Universal 500w,Bio Rad公司),倒置荧光显微镜(13 TS100,Nikon 公司)。
1.3 方法
1.3.1造模及分组 SD大鼠(♂,6周龄)购买后适应性喂养1周,随机分为4组,每组8只。对照组(CON)给予普通饲料喂养,其余3组大鼠给予高脂饲料喂养。喂养4周后除CON组外,其余模型大鼠按35 mg·kg-1行腹腔注射链脲佐菌素(streptozotocin,STZ)构建糖尿病心肌病模型(diabetic cardiomyopathy,DCM)。STZ注射1周后,大鼠禁食12 h用尾静脉血测定血糖值,以空腹血糖≥16.7 mm·L-1为标准确定糖尿病模型造模成功。将造模成功的大鼠随机分为3组,分别为模型组(DCM),柚皮苷组(NA),柚皮苷+ Maxi K特异性抑制剂组(NA+PAX),DCM组给予NA组等体积生理盐水灌胃,1次/日。NA组及NA+PAX组分别给予柚皮苷混悬液40 mg·kg-1[11]或者柚皮苷40 mg·kg-1+paxilline 20 mg·kg-1[12],1次/日。所有大鼠均连续给药12周,普通饲料喂养。4组大鼠均每周测定一次体重及空腹血糖。
1.3.2大鼠心功能及血流动力学变化检测 戊巴比妥腹腔注射麻醉大鼠后,将其仰卧固定于保温板并使用直肠探温针监测动物体温。大鼠胸部备皮后涂抹耦合剂,多普勒超声诊断仪检测大鼠心功能变化程度。选用710超声探头(轴向70 μm分辨率)取左心室短轴切面,长轴切面以及心尖四腔心切面行心脏超声。测量后每组原始数据取连续5个心动周期测量的平均值。超声检测指标:左室射血分数(LVEF)、左室短轴缩短率(LVFS)、左室舒张早期最大血流/二尖瓣心房收缩期最大血流(ratio of E/A)、左心室后壁舒张末厚度(LVPWd)、左心室后壁收缩末厚度(LVPWs)、左心室前壁舒张末厚度(LVAWd)、左心室前壁收缩末厚度(LVAWs)。心功能测定后将大鼠颈部正中切口,分离右侧颈总动脉,插入塑料导管并固定,导管另一头经压力换能器连接生物信号记录分析系统测定血流动力学变化,检测指标包括:左室舒张末期压力LVEDP及左室压力最大上升和下降速率(dp/dt)。操作均由同一人完成且随机取样,未告知动物分组。
1.3.3大鼠心脏病理改变检测 取大鼠左心室制备为石蜡切片,HE及Masson染色检测心脏病理改变程度对大鼠主动脉及左心室行Masson染色及HE染色检测,同时对心肌胶原进行半定量分析计算心肌胶原容积分数(collagen volume fraxtion,CVF)。
1.3.4Western blot检测心肌相关蛋白表达 取少量大鼠左心室心肌组织,提取总蛋白后测定浓度,每个孔道上样量约为20 μg,SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测心肌Maxi K、Ⅰ型胶原蛋白、纤连蛋白水平改变程度。
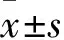
2 结果
2.1 Maxi K抑制后NA对大鼠体质量及血糖的影响与CON组相比,实验组大鼠(DCM组,NA组,NA+PAX组)均出现多饮、多食、多尿、体质量减少等糖尿病典型症状且血糖明显增高,但实验组之间差异无统计学意义(Tab 1)。
2.2 Maxi K抑制后NA对大鼠心功能的影响实验结果显示,与文献结果类似DCM组与CON组相比心脏收缩功能参数LVEF、LVFS、LVPWs无明显变化[13],其舒张功能参数E/A、LVAWd、LVPWd和收缩功能参数LVAWs值降低(P<0.05)而LVEDP明显增加(P<0.05),血流动力学变化显示DCM引起dp/dt明显降低(P<0.05)。NA连续给药12周后可部分恢复大鼠心功能,其中LVPWd基本可恢复至CON组水平。而使用PAX特异性阻断Maxi K后,NA心脏保护功能明显下降,其中E/A、LVPWd与DCM组无差异(Tab 2,Fig 1)。
2.3 Maxi K抑制后NA对大鼠心脏病理学影响HE与Masson染色结果如Fig 2所示,与CON组相比DCM组心脏出现细胞核不规则、纤维肿胀、疏松,空泡样变性明显及胶原纤维明显增多的病理改变。NA组可明显观察到肌纤维排列较DCM组略整齐,空泡样变性及胶原纤维减少。但是,特异性抑制Maxi K后,NA对大鼠心肌病理的改善程度明显减弱。对Masson染色图片行CVF分析,与CON组(3.15±0.7)相比,DCM组(40.98±4.7)明显增加(P<0.05),与病理结果相似,NA给药后可降低CVF值(9.03±1.78),而特异性阻断Maxi K后,CVF值出现明显上升(28.19±3.4,P<0.05)。
2.4 Maxi K抑制后大鼠心肌细胞胶原蛋白、纤连蛋白表达水平改变Western blot结果显示与CON组相比DCM组胶原蛋白及纤连蛋白表达均增强,NA给药后有所下降。NA+PAX组胶原蛋白及纤连蛋白表达与NA组相比有所增加(Fig 3)。
2.5 NA对DCM大鼠心肌Maxi K表达的作用Fig 4显示糖尿病可导致大鼠心肌Maxi Kα及β亚基表达量均出现明显下降。经NA治疗后,Maxi K表达未发生明显恢复。

Tab 1 Changes of body weight and blood glucose in rats

Tab 2 Changes of cardiac function in rats

Fig 1 Representative echocardiographic images of rat heart in each group
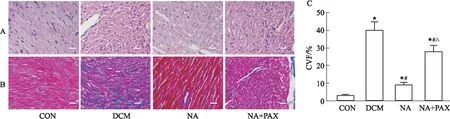
Fig 2 HE and Masson staining results and CVF analysis of rat myocardial tissues

Fig 3 Changes in protein levels of myocardial collagenand fibronectin in rats

Fig 4 Changes in myocardial Maxi K α subunitsand β subunits in rats
3 讨论
糖尿病患者体内高糖微环境可导致血管功能受损从而继发DCM,其具体病理机制尚未阐明。部分学者提出假说认为血管内皮细胞膜表面Maxi K功能下降是引起糖尿病患者血管舒张功能受损的重要原因[14]。有学者使用Maxi K通道β亚基敲除小鼠建立糖尿病动物模型,随后观察到Maxi K通道功能缺失会促进糖尿病模型动物血管功能障碍、重塑和纤维化程度加重,该实验结果进一步证明上述假说。后续功能恢复性实验指出Maxi K特异性开放剂NS1619对动物心脏具有明确保护作用[15]。因此,Maxi K通道有望成为DCM治疗干预的重要靶点。
柚皮苷是一类可从饮食摄入的黄酮类化合物,对高血压、冠心病、糖尿病心肌病等多种心血管疾病产生有利作用。柚皮苷的心血管保护作用涉及多个信号通路和分子靶点,其中柚皮苷对离子通道的调控作用近年来受到了广泛关注。有报道指出柚皮苷可通过促进Maxi K通道开放对心肌缺血/再灌注产生保护作用,该保护作用可被Maxi K通道特异性抑制剂部分抵消[3]。更为重要的是,有报道指出NA可通过激活Maxi K对1岁龄老年大鼠产生心血管保护作用,该研究结果为老年营养方案设计提供了新视角[16]。
本研究探讨柚皮苷对糖尿病模型大鼠心功能的保护作用是否受到Maxi K通道特异性抑制剂PAX的影响。通过建立DCM模型,我们观察柚皮苷及柚皮苷与PAX联合给药后模型大鼠心功能及病理情况改善程度,实验结果显示,柚皮苷对DCM具有明确保护作用,可增强模型大鼠心脏舒张功能、降低心肌纤维化程度。但上述保护作用在PAX联合给药后明显下降(P<0.05)。同时,为证明文献报道所述柚皮苷为Maxi K通道开放剂而非增加其蛋白表达,本研究使用Western blot技术检测各组模型大鼠心脏Maxi K通道α及β亚基表达程度变化,实验结果显示柚皮苷对其无影响。
综上所述,我们推测促进Maxi K通道功能恢复是柚皮苷对DCM产生保护作用的重要环节。随着年龄增加,细胞离子通道功能进一步衰退[17],NA通过调控Maxi K在老年大鼠心功能保护中展现的优良作用[16]提示我们,与传统DCM候选药物相比,NA通过恢复Maxi K功能可能对老年糖尿病患者心功能具有更好的保护作用。该实验依据可用于指导设计老年糖尿病患者膳食营养方案,以延缓其心功能障碍提高患者生活质量。
