苦参碱注射液对小鼠急性酒精性肝损伤的保护作用*
2022-01-13都梦帆胥冰向汝郭东艳范妤史晓燕段丽芳
都梦帆,胥冰,向汝,郭东艳,范妤,史晓燕,段丽芳
(陕西中医药大学1.医学技术学院,2.陕西省中药基础与新药研究重点实验室3.基础医学院,陕西 咸阳712046)
酒精性肝病(alcoholic liver disease, ALD)指摄入过量酒精引起的广泛肝损伤,导致酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化及酒精性肝硬化等一系列肝脏损伤的疾病[1],随着持续大量摄入酒精而逐级病变。目前ALD 发病率在肝脏疾病中排第2 位,仅次于病毒性肝炎,随着疾病的进展会逐渐发展为不可逆的肝硬化,甚至肝癌,严重威胁患者的健康[2]。酒精性肝损伤目前没有较好的临床治疗策略,西医主要以营养支持和对症治疗为主,疗效甚微,不良反应较多[3]。我国传统中药可保肝护肝、健脾和胃、降低转氨酶、加快乙醇代谢,还能逆转酒精导致的肝细胞损伤,减轻酒精代谢物对脏器的损伤[4],因此从中草药中提取有效成分,探寻预防和治疗酒精性肝损伤的新药物具有重要意义。
苦参碱是一种四环喹啉嗪生物碱[5],主要存在于苦参、广豆根、苦豆子等豆科植物中,具有抗炎、抗菌、抗病毒、抗肿瘤、抗纤维化等药理作用[6],目前临床上主要用于辅助其他药物对病毒性肝炎和肿瘤等疾病进行治疗[7]。有研究表明苦参碱可调节机体的氧化应激和炎症反应,协同保护溃疡性结肠炎和肺损伤[8]。苦参碱可明显改善四氯化碳诱导的药物性肝损伤,增强抗氧化物酶,减少肝损伤产生高氨血症引起的氧化应激,调节神经炎症,减少四氯化碳诱导细胞凋亡引起的焦虑和抑郁等[9]。但其在酒精性肝损伤中的保护作用还不清楚。因此本文主要针对苦参碱在酒精性肝损伤中的抗氧化作用进行研究,探究苦参碱的肝保护作用。
1 材料与方法
1.1 实验动物
SPF 级雄性昆明小鼠30 只,实验动物生产许可证号:SCXK(陕)2018-001,实验动物使用许可证号:SYXK(陕)2015-002,体重(20±2)g,购于西安交通大学医学部实验动物中心。小鼠分笼饲养,室温保持(20±3)℃,模拟正常光照时间,普通饲料喂养。本实验遵循实验动物保护和使用指南,并经陕西中医药大学实验动物伦理委员会批准。
1.2 药品与试剂
苦参碱标准品购自山东瑞阳制药股份有限公司,溶解于葡萄糖溶液后参照成人用量折算,按比例分别制成高剂量组(2.8 mg/kg)、低剂量组(1.4 mg/kg)。
丙二醛(Malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)、还原型谷胱甘肽(Glutathione, GSH)、过氧化氢酶(Catalase, CAT)、甘油三酯(Triglyceride, TG)测定试剂盒,丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)试剂盒、总胆红素(total bilirubin, T-BIL)试剂盒均购自南京建成生物工程研究所。BCA 蛋白定量检测试盒购自武汉博士德生物工程有限公司,油红O 染色试剂盒购自西安赫特生物科技有限公司,HE 染色试剂盒购自北京索莱宝科技有限公司。
1.3 仪器与设备
DM4000B 显微镜、石蜡切片机购自德国Leica 公司,ELx808 酶标仪购自美国Bio Tek 公司,TC-120S 型生物组织自动脱水机、TB-718EL 生物组织包埋机、TK-218II 生物组织摊片、烤片机购自湖北泰维科技实业有限公司,Centrifuge 5417R 台式冷冻高速离心机购自德国Eppendorf 公司。
1.4 方法
1.4.1 动物分组与药物干预 将30 只小鼠根据随机分类法分为空白组、模型组、阳性对照组(联苯双酯滴丸125 mg/kg)、苦参碱高剂量组(苦参碱注射液2.8 mg/kg)、苦参碱低剂量组(苦参碱注射液1.4 mg/kg)。各组按照10 ml/(kg·d)剂量进行尾静脉注射,空白组和模型组注射同等剂量的葡萄糖溶液。实验期间不限进食和饮水,连续给药14 d,末次给药12 h 后,除空白组外,其余各组按12 ml/kg一次性灌胃50%乙醇,复制急性酒精性肝损伤模型,16 h 后取血和肝脏。
1.4.2 一般形态观察 在整个实验过程中,观察小鼠的体重变化、进食、饮水、毛发、精神状态、行为及死亡情况,有任何异常情况及时记录。
1.4.3 肝指数测定 4℃生理盐水漂洗肝脏,吸干水分后称重。肝脏指数(%)=肝脏重量(g)/小鼠体重(g)×100%
1.4.4 血清生化指标检测 血液样品静置2 h,冷冻离心机4℃、3 500 r/min 离心10 min,取上清液用于检测血清ALT、AST 和T-BIL。
1.4.5 肝组织的病理切片观察 肝左叶最大横截面取2~3 mm,经固定、脱水、透明、浸蜡、包埋、切片后,按照苏木精-伊红染色试剂盒步骤染色,封片后在光学显微镜下观察各组小鼠肝组织的病理变化。
1.4.6 肝组织相关指标检测 取适量肝组织样本,加入10 倍预冷生理盐水,研磨后制备成10%的组织匀浆,4℃条件下3 500 r/min 离心10 min,吸取上清液,进行蛋白定量后检测MDA、TG、SOD、CAT、GSH 水平。
1.4.7 肝细胞脂滴沉积分析 取OCT 包埋胶固定的肝组织,用冷冻切片机-20℃切至10 μm,切片用10%的中性甲醛固定,60%异丙醇漂洗,经油红O 滴染、漂洗、复染后,甘油封片。光学显微镜下观察各组肝组织脂滴分布。应用Image-Pro Plus 6.0软件半定量测定脂滴的平均光密度。
1.5 统计学方法
数据分析采用SPSS 19.0 统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步的两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组肝脏指数的变化
空白组、模型组、阳性对照组、苦参碱高剂量组、苦参碱低剂量组肝指数分别为(5.01±0.34)% 、(5.91±0.24)% 、(5.29±0.54)% 、(5.41±0.40)%和(5.51±0.25)%,经单因素方差分析,差异有统计学意义(F=8.904,P=0.001),模型组较空白组增加(P<0.05),苦参碱高剂量组、苦参碱低剂量组、阳性对照组较模型组降低(P<0.05)。
2.2 各组血清ALT、AST、T-BIL水平的变化
各组血清AST、ALT、T-BIL 相对表达量比较,差异有统计学意义(P<0.05),模型组较空白组升高(P<0.05),提示小鼠肝损伤模型复制成功。阳性对照组、苦参碱高剂量组、苦参碱低剂量组较模型组降低(P<0.05),提示苦参碱预处理可改善急性肝损伤小鼠模型的ALT、AST、T-BIL 活性。见表1。
表1 各组血清AST、ALT、T-BIL水平比较(n=6,±s)

表1 各组血清AST、ALT、T-BIL水平比较(n=6,±s)
组别空白组模型组阳性对照组苦参碱高剂量组苦参碱低剂量组F 值P 值AST/(u/L)54.38±7.58 166.98±20.37 60.43±8.33 88.25±13.31 109.17±15.81 10.017 0.001 ALT/(u/L)27.43±3.06 41.34±5.48 31.71±4.13 32.48±5.35 35.04±4.03 4.307 0.024 T-BIL/(μmol/L)2.92±1.11 38.84±10.14 13.80±8.96 22.77±7.96 25.18±5.48 16.356 0.000
2.3 各组肝组织病理学变化
空白组肝组织结构正常,肝索排列清晰整齐,无肝细胞变性、坏死,未见脂肪变性。模型组肝小叶结构不清晰,肝索杂乱排列,大量炎症细胞浸润,肝实质间出现大量细胞空洞,核固缩深染,肝细胞水肿,出现严重的脂肪变性和气球样变性。苦参碱低剂量组和阳性对照组较模型组稍有好转,苦参碱高剂量组肝脏形态趋于完整,无明显空洞,肝小叶结构清晰,肝索排列整齐,少量核固缩深染,未见明显水肿和脂肪变性。见图1。
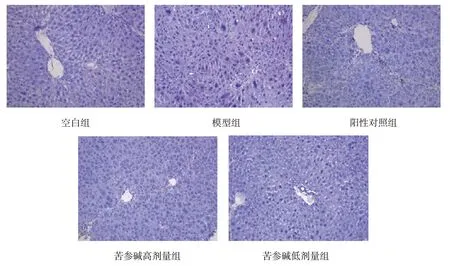
图1 苦参碱对酒精性肝损伤小鼠肝组织形态学的影响 (HE染色×100)
2.4 各组肝组织抗氧化能力的变化
各组肝组织匀浆中SOD、MDA、GSH、CAT、TG 水平比较,差异有统计学意义(P<0.05),模型组SOD、GSH、CAT 较空白组降低(P<0.05),MDA、TG 较空白组升高(P<0.05)。阳性对照组、苦参碱高剂量组的GSH、CAT、SOD 较模型组升高(P<0.05),MDA、TG 较模型组降低(P<0.05)。低剂量苦参碱预处理可提高GSH、CAT 水平,抑制肝脏中TG 水平,但模型组与苦参碱低剂量组SOD、MDA 水平比较,差异无统计学意义(P>0.05)。见表2。
表2 各组肝组织SOD、MDA、GSH、CAT、TG相对表达量比较 (n=6,±s)

表2 各组肝组织SOD、MDA、GSH、CAT、TG相对表达量比较 (n=6,±s)
组别空白组模型组阳性对照组苦参碱高剂量组苦参碱低剂量组F 值P 值SOD/(u/mg)0.26±0.02 0.16±0.04 0.23±0.05 0.24±0.03 0.20±0.03 6.025 0.007 MDA/(nmol/mg)0.76±0.10 1.13±0.25 0.83±0.18 0.86±0.16 0.93±0.22 4.002 0.025 GSH/(g/L)1.87±0.20 1.30±0.24 1.63±0.26 1.73±0.30 1.65±0.26 4.539 0.021 CAT/(u/mg)1.18±0.06 0.87±0.10 1.04±0.05 1.12±0.04 1.00±0.07 5.212 0.010 TG/(mmol/L)0.13±0.02 0.29±0.05 0.16±0.05 0.19±0.03 0.20±0.04 3.691 0.032
2.5 苦参碱对酒精性肝损伤小鼠肝组织脂滴沉积的影响
油红O 染色结果显示:空白组小鼠肝脏细胞中存在少量、小体积、分布均匀的橘红色小脂滴。模型组小鼠可见肝细胞内出现弥漫性、大小不一的橘红色脂滴,相邻肝细胞内脂滴融合,且较空白组体积增大。阳性对照组、苦参碱高剂量组、苦参碱低剂量组小鼠肝细胞内橘红色脂滴较模型组数量减少,体积减小,差异显著(见图2)。计算脂滴光密度后结果显示:空白组、模型组、阳性对照组、苦参碱高剂量组、苦参碱低剂量组肝脏脂滴光密度分别为(4.08±0.42)、(7.09±1.59)、(5.84±0.47)、(4.15±0.94)、(4.50±0.39),经单因素方差分析,差异有统计学意义(F=9.888,P=0.000)。模型组较空白组增加(P<0.05),阳性对照组、苦参碱高剂量组、苦参碱低剂量组较模型组减少(P<0.05)。

图2 苦参碱对酒精性肝损伤小鼠肝细胞脂质沉积的影响 (油红O染色×200)
3 讨论
ALD 的病理机制涉及广泛,与线粒体功能障碍、脂质过氧化、肠源性内毒素血症、Kupffer 细胞活化、免疫系统及肝炎病毒等有关[10-11]。此外,近年来有研究表明氧化应激反应在酒精性肝损伤中起到重要的推动作用[12-13]。苦参碱具有多种药理作用,临床上主要用于治疗病毒性肝炎、慢性肝纤维化以及恶性肿瘤的辅助治疗[14]。柴宁莉等[15]发现氧化苦参碱可诱导肝星状细胞凋亡,减轻四氯化碳诱导的肝纤维化。此外,有研究发现苦参碱具有抗癌作用,可下调肝癌干性基因,抑制肝癌细胞的增殖[16]。此外,苦参碱对APAP 所致的药物性肝损伤具有保护作用[17],但其在酒精性肝损伤中的作用仍不清楚,本实验旨在通过体内实验探讨苦参碱在酒精性肝损伤中的抗氧化作用。
肝脏是进行酒精代谢的主要器官,ALT 和AST作为肝细胞浆内的两种可溶性酶,在酒精代谢中起到重要作用。肝细胞受损后,细胞膜的通透性增加,导致大量可溶性酶进入血液,因此ALT 和AST 可作为肝脏损伤的敏感指标[18],能反映肝细胞的损伤程度。本研究中模型组小鼠的ALT、AST 和T-BIL 明显高于空白组,提示急性肝损伤模型复制成功,而苦参碱注射液各治疗组ALT、AST、T-BIL较模型组明显下降,且随着剂量因素比重的增大,抑制作用更明显。说明苦参碱注射液预处理能稳定肝细胞膜,抑制因肝细胞破裂、坏死而引起的血清转氨酶升高,保护肝细胞免于大量酒精摄入引起的损伤。
肝脏内TG 的积累是机体对乙醇消耗的重要反应之一,也是肝脏脂肪变性的重要特征。与空白组相比,模型组TG 水平升高,苦参碱预处理可降低肝脏中TG 水平,且随着剂量因素比重的增加,抑制作用更明显。油红O 是一种偶氮染料,可特异性的与组织中的TG 等中性脂肪结合呈小脂滴状并着色,组织内的脂滴呈橘红色[19]。本研究油红O 染色结果显示经苦参碱预处理后,小鼠肝组织中的脂滴较模型组下降,表明苦参碱可有效抑制酒精引起的小鼠肝脏脂质代谢紊乱,抑制肝脏中脂肪过度沉积,减少脂质过氧化损伤。
氧化应激指机体产生大量自由基,造成体内多种分子的氧化或硝化损伤,降低清除自由基的能力,损伤脂质、蛋白质及DNA[20]。过量的ROS 可激活肝细胞脂质过氧化,导致MDA 和其他脂质过氧化物大量生成,这可能破坏细胞膜,导致细胞的肿胀和坏死[9]。MDA 作为不饱和脂肪酸发生脂质过氧化反应生成的终末产物之一,可破坏细胞膜结构,其水平可反映自由基产生的强度,体现机体损伤的程度[21]。模型组小鼠肝组织匀浆中MDA 显著增加,表明其肝脏脂质过氧化受损严重,而苦参碱可拮抗酒精摄入引起的氧化损伤。SOD、GSH、CAT 是体内重要的抗氧化酶和非酶抗氧化剂,可直接或间接清除氧自由基,及时修复受损细胞[22]。与模型组比较,苦参碱高剂量组的SOD、GSH、CAT 水平明显提高,表明苦参碱可提高机体抗氧化能力,清除自由基,改善肝损伤。
