阿尔兹海默病患者线粒体转运RNA变异的初步研究
2022-01-13袁妮娜章瑜丁禹冷建杭
袁妮娜 章瑜 丁禹 冷建杭*
阿尔兹海默病(Alzheimer’s disease,AD),又称老年痴呆症,是一种神经退行性疾病,多发于老年或老年前期,85岁以上发病率最高,女性多于男性,预计至2050年世界上将有1.5亿AD患者[1]。AD已成为继心血管疾病、恶性肿瘤、中风之后的第4位死亡原因,目前其发病机制尚未完全阐明。有研究报道,β淀粉样蛋白(amyloid β-protein,Aβ)、神经纤维缠结以及线粒体功能障碍皆可导致AD的发病,而且三者可形成复杂的恶性循环,共同加重AD的发展[2-4]。线粒体基因组是双链环状DNA分子,全长16 569-bp,共包含37个基因,编码13种蛋白质,22种tRNA与2种rRNA[5]。线粒体基因的排列十分紧密,除了D-loop外,相邻的基因之间几乎没有任何非编码区。由于线粒体缺乏组蛋白保护,直接暴露于氧化磷酸化的环境中,其变异率远高于核基因[6]。本研究主要通过筛查AD患者的线粒体tRNA变异情况,探讨线粒体tRNA变异与AD的相关性。
1 资料与方法
1.1 临床资料 选取2017年6月至2020年6月在本院确诊为AD的患者100例,作为观察组。其中,男59例,女41例;年龄(75.3±4.2)岁;均符合2011年美国国立衰老研究院和阿尔兹海默病协会关于AD的诊断标准[7]和美国国立神经病、语言交流障碍和卒中研究所-老年性痴呆及相关疾病学会的AD诊断标准[8];排除合并严重的肝肾疾病、严重感染、恶性肿瘤者。另选取同期在本院体检的健康者50例作为对照组。其中,男35例,女15例;年龄(69.5±9.6)岁。本研究经医院医学伦理委员会批准,所有研究对象均签署知情同意书。
1.2 线粒体tRNA变异筛选 抽取所有研究对象清晨空腹静脉血5 mL,使用酚-氯仿的方法提取基因组DNA,-30 ℃保存备用。以提取的全基因组DNA为模板,进行22个线粒体tRNA基因组的扩增,所需的引物参照本课题组前期发表的论文[9]。其中,PCR的条件为95 ℃变性5 min,94 ℃ 10 s,60 ℃ 30 s,72 ℃ 1 min,共30个循环,最后72 ℃ 5 min作为延伸。PCR产物经过琼脂糖凝胶电泳分析后纯化,并用Big Dye Terminator Cycle测序反应试剂盒处理,美国应用生物系统公司(Applied Biosystems,ABI)3700 DNA自动测序仪直接测序分析,所得的结果用DNA STAR软件与人类线粒体DNA标准剑桥序列(GenBank No. NC_012920)进行比对[10],筛选变异位点。同时,对50例健康对照个体进行线粒体tRNA基因的PCR扩增和测序,方法同上。
1.3 种系进化保守分析 使用人、鼠[11]、牛[12]和非洲爪蟾[13]等4个物种的线粒体DNA序列进行种系进化保守分析,然后在16个哺乳动物之间进行进一步的分析,计算保守性指数(conservation index,CI),以CI≥75%视为有功能学意义。
2 结果
2.1 AD相关的线粒体tRNA变异筛选 共发现了5个可能的致病性突变:tRNAIleA4263G,tRNAAlaT5655C,tRNACysT5802C,tRNAGluA14693G以及tRNAThrG15927A,见图1。但是,这些突变在对照组中均未发现。其中,1例AD患者携带A4263G突变(1%),2例携带T5655C突变(2%),1例携带T5802C突变(1%),2例携带A14693G突变(2%),2例携带G15927A突变(2%)。
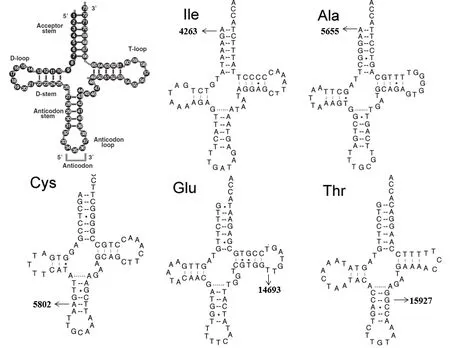
图1 AD相关的线粒体tRNA变异位点
2.2 AD相关的线粒体tRNA变异特点分析 经过线粒体tRNA二级结构分析发现,在这些突变中有2个变异发生在线粒体tRNA接收臂上(tRNAIleA4263G和tRNAAlaT5655C),有2个变异发生在反密码子环上(tRNACysT5802C和tRNAThrG15927A),有1个变异发生在TψC环(tRNAGluA14693G)。有3个突变破坏了原有的A-T碱基对(A4263G,T5655C和T5802C),1个突变破坏了原有的C-G碱基对(G15927A)。进一步的种系进化保守分析发现,这些突变在不同的物种之间都是高度保守的,提示具有功能学意义,见表1。
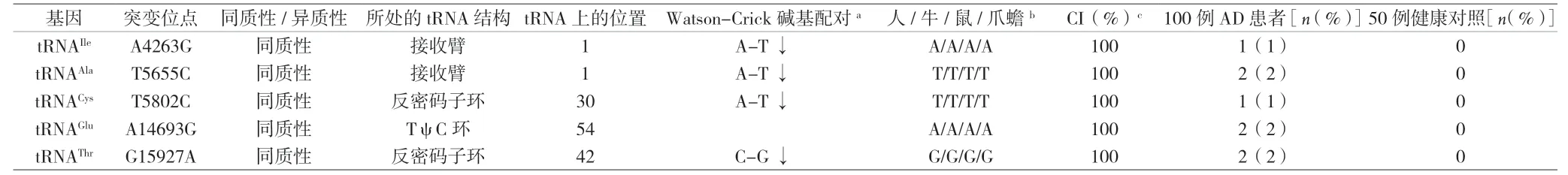
表1 AD有关的线粒体tRNA变异分析
3 讨论
目前,全世界约有4700万AD患者,65岁以上的老年人群中约有1/8患有AD,相关的医疗费用高达数十亿美元。随着人类平均寿命的不断提高,AD对世界构成了巨大的公共卫生挑战。
成年人大脑的比重虽只占2%,但消耗将近20%的氧气,为满足如此巨大的能量需求,大脑配置了巨大的线粒体容量,因此大脑正常功能极易受到线粒体功能障碍的影响,线粒体功能损伤在AD的发生发展中起着重要作用[14-16]。本研究对杭州地区的100例AD患者和50例健康对照个体进行了线粒体tRNA的全基因组突变筛查,结果提示AD患者的线粒体tRNA突变频率高于健康对照组。在这些突变中,位于接收臂上的突变有两个,分别为A4263G和T5655C。事实上,A4263G突变位于线粒体tRNAIle5’起始端,该位点的突变影响了tRNAIle的转录及RNase P 5’端的加工[17]。A4263G突变会显著降低tRNAIle的稳定性和线粒体蛋白合成,表明A4263G突变可能会引起线粒体功能损伤。此外,线粒体T5655C突变位于线粒体tRNAAla的5’末端。功能学研究表明,该突变导致线粒体RNase P对tRNAAla前期5’端剪切效率下降30%,ATP水平显著下降,而ROS水平明显上升,表明T5655C突变可能引起线粒体功能障碍[18]。
同质性的T5802C突变则位于tRNACys基因的反密码子环上,反密码子环承担着密码子与反密码子的相互作用以及氨基酸搬运工作[19]。从结构上看,线粒体T5802C变异破坏了原有高度保守的碱基对(30A-40G)。因此,有理由相信该突变会导致线粒体tRNA代谢障碍,进而导致线粒体蛋白合成受阻。此外,G15927A突变破坏了原有的高度保守的Watson-Crick碱基配对(28C-42G)。前期研究表明,G15927A突变导致线粒体tRNAThr的氨基酰化水平下降39%,严重影响了线粒体蛋白合成,尤其是线粒体ND1和CytB的表达[20]。
A14693G突变发生在tRNAGlu基因54位点上,该位点在进化上高度保守。与核基因编码的tRNAs一样,线粒体tRNA也要经过转录后修饰,在通常情况下tRNAGlu的54位的碱基常需要经过修饰才能维持tRNA的二级结构和功能的稳定性[21]。因此,A14693G变异可能会影响tRNAGlu的空间结构和功能稳定性,使tRNA的代谢功能障碍,引起线粒体功能损伤[22]。
综上所述,线粒体tRNAIleA4263G,tRNAAlaT5655C,tRNACysT5802C,tRNAGluA14693G以及tRNAThrG15927A突变会影响线粒体tRNAs的代谢,导致线粒体蛋白合成受阻、功能损伤,进而参与AD的发病进程。由于本研究的样本量较少,后续还需扩大样本量来进行进一步研究。
