大菱鲆趋化因子CCL34基因的鉴定及其响应细菌感染的表达特征❋
2022-01-13宋欢欢李雨晴赵寿聪
宋欢欢, 张 羽, 张 佩, 李雨晴, 赵寿聪, 李 超, 傅 强
(青岛农业大学海洋科学与工程学院, 山东 青岛 266109)
免疫系统为生物体抵御外来致病微生物提供了一种有效的防御机制。鱼类在进化上是介于仅具有天然免疫系统动物和主要依赖获得性免疫系统动物的中间类群[1]。相对于哺乳动物,鱼类在抵御外来病原微生物侵扰时,先天性免疫系统发挥主要作用且几乎不受温度的影响[2]。研究表示,鱼类具有一个包含信号分子、细胞因子和趋化因子的网络,从而能够控制和调节先天性和获得性免疫[3]。当受到致病因子刺激活化后,淋巴细胞、单核细胞和中性粒细胞等会分泌一种小分子活性多肽物质,分子量约8~14 kDa,含90~100个氨基酸,此即为趋化因子[4-5]。它们能够促进白细胞迁移到感染部位[6],调节免疫应答和细胞分化,是关键的免疫调节因子,充当天然免疫和适应性免疫之间的桥梁[7]。近年来的研究发现趋化因子参与了多种机体反应活动, 如炎症反应、细胞间通讯、抗原呈递、血细胞发育和转移及病毒侵染和伤口愈合等[8-11]。除了在免疫中发挥作用,它们还参与血管再生[12],神经发育[13],器官发生[14]与生殖细胞迁移和正常生长发育[15]。大多数趋化因子含有四个保守的半胱氨酸残基,根据前两个半胱氨酸残基的位置,将趋化因子分为四个亚族:CC、CXC、C和CX3C,其中CC是最大的亚族[16]。
近年来,鱼类中很多趋化因子被分离和鉴定出来,大多数鱼类的趋化因子基因在免疫器官或组织如头肾、脾脏中表达水平较高,推测它们在先天免疫中发挥作用[17]。最近几年对鱼类趋化因子CXC型和CC型进行了大量的研究,然而对于鱼类趋化因子基因功能的研究尚未成熟。鱼类中第一个被鉴定的 CC 型趋化因子是虹鳟鱼(Oncorhynchussmykiss)的 CK-1[18],从虹鳟鱼中鉴定出来的CC型趋化因子CK1和CK2在炎症反应中起一定的作用。目前为止,大西洋鳕鱼(Gadusmorhua)[19]、虹鳟鱼(O.mykiss)[19]、金头鲷(Sparusaurata)[20]和大黄鱼(Larimichthyscrocea)[21-22]中鉴定出很多 CC 型趋化因子。目前比较系统全面的趋化因子鉴定发现斑马鱼有62个CC趋化因子[10-11],斑点叉尾鮰(Ictaluruspunctatas)有64个CC趋化因子[23-25]。在已发现的35种CC趋化因子中,有8种仅在鱼类中有报道[25],分别是CCL32、CCL33、CCL34、CCL35、CCL36、CCL38、CCL39和CCL44。到目前, 在大菱鲆(S.maximus)中已经发现了3个CXC趋化因子, 3个CC趋化因子和3个趋化因子受体CCR3、CCR9和 CXCR4[26-32]。
大菱鲆是一种重要的低温适应冷水性海水养殖鱼类,在过去的十年里,中国养殖年平均产量为5×104~6×104t,约占世界水产养殖大菱鲆总产量的80%[33]。其生长迅速,肉质好,耐低温,因此能够迅速得到产业化推广。然而,随着大菱鲆养殖集约化程度不断提高、养殖密度不断增大,大菱鲆病害频发,各种病毒性疾病、细菌性疾病和寄生虫病的报道日渐增多[34-36]。通常使用抗生素来防治疾病,但其具有强烈的副作用,会使病原菌产生耐药性,同时引起环境污染。目前,分子生物学技术的兴起,为增强养殖鱼类的免疫力和提高抗病能力提供了新的手段。本研究从大菱鲆基因组和转录组数据库中鉴定出大菱鲆的一种趋化因子CCL34,同时进行系统发育分析和共线性分析,确定此趋化因子CC的分类地位。此外,利用实时荧光定量PCR(qRT-PCR)技术,分析大菱鲆趋化因子CCL34在健康的大菱鲆组织及被鳗弧菌和无乳链球菌感染的大菱鲆肠道和皮肤组织中的表达情况。
1 材料与方法
1.1 实验用鱼
大菱鲆购自黄海所养殖基地,体重250~500 g,运至青岛农业大学蓝谷校区实验室喂养1个月,水温16~20 ℃。取正常大菱鲆组织(皮肤,血液,肝脏,肠,鳃,脾脏,脑和头肾)及被鳗弧菌和无乳链球菌分别感染的大菱鲆组织(皮肤和肠道),立即放入液氮中冻存,然后保存在-80 ℃冰箱中,用于后续总RNA提取。
1.2 实验方法
1.2.1 序列鉴定 在NCBI (https://www.ncbi.nlm.nih.gov/)、Ensemble (http://www.ensemble.org)和ZFIN(http://zfin.org/)中下载人(Homosapiens)、鼠(Musmusculus)、鸡(Gallusgallus)、斑马鱼(Daniorerio)、斑点叉尾鮰(Ictaluruspunctatus)、河豚(Takifugurubripes)、日本青鳉(Oryziaslatipes)、罗非鱼(Oreochromisniloticus)、牙鲆(Paralichthysolivaceus)等趋化因子CCL的mRNA序列和蛋白序列。基于同源基因的相似性,将这些序列放到已构建的大菱鲆基因组和转录组数据库中blastn比对[37-38],在此基础上利用Clustal Omega(https://www.ebi.ac.uk/Tools/msa/clustalo/)去除初始序列中的重复序列,根据基因位置的唯一性和可信度初步筛选大菱鲆趋化因子CC。从大菱鲆转录组数库中提取目标cDNA序列,用ORF finder(https://www.ncbi.nlm.nih.gov/orffinder/)预测目标序列所编码的蛋白序列,BLASTP比对NCBI的非冗余蛋白数据库。通过分子结构分析工具SMART(http://smart.embl-heidelberg.de/smart/set_mode.cgi?NORMAL=1)确定序列的特征性功能结构域,并通过BLASTP预测的保守结构域对其进行验证。SignalP(http://www.cbs.dtu.dk/services/SignalP/)网站用于分析目标序列信号肽。其三维结构由Phyre2 服务器建立(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)。为了确定表达蛋白质的蛋白质-蛋白质相互作用(PPI)网络,使用STRING软件11.0(https://string-db.org/cgi/input?sessionId=beUB0fx2FZid&input_page_active_form=single_sequence),以0.4的置信度分析了蛋白质-蛋白质的网络表达形式。
1.2.2 引物设计 参照从大菱鲆基因组和转录组数据库中提取的趋化因子CCL34cDNA序列,根据该趋化因子的开放阅读框设计一对特异引物(CCL34F/R,见表1)用于实时荧光定量PCR(qRT-PCR)来分析该趋化因子的表达,以大菱鲆cDNA为模板,PCR产物大小为183 bp。

表1 实验所用引物序列
1.2.3 系统发生分析 利用分子进化遗传学分析(MEGA 7)软件包对预测的大菱鲆趋化因子CCL34蛋白序列与在各种数据库中搜索并下载下来的人、鼠、鸡、斑马鱼、斑点叉尾鮰、河豚、日本青鳉、罗非鱼、牙鲆等生物的趋化因子CCL蛋白序列一同构建系统进化树,用Muscle 程序(通过对数预期进行多序列比较)比对氨基酸序列同源性,数据分析采用泊松定理P选项,重复1 000次,计算方法为Maximum Likelihood,用自展内部分支法来评定系统进化树的可靠性。
1.2.4 共线性分析 基于大菱鲆CCL34和斑马鱼,牙鲆的相邻基因比较,共线性分析可进一步确定目标序列是大菱鲆趋化因子CCL34。通过FGENESH程序从大菱鲆基因组中预测CCL34相邻基因的蛋白质序列,通过BLASTP比对NCBI非冗余蛋白数据库鉴定蛋白质序列,并用UniProt知识库(https://www.uniprot.org/)进行注释。从Genomicus(http://www.genomicus.biologie.ens.fr/genomicus-94.01/cgi-bin/search.pl)网站中确定其他物种CCL34相邻蛋白质序列的保守共线性,共线性分析结果图见图3。
1.2.5 细菌感染及样品收集 为了研究CCL34在宿主防御中的免疫作用,选择革兰氏阴性菌鳗弧菌(Vibrioanguillarum)和革兰氏阳性菌无乳链球菌(Streptococcusagalactiae)分别感染平均体重为250~500 g的大菱鲆。先进行预感染,选择有明显症状的鱼体,分离两种菌,进行生化鉴定。从单菌落中分离细菌,接种于LB肉汤培养基,过夜培养(28 ℃,180 r/min)。
选择健康的大菱鲆在5×107CFU/mL浓度的鳗弧菌溶液中浸泡感染,分别在2、6、12、24 h四个时间点解剖鱼体,取皮肤、肠道组织。选择健康的大菱鲆在5×106CFU/mL浓度的无乳链球菌溶液中浸泡感染,分别在2、4、8、12 h四个时间点解剖鱼体,取皮肤、肠道组织放入液氮中冻存,保存在-80 ℃冰箱中。
1.2.6 CCL34趋化因子的表达分析 从上述冻存的大菱鲆组织(1.1和1.2.5)中,用Trizol试剂提取总RNA。按照FastKing cDNA第一链合成试剂盒(快速反转录试剂盒)(Invitrogen, USA)的说明书进行大菱鲆cDNA的合成,特异引物(CCL34F/R,见表1)用于实时荧光定量PCR(qRT-PCR)表达分析,以8种健康大菱鲆组织(肝脏,脾脏,头肾,皮肤,肠,血液,鳃,脑)cDNA为PCR反应模板,模板稀释10倍,每种组织做3个平行样,以18sRNA作为内参基因。本研究采用的是 BIO-RAD CFX96荧光定量 PCR仪 (Bio-Rad Laboratories, Hercules, CA), 每次反应均为10 μL 体系: TB Green Premix Ex Taq II 5 μL, 上下游引物各0.4 μL, cDNA模板0.8 μL。反应条件采用三步法: 95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 32 s, 40 个循环; 95 ℃ 15 s, 60 ℃ 1 min, 95 ℃ 15 s。
数据处理: 用Relative Expression Software Tool (REST)分析结果来捕获P值<0.05的显著性表达。用肠的Ct值(肠的Ct值最大,表达水平最低)作为对照来确定大菱鲆健康组织的基因表达模式;用大菱鲆健康组织(肠,皮肤)的Ct值作为对照来确定被鳗弧菌和无乳链球菌感染后不同时间点的表达模式。采用2ΔΔCT方法计算相对基因表达倍数变化。mRNA表达水平被标准化到同一样本的18S RNA基因的表达水平。所有定量数据以平均值±标准误差表示。
2 结果
2.1 CCL34序列鉴定
该趋化因子的全长cDNA序列共885 bp,包括1个327 bp的5’非编码区(UTR),1个312 bp的开放阅读框(ORF编码103个氨基酸)和1个246 bp的3’非编码区。成熟肽第31、32位为两个靠在一起的半胱氨酸,该特征证明该趋化因子是CC趋化因子。通过基因组序列扩增发现该CCL34基因含有4个外显子和3个内含子。其蛋白质三维结构(见图1)与其它CC趋化因子一致,在N端附近有两个保守的连续半胱氨酸残基。

图1 CCL34蛋白质三维结构
2.2 系统发生分析
用分子进化遗传学分析(MEGA7)软件包对大菱鲆趋化因子CCL34构建的进化树结果如图2所示。系统进化树显示出几种鱼类的CCL34分为两支,一是与斑马鱼、斑点叉尾鮰CCL34a聚为一支,另一支则与斑马鱼、斑点叉尾鮰CCL34b聚为一支。通过图2可以看出大菱鲆趋化因子CCL34和牙鲆先聚到一起,置信度是100,然后与斑马鱼和斑点叉尾鮰的CCL34a聚到一起,置信度是57,最终与斑马鱼和斑点叉尾鮰的CCL34b聚到一起,因此把该趋化因子命名为大菱鲆CCL34。
2.3 共线性分析和基因结构分析
构建系统进化树初步鉴定了趋化因子CCL基因为大菱鲆趋化因子CCL34基因,共线性分析将对CCL34基因的鉴定提供更加有力的证据。结果如图3所示,大菱鲆趋化因子CCL34基因位于7号染色体上,其上游基因有tnr,下游基因有rbp1、prmt5、cdh24、rem2、ctnnd2b和astn1。大菱鲆趋化因子CCL34基因附近与牙鲆趋化因子CCL34a基因附近、斑马鱼趋化因子CCL34a.3、CCL34a.4基因附近共有的基因是tnr、rbp1、prmt5、cdh24、rem2、ctnnd2b和astn1。结果证明,从大菱鲆基因组数据库blast比对预测的大菱鲆趋化因子CCL34基因,与斑马鱼、牙鲆、斑点叉尾鮰某些趋化因子CCL34基因亲缘关系比较近,序列比较保守,进一步鉴定了从数据库中提取的大菱鲆趋化因子CCL基因可以命名为CCL34基因。

(分支上的数值代表 1 000 bootstrap 的置信度。GenBank 序列号在物种名右侧列出。大菱鲆CCL34用“●”标注。Numbers at branch nodes represent the confidence level of 1 000 bootstrap replications. The accession numbers of GenBank were shown on the right of species names. Turbot CCL34 were marked by “●”.)
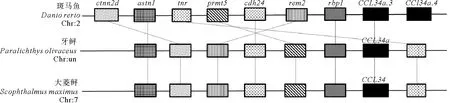
(基因全称Full gene names:ctnnd2b:Catenin (cadherin-associated protein), delta 2b;astn1:Astrotactin 1;tnr:Tenascin R;prmt5: Protein arginine N-methyltransferase 5;cdh24:Cadherin 24;rem2:RAS (RAD and GEM)-like GTP-binding 2;rbp1:Retinol binding protein 1b, cellular;CCL34a.3:Chemokine (C-C motif) ligand 34a, duplicate 3;CCL34a.4:Chemokine (C-C motif) ligand 34a, duplicate 4; CCL34:CC chemokine isoform 4。共线性分析所需序列信息通过NCBI和Ensembl网站获取,相同颜色并用短线相连的方格代表同一种基因,趋化因子CCL34用黑色方格标注。These syntenies were generated with the information obtained from the NCBI and Ensembl. Squares with same color and connected to represent the same gene. CCL34 are marked with black squares.)
2.4 大菱鲆趋化因子CCL34 在健康组织中的表达分析
利用qRT-PCR方法检测大菱鲆趋化因子CCL34基因在健康组织中的表达情况,发现它在所检验的健康组织中均普遍表达(见图4)。以肠作为基准,倍数为1倍,鳃的倍数为1.50,脾脏的倍数为2.70,血液的倍数为7.34,脑的倍数为44.57,皮肤的倍数为64.13,肝脏的倍数为233.85,肾脏的倍数为1 156.33。大菱鲆趋化因子CCL34基因在肾脏组织中表达水平最高,其次在大菱鲆肝脏中具有较高表达水平,大菱鲆趋化因子CCL34基因在皮肤、脑中表达水平处于中等,然后是在鳃、脾脏和血液中的表达量偏低,而在肠中表达量最低。实验结果表明趋化因子CCL34基因在健康大菱鲆组织中普遍表达。
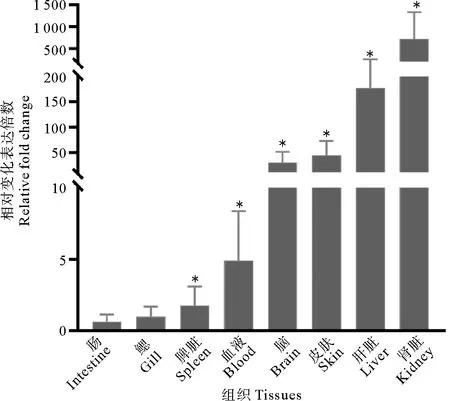
(以健康组织为对照组, 表示与对照组差异显著 (p<0.05). Health tissue was chosen as the control group, donates significant compared with control (p<0.05).)
2.5 细菌感染后大菱鲆CCL34在肠和皮肤中的表达分析
在鳗弧菌感染后,CCL34在皮肤2 h内,下调1.40倍,到6 h显著下调4.41倍,到12 h显著下调8.38倍,到24 h下调1.69倍。与皮肤不同,CCL34在肠道中显著上调且上调趋势越来越明显,它在2 h内显著上调3.167倍,6 h后显著上调20.19倍,12 h后显著上调35.40倍,24 h后显著上调44.53倍。综上CCL34在皮肤中呈现持续下调的趋势,在肠道中呈现持续上调的趋势。皮肤中大菱鲆趋化因子CCL34在12 h表达量最低,而在肠道中表达量随时间推移逐渐增大(见图5)。
无乳链球菌感染后,观察到在皮肤中呈现下调表达趋势,2 h显著下调7.93倍,到4 h下调1.99倍,8 h显著下调8.160倍,到12 h显著下调2.72倍。而在肠道中呈现显著上调趋势,2 h内显著上调42.34倍, 4 h显著上调30.253倍,8 h内显著上调37.16倍,到12 h显著上调94.41倍。在感染无乳链球菌的过程中,发现在皮肤中呈现持续下调的趋势,在肠道中呈现持续上调的趋势,且在2、4、8 h内上调差异显著(P<0.05)。皮肤中的基因表达在8 h表达最低,肠道在12 h时基因表达量最高(见图6)。

(以健康组织为对照组, 表示与对照组差异显著 (p<0.05). Health tissue was chosen as the control group, donates significant compared with control (p<0.05).)
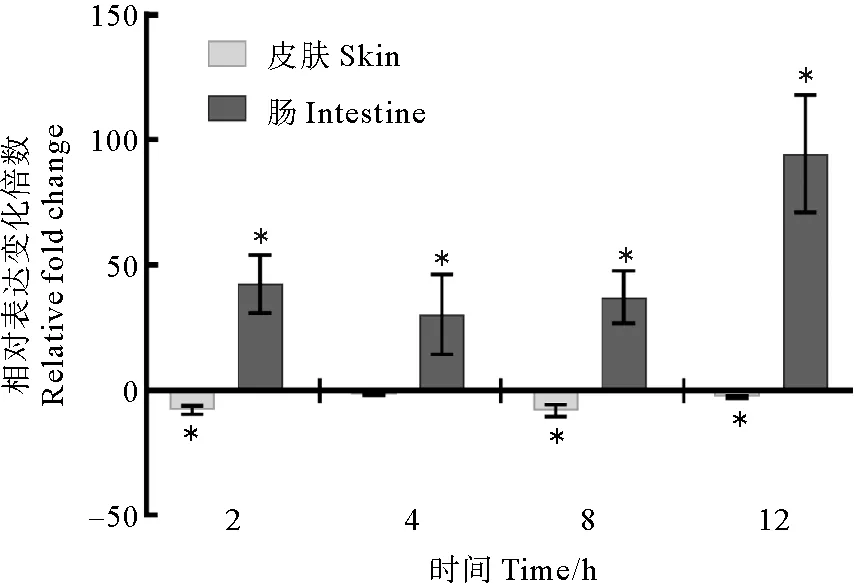
(以健康组织为对照组, 表示与对照组差异显著 (p<0.05). Health tissue was chosen as the control group, donates significant compared with control (p<0.05).)
2.6 CCL34的蛋白质-蛋白质相互作用(PPI)网络分析
PPI网络分析结果揭示了CCL34可能参与的潜在的相互作用蛋白和免疫相关信号通路。一方面,与趋化因子配体联系最密切的是基因是趋化因子配体和受体(见图7)。如图7所示,CCR7和CCR9a都被预测为相互作用的基因,这表明CCL34与CCR7和CCR9a在大菱鲆中可能存在潜在的互作关系。此外,还观察到一些免疫相关基因与趋化因子CCL34互作,如cxl(CXL1)和gpr(GPR171)。
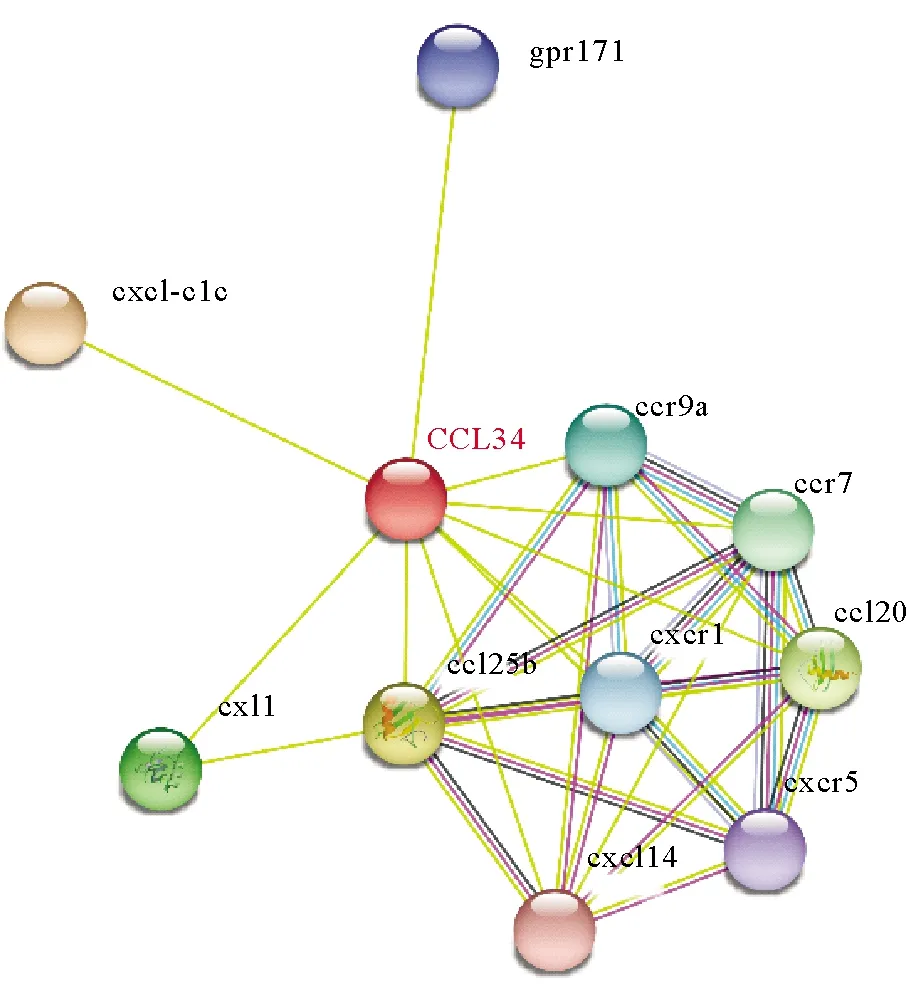
图7 蛋白质-蛋白质相互作用网络(PPI)
3 讨论
本实验从构建的大菱鲆基因组和转录组数据库中筛选到一个大菱鲆趋化因子CCL,系统进化树显示(见图2),该趋化因子与鱼类的亲缘关系比较近,先与斑马鱼和斑点叉尾鮰的CCL34a聚到一起,最终与斑马鱼和斑点叉尾鮰的CCL34b聚到一起。通过与斑马鱼、牙鲆的共线性分析对该趋化因子进一步鉴定(见图3),发现其序列比较保守,因此把该趋化因子命名为大菱鲆CCL34。
目前,对于鱼类趋化因子CCL34的功能研究依旧很少。但根据一些其它趋化因子CCL的相关研究可以推测大菱鲆趋化因子CCL34可能参与免疫相关过程。例如,在关于斑点叉尾鮰趋化因子CCL的研究中显示,趋化因子CCL可能在鱼的免疫反应中发挥重要作用。当爱德华氏菌和柱状黄杆菌感染斑点叉尾鮰后,趋化因子CCL33、CCL34、CCL36基因显著表达;在迟缓爱德华氏菌感染后,CCL19a.2在易感鱼类中表达水平极高,达200倍以上。此外,CCL19a.1、CCL20a.3和CCL34b.1在易感鱼类中的表达水平也较高,达20倍以上。这些表达模式对趋化因子CCL的功能分析奠定基础[25]。大菱鲆趋化因子CCL19以一种依赖于保守的DCCL基序的方式招募白细胞并增强宿主免疫防御。为了检测rSmCCL19在病毒和细菌感染时是否对宿主免疫反应有任何影响,向大菱鲆腹腔注射rSmCCL19后,用病毒病原体巨细胞病毒活细菌病原体迟缓大肠杆菌感染大菱鲆,在不同时间点检测病毒和细菌在肾脏内的扩散情况,发现rSmCCL19处理的鱼在所有检测时间内回收的细菌细胞数量都显著低于对照鱼,说明rSmCCL19增强了宿主对病毒和细菌感染的抵抗力。将注射rSmCCL19后的大菱鲆头肾作为样品进行实时荧光定量,结果显示其对一些基因如L-1b、IL-8、IL-17A/F、IL-22、IRF-5、IRF-7、IRF-8、Mx和MHCIIα等均有明显的诱导作用。这些结果与rSmCCL19对病原体感染的增强作用是一致的[39]。在大菱鲆中,IRF-5、IRF-7、IRF-8调节干扰素依赖的免疫反应,这3个基因被病毒和poly I: C上调,这表明它在抗病毒感染中发挥作用[40-42]。这些基因的表达增加,再加上Mx和NKEF,这两个基因是与抗病毒防御相关的先天免疫反应的关键参与者,可能至少在一定程度上解释了rSmCCL19处理的鱼减少病毒感染的原因。SmCCL19诱导的免疫应答可能导致体内注射rSmCCL19后对病毒和细菌的抵抗力增强[43]。趋化因子CCL可以对细菌产生反应,表现出抗菌活性,募集白细胞,在鱼类免疫系统中发挥重要作用。在一项研究中,用qRT-PCR方法检测许氏平鲉感染鳗弧菌后0、4、8、12、24、48 h肝、脾脏组织CCL25mRNA的表达。结果表明,许氏平鲉CCL25基因在肝脏中的mRNA表达在24 h后开始显著升高(p<0.01),是0 h的11倍,48 h后开始下降(p>0.05)。在脾脏,CCL25mRNA的表达水平在4 h(46倍,p<0.01)和8 h(6倍,p<0.05)均显著高于0、12 h后表达水平恢复到正常水平,与0 h相比,SsCCL25mRNA的表达水平在4 h(46倍,p<0.01)和8 h(6倍,p<0.05)显著升高。通过检测CCL25 mRNA的组织分布和对细菌刺激的时间表达反应,揭示许氏平鲉CCL25可能参与免疫应答。有研究表明,鲶鱼在感染ICTALURI爱德华氏菌后,CCL19基因的表达显著上调[25],这可能表明CCL19在鱼类免疫活动中起重要作用。有研究表明CCL28是一种广谱抗菌趋化因子,在粘膜组织中表达,可从唾液和牛奶中大量回收[40]。CCL28的C末端区域是其抗菌活性的重要决定因素。
本研究结果显示趋化因子CCL34基因在大菱鲆组织中普遍表达,在肾脏中表达水平最高,其次是肝脏和皮肤。结果说明大菱鲆趋化因子CCL34基因具有较高的组织特异性,可能与免疫机制有关。大菱鲆趋化因子CCL34基因在多个组织中均有表达,并且在细菌感染后基因表达变化显著,说明大菱鲆趋化因子CCL34可能参与机体内的免疫应答。其蛋白质-蛋白质相互作用网络分析(见图7)显示,大菱鲆趋化因子CCL34可能与其他趋化因子配体和受体联系在一起参与机体的免疫反应,如CCL25b、CCR1、CXCR1等,也可能与其他的免疫相关基因一起参与一些与免疫相关的信号转导,如gpr171、cxl1等。鱼类终生生活在水体环境中,其粘膜持续暴露于各种病原及物理化学有害物质中,是鱼类感染的重要部位,也是抵御病原菌附着和入侵的第一道防线。粘膜免疫系统主要由肠道、皮肤和鳃相关淋巴组织构成[44]。肠道构成最大的体表面积不断地接触外界的病原菌,并且在免疫防御炎症反应和病原菌感染方面起到关键作用[45]。鱼类的皮肤表皮主要由上皮细胞组成,其间分布有粘液细胞和囊状细胞。鱼类上皮组织中含有大量的粘液细胞、巨噬细胞和各类淋巴细胞,与其他活性物质构成了抵御病原微生物感染的有效防线。例如, 虽然在血清中没有检测到抗体, 但皮肤黏液中的抗体滴度很高, 所以获得很高的免疫保护[46]。为了揭示趋化因子CCL34在大菱鲆黏膜免疫中的作用,选取细菌感染后黏膜组织中肠道和皮肤,对其表示模式进行了研究。实验结果表明,被鳗弧菌和无乳链球菌感染后,皮肤中的表达水平持续下调,鳗弧菌和无乳链球菌逐渐感染鱼体,加剧鱼体的病理损伤,抵抗先天性免疫反应。在鳗弧菌和无乳链球菌感染过程中,肠道基因表达水平显著上调,说明肠道粘膜组织在大菱鲆非特异性免疫中可能发挥重要的作用。
综上所述,本研究推测大菱鲆趋化因子CCL34基因与大菱鲆免疫反应有关,起到免疫防御的作用,为进一步研究大菱鲆趋化因子CCL34的功能奠定了一定的基础。
