来源于五加科中药通过调节肠道菌群发挥药理作用的研究进展
2022-01-13杨娅楠吴崇明
杨娅楠,张 芳,吴崇明
来源于五加科中药通过调节肠道菌群发挥药理作用的研究进展
杨娅楠,张 芳,吴崇明*
中国医学科学院 北京协和医学院药用植物研究所 药理与毒理研究中心,北京 100193
近年来,五加科药用植物由于其广泛的药理作用和保健功能,引起人们的广泛关注。虽然对其药理作用的相关研究众多,但是揭示其与肠道菌群相关性的研究相对较少,并且存在研究不够透彻、单体成分研究不足的现象,从而造成人们对其药理作用与肠道菌群之间的关系缺乏系统性的认识。以五加科药用植物(中药),主要是人参、三七为中心,回顾其历代研究、功效、活性成分及药理作用,总结其提取物及皂苷、多糖等单体成分对肠道菌群的调节作用,并将该调节作用与相关药理作用进行关联,旨在揭示人参、三七调节身体机能、促进人体健康的机制,为中药与肠道菌群的相关研究提供新的认识,提示五加科植物具有开发成新型益生元的潜力。
五加科;人参;三七;肠道菌群;益生元
五加科(Araliaceae)植物为双子叶植物,主要为灌木或乔木,也有一部分攀缘植物和草本植物。分布在中国的五加科植物约有22个属,160种,已知可供药用的有114种,其中,人参、三七、西洋参、竹节参、楤木等属于珍稀名贵药材,通草(通脱木的茎髓)、五加皮、刺五加等都是传统的中药材。《本草纲目》中就有关于人参、三七等的记载,《神农本草经》中也将人参、五加皮等列为上品,可“轻身益气,延年益寿”。现代药理研究表明,源于五加科的中药对肾病[1]、心血管疾病[2]、糖尿病[3]、肿瘤[4]等多种疾病具有调节改善作用。其中人参具有抗炎[5]、抗氧化[6]、抗抑郁[7]、改善代谢[8]等多种药理作用。三七具有体外抗炎活性[9],被应用于心脑血管疾病[10]和糖尿病肾病[11]的治疗。刺五加也具有抗氧化应激[12]、抗焦虑[13]、神经保护[14]等多种作用,由此可见,五加科中药对人类健康具有积极影响。
五加科中药中丰富的化学成分是其发挥药理作用的物质基础。其中皂苷类成分是人参、三七、刺五加中的主要化学物质,具有抗炎、抗氧化应激、抗抑郁、促进代谢、保肝护肝等多种药理作用。此外,人参、三七、刺五加的总提取物以及其多糖、黄酮类成分也介导其药理作用的发挥。它们的具体化学成分及药理作用见表1。
表1 五加科中药(人参、三七、刺五加)提取物及其活性成分药理作用
Table 1 Pharmacological effect of extracts and active compounds of traditional Chinese medicines (Ginseng Radix et Rhizoma, Notoginseng Radix et Rhizoma, Acanthopanacis Senticosi Radix et Rhizoma seu Caulis) from Araliaceae
类别提取物/活性成分药理作用参11考文献 总提取物人参提取物改善代谢15 酶解红参提取物神经保护16 三七提取物抗菌、抗病毒17 三七叶提取物抗氧化18 三七花提取物抗炎、免疫调节19-20 刺五加提取物抗癌21 刺五加根、树皮提取物抗炎、免疫调节22 皂苷人参皂苷抗炎、免疫调节23 人参皂苷Rb1改善代谢3 三七总皂苷抗氧化、抗癌、改善代谢24-26 三七中各类皂苷抗抑郁27 刺五加皂苷抗炎、免疫调节28 刺五加皂苷B、E抗癌29 刺五加皂苷B抗氧化12 多糖韩国红参酸性多糖抗炎、免疫调节30-31 人参多糖抗癌、抗氧化32 三七粗多糖抗癌33 发酵三七多糖抗氧化34 刺五加多糖抗癌、抗氧化、抗炎35-36 黄酮三七总黄酮抗菌、抗病毒、抗氧化37-39 人参黄酮抗氧化40 挥发油人参挥发油神经保护、抗氧化、抗癌41-43
益生元是指宿主微生物选择性利用的具有健康益处的底物,具有明确性、安全性和稳定性的特征[44],已经确认存在的益生元物质主要有半乳糖和果聚糖[45]。目前,对于益生元的开发,主要聚焦在机体摄入的成分中,即摄入的食物或药食同源物质中的功能性成分促进有益菌群的生长和有益代谢物的产生,这些微生物或其代谢物反过来对宿主有直接的益处,如保护肠道免受病原体的侵害并保持肠道生态系统的平衡[46]。多项研究表明,益生元可以缓解许多与免疫系统[47]、癌症转移[48]、2型糖尿病[49]和肥胖相关的疾病[50]。因此,开发稳定、安全、有效的益生元对于人类健康事业具有重大意义。
肠道菌群是指寄生在宿主肠道内的微生物群。正常状态下,机体内微生物的组成和丰度呈现动态平衡,共同维持宿主的身体健康。但在应激状态或致病条件的刺激下,肠道菌群发生紊乱,从而与机体的病理状态相关联。近些年,随着肠-脑轴[51]、肠-肺轴[52]、脑-肠-肾轴[53]等研究的深入,发现肠道菌群在人体多种疾病的发生发展中均发挥着不可忽视的作用。而五加科植物可能通过调节肠道菌群发挥其药理作用,具有开发成新型益生元的潜力。
本文系统性地回顾了五加科中药人参、三七、刺五加对肠道菌群的调节作用,旨在揭示其药理作用的发挥与调节肠道菌群之间的联系,从而为五加科中药药理作用机制的阐释以及开发成新型益生元的潜力提供理论与科学依据。
1 五加科中药提取物及其活性成分对肠道菌群的影响
1.1 人参提取物及其活性成分对肠道菌群的调节作用
1.1.1 人参提取物 吕宁[54]通过实验证明,当人参水煎液与人源肠道菌共温孵育时,可明显增加变形菌门(Proteobacteria)的丰度,减少拟杆菌门(Bacteroidetes)的降低,对厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)无明显影响;当人参水煎液与鼠源肠道菌共温孵育时,则显著降低了拟杆菌门、变形菌门和放线菌门的丰度,对厚壁菌门的影响不明显。由此可见,人参提取物对人体和鼠类的肠道菌群均有一定的调节作用。孙艺凡等[55]也证明,长期服用人参提取物有利于大鼠的肠道健康,主要体现在上调益生菌属如双歧杆菌属、异杆菌属、乳酸菌属、梭菌属和副萨特氏菌属等丰度,下调致病菌属如丁酸弧菌属、副拟杆菌属、另枝菌属、、和螺杆菌属等丰度,通过这种调节作用,使肠道菌群中的益生菌竞争性增强,促进肠道健康。此外,服用人参提取物后,通过诱导肠道菌群所产生的代谢物也可发挥重要的调控作用,如人参提取物诱导粪肠球菌产生不饱和长链脂肪酸肉豆蔻酸,通过激活褐色脂肪组织和形成米色脂肪来降低脂肪含量,逆转肥胖者的肠道菌群组成,使主要菌属为双歧杆菌属、属和粪杆菌属[8]。长期摄入人参提取物后,宿主白细胞介素-4(interleukin-4,IL-4)、IL-10和免疫球蛋白A(immunoglobulin A,IgA)的水平均显著升高,这与双歧杆菌属和乳酸菌属丰度相关[56]。总之,长期服用人参提取物对宿主肠道代谢、免疫系统、抗炎过程和肠道菌群结构均有积极影响。
1.1.2 发酵人参 研究表明,发酵可显著提高人参多糖的含量,经发酵人参处理后,可增加肠道总细菌数、鼠乳杆菌、双歧杆菌属、肠杆菌科(Enterobacteriaceae)和屎肠球菌的丰度,恢复初始的肠道菌群,缓解抗生素相关性腹泻症状和结肠炎症[57]。发酵乳杆菌(KP-3)发酵人参还可逆转酒精喂养所致小鼠回肠和结肠内乳酸菌属、双歧杆菌属、艾克曼菌属、、瘤胃球菌属、等短链脂肪酸产生菌降低,以及拟杆菌门中的unclassified S24-7和变形菌门中的萨特菌属丰度增加,从而减轻酒精性肝损伤和肠道紊乱[58]。
1.1.3 人参皂苷 人参皂苷是人参中的主要成分之一,给予人参皂苷的小鼠肠道菌群结构会发生显著变化,即荧光假单胞菌和丁酸梭菌数量明显增加,进而促进优势菌的增殖,抑制肠道病原菌的定植生长,提高小鼠的健康水平[59]。人参皂苷Rk3可使抗生素导致的肠道菌群紊乱小鼠肠道富集拟杆菌属、拟普雷沃菌属和属,降低厚壁菌与拟杆菌比值,有效地改善肠道微生物群失调[60]。Jia等[61]通过多组学研究揭示,人参皂苷Rb1可通过调节甘油磷脂代谢通路中磷脂酰胆碱的合成和分解来调节肠道微生物群,上调属和异杆菌属丰度,下调属丰度,从而降低血清总胆固醇水平。人参皂苷提取物还可调节高脂饮食引起的肠道菌群失衡,缓解由菌群失调介导的肠道渗漏和代谢性内毒素血症,从而改善非酒精性脂肪性肝病[62]。此外,人参总皂苷、人参二醇、人参三醇处理可逆转急性联合应激诱导的肠道代谢产物变化,其中人参总皂苷的保护作用要优于人参其他组分[63]。
1.1.4 人参多糖 多糖类成分通常对肠道菌群有明显的调节作用,研究证明,人参多糖可通过增加厚壁菌门丰度,降低拟杆菌门丰度来恢复糖尿病所致的肠道菌群紊乱[64]。此外,人参多糖可通过增加厚壁菌门的相对丰度,降低拟杆菌门的相对丰度,尤其是促进人参皂苷的2种主要代谢菌——乳酸杆菌和拟杆菌的生长[65]来促进微生物对皂苷成分的脱糖基化反应,促进人参皂苷Rb1在肠道上皮的吸收,从而增加人参皂苷Rb1在全身的分布,减轻右旋葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导的结肠炎症状[66]。
1.2 三七提取物及其活性成分对肠道菌群的调节作用
1.2.1 三七提取物 三七提取物通常经过提取、过滤、浓缩等步骤制得,其中含有皂苷、多糖、黄酮、炔类、醇类等化学成分,因此具有多种药理活性[67]。目前,多项研究表明,三七提取物可通过调节肠道菌群达到缓解疾病的目的。Li等[68]研究显示,三七提取物处理后,能显著上调长双歧杆菌的丰度,从而抑制局灶性脑缺血/再灌注损伤。王佳丽[69]研究了人参-三七-川芎提取物对-半乳糖诱导血管衰老大鼠及高糖高脂诱导血管衰老小鼠肠道菌群组成和丰度的影响,结果显示,人参-三七-川芎提取物通过调节肠道微生物群的结构与组成,降低拟杆菌/厚壁菌(B/F)值和拟普雷沃菌属的丰度,促进短链脂肪酸的产生,减轻肠黏膜损伤,从而干预-半乳糖诱导血管衰老。低剂量提取物处理后的优势菌群为毛螺旋菌科(Lachnospiraceae)、梭菌目(Clostridiales)、Rs_E47_termite_group;高剂量处理后优势菌群为拟杆菌科(Bacteroidaceae)、厌氧棍状菌属、、Erysipelotrichaceae_g_norank。与模型组比较发现,低剂量组的主要差异菌群为螺杆菌和Tyzzerella_3;高剂量组的差异菌群为埃希氏菌-志贺氏菌属-、Tyzzerella_3、厌氧棍状菌属和。由此可见,三七提取物对肠道菌群具有明显的调控作用。
1.2.2 三七注射液 除口服药物之外,许多注射药物在进入人体之后也会通过“肝肠循环”随胆汁进入到肠道,对肠道菌群进行调节,进而在体内发挥药效。研究表明,三七注射液对慢性肾病(chronic kidney disease,CKD)和慢性肾衰竭具有一定的作用,其可能主要通过改善肠道菌群的结构(即上调双歧杆菌和乳酸杆菌的水平,下调肠球菌和肠杆菌的水平)和降低细菌的移位率来实现[70]。三七注射液通过调节肠道菌群改善肾病的研究充分体现出“肠-肾轴”在疾病发展过程中的重要作用,将为肾脏相关疾病的治疗提供新的方向。
1.2.3 三七皂苷成分 三七中含有丰富的皂苷成分,主要为达玛烷型的20()-原人参二醇型[20()-protopanaxadiol] 和20()原人参三醇型[20()-peotopanaxatriol] 皂苷,而没有齐墩果酸型皂苷,这与人参皂苷明显不同。三七不同皂苷成分对肠道菌群的调节作用具有差异性,三七总皂苷主要通过增加嗜黏蛋白-艾克曼菌和狄氏副拟杆菌的丰度来塑造小鼠肠道菌群[26],从而发挥抗肥胖[26]、抗结直肠癌的作用[25]。研究表明,三七总皂苷还具有改善阿尔茨海默症小鼠模型记忆损伤的作用,主要与增加厚壁门、拟杆菌门、乳杆菌属和螺杆菌属的菌群组成相关[71]。在与杠柳毒苷的配伍过程中,三七总皂苷可使肠道菌的总数和拟杆菌细菌数增加,在一定程度上发挥减毒作用[72]。三七皂苷还可通过调节肠道菌群中的有益菌,如双歧杆菌、乳酸杆菌等的丰度来减轻心脏毒性的损伤,同时,还可阻断单核细胞诱导的心肌肥大[2],从而预防心脏疾病的发生。
1.3 刺五加提取物及其活性成分对肠道菌群的调节作用
刺五加中含有皂苷、多糖等成分,具有调节免疫、抗应激、抗衰老等多种活性。研究表明,刺五加多糖对黑腹果蝇肠道稳态有明显的保护作用,但只能延长雌蝇的寿命,对雄蝇无作用[73]。对于刺五加提取物及其他活性成分对肠道菌群的调节作用,目前的研究较少,尚需进一步的研究与探索。
2 肠道菌群调节作用与五加科中药药理作用之间的关联
中药与肠道菌群之间是相互作用的关系,一方面,中药对肠道菌群具有调节作用,可以改变肠道菌群的结构和组成,以及影响肠道菌群相关代谢物的产生,从而影响机体健康;另一方面,肠道菌群对中药的体内代谢具有重要影响,可通过氧化、还原、水解、羟基化等反应促进活性物质的产生或代谢。五加科来源中药具有抗炎、抗肿瘤、抗氧化等多种药理作用,其对肠道菌群也具有明显的调节作用,本文在此基础上,对五加科中药的药理作用及其对肠道菌群调节作用之间的关联进行分析,强调了肠道菌群与中药相互作用的重要性(图1)。
2.1 五加科中药对肠道菌群的影响(通过调节菌群发挥药理作用)
五加科植物人参、三七等的摄入,会影响肠道菌群的结构与组成,这与其药效作用的发挥密切相关。黄志敏等[1]研究证明,三七注射液延缓CKD大鼠肾纤维化进展的机制可能与其调节CKD大鼠肠道菌群、修复肠道黏膜屏障功能及抑制肠道菌群移位有关。三七总皂苷可能通过调节艾克曼菌的比例来增强其抗结直肠癌的效应[25]。西洋参和铁皮石斛合剂可使乳酸菌属、萨特菌属、另枝菌属、、嗜胆菌属、粪球菌属、戈登氏杆菌属、属丰度增加,而放线菌属、埃希氏菌-志贺氏菌属、梭形杆菌属、史雷克氏菌属、链球菌属和属等与炎症相关的致病菌,以及与糖尿病相关的柯林斯氏菌属、罗氏菌属、、史雷克氏菌属丰度减少[74],从而维持肠道微生物群落与宿主之间的互惠共生,改善机体的疾病状态。人参和酸枣仁提取物可提高脾虚证大鼠肠道厚壁菌门和拟杆菌门丰度,降低变形菌门和放线菌门丰度,从而平衡代谢过程,改善脾虚证的症状[75]。由此可见,中药对人体的调节作用部分是由肠道菌群直接介导的,提示将来可更多地关注肠道菌群,从而为中药作用机制的探索提供更多的路径选择。
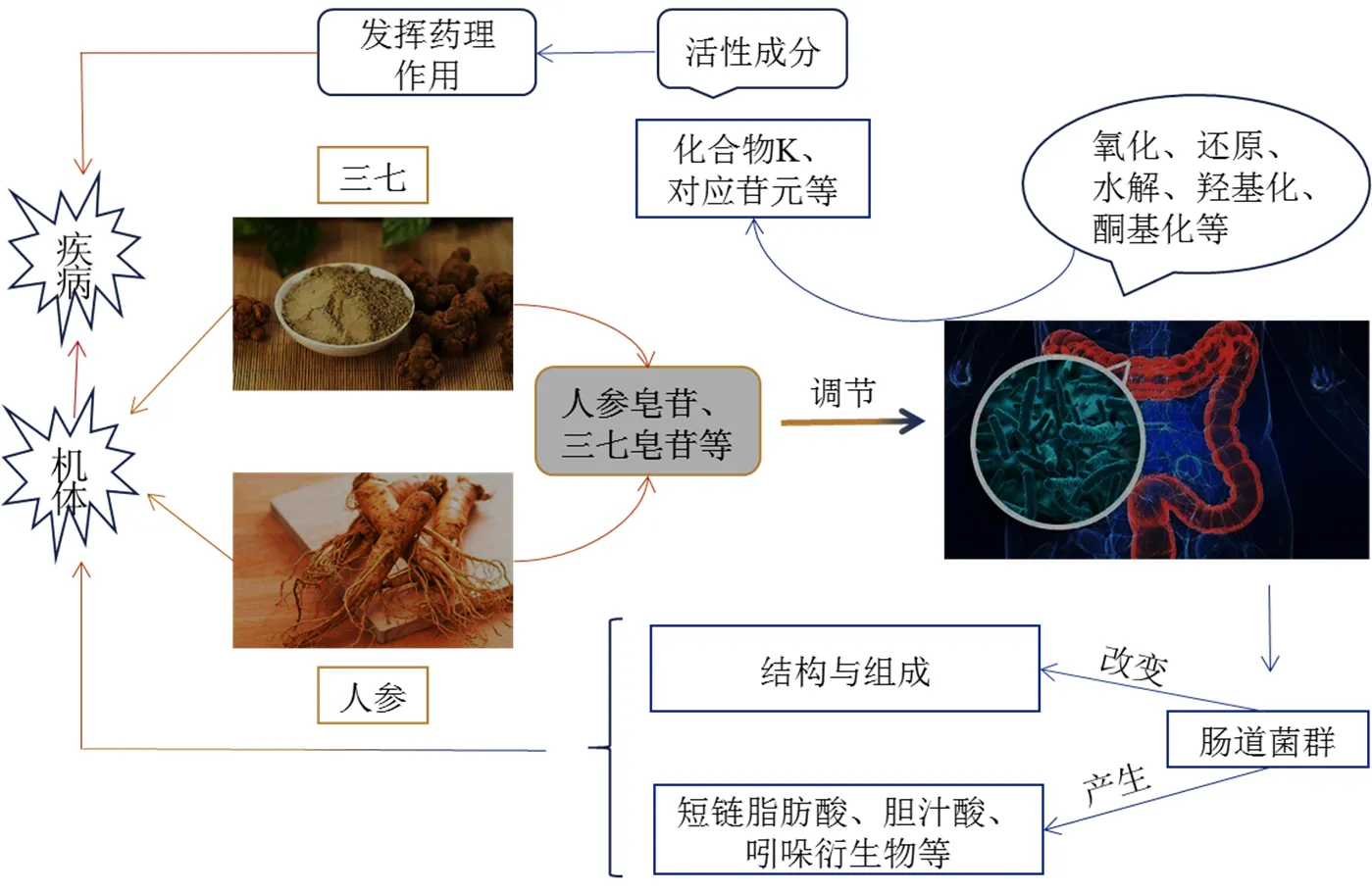
图1 肠道菌群与中药的相互作用
2.2 肠道菌群对五加科中药体内代谢的影响(通过调节药物代谢,进而发挥药理作用)
药物摄入进入人体后,除了对肠道菌群及机体产生效应外,同时也会受到肠道菌群对其所产生的代谢、排泄的影响。由于三七、人参中所含的人参皂苷的口服生物利用度低,需要在肠道菌群的作用下发生侧链的氧化-还原反应、羟基化反应及酮基化反应转化后才可发挥药理作用[72]。人参皂苷在肠道菌群的代谢下,发生的代谢反应主要为原人参二醇型人参皂苷转化为化合物K和人参皂苷Rh2;原人参三醇型人参皂苷转化为人参皂苷Rh1和原人参三醇;奥克梯隆醇型人参皂苷转化为奥克梯隆醇[76]。人参皂苷经过肠道微生物转化后的吸收途径为Rb1→Rd→F2→CK→苷元,Rg1→Rh1→苷元[77]。李雪晴等[78]研究结果也显示,在人肠道菌群的作用下,人参皂苷可发生脱糖基反应,最终转化为进入人体内并发挥药效的单糖苷和苷元。而当肠道微生物群被破坏时,三七总皂苷将不能进行有效的生物转化[79]。此外,益生元干预可使人参皂苷Rb1及其中间代谢产物人参皂苷Rd、F2和化合物K的血药浓度峰值和药时曲线下面积均有不同程度的升高[80],由此可见,肠道菌群在促进皂苷吸收和药效的发挥中发挥至关重要的作用。
3 结语与展望
多项研究表明,人参、三七的抗炎、改善代谢等作用均与调节肠道菌群的结构与组成相关,主要表现为增加有益菌双歧杆菌属乳酸菌属等的丰度,降低致病菌、螺杆菌属等的丰度。虽然目前的研究已经证明肠道菌群在人参、三七等五加科中药治疗、缓解疾病过程中占据重要地位,但是,在菌群分析时,仍然更多关注在门、属水平上的变化,对于菌群更精确的分析有所欠缺。今后的研究中,应该明确分析在菌种,甚至菌株水平上的变化,达到精准定位。另外,对于各药材应该对其单体成分进行更加深入的研究。例如,多糖对菌群具有一定的调节作用,但是三七多糖调节肠道菌群的相关研究却很少,尚待进一步开发。
总而言之,人参、三七等五加科中药具有明显的益生元特性,或可开发成为新的益生元。具体而言,在明确五加科植物及其活性成分对肠道菌群组成和结构的调节作用后,可以进行针对性的验证,再次确认其益生元功效后,可将其添加到某些食物中或者制成益生元产品,从而促进人类健康事业的发展。当然,这个过程是艰辛且漫长的,需要不断的探索与验证。
此外,我国五加科植物约有22个属,160种,其中可供药用、对人体健康有调节作用的多达114种。因此,研究的范围不应该仅局限于人参、三七等著名的中药材,而应该对五加科中的其他植物,如通草、五加皮等传统药材进行深入的研究,探索其对人体各功能的改善情况以及对肠道菌群的调节作用。这样才能为新药、益生元、保健品等的开发提供更多的选择。
利益冲突 所有作者均声明不存在利益冲突
[1] 黄志敏, 黄仁发, 唐宇, 等. 基于肠肾轴理论探讨三七注射液对慢性肾脏病大鼠肠黏膜功能和肠道菌群的影响 [J]. 中华中医药学刊, 2021, 39(9): 156-159.
[2] 魏金娜, 李琳, 王启隆, 等. 中药调控肠道菌群防治心脏疾病的研究进展 [J]. 世界科学技术—中医药现代化, 2019, 21(6): 1135-1140.
[3] Zhou P, Xie W J, He S B,. Ginsenoside Rb1as an anti-diabetic agent and its underlying mechanism analysis [J]., 2019, 8(3): 204.
[4] Wang C Z, Huang W H, Zhang C F,. Role of intestinal microbiome in American ginseng-mediated colon cancer prevention in high fat diet-fed AOM/DSS mice [J]., 2018, 20(3): 302-312.
[5] Wang C Z, Yu C, Wen X D,. American ginseng attenuates colitis-associated colon carcinogenesis in mice: Impact on gut microbiota and metabolomics [J].:, 2016, 9(10): 803-811.
[6] Byun J, Kim S K, Ban J Y. Anti-inflammatory and anti-oxidant effects of Korean ginseng berry extract in LPS-activated RAW264.7 macrophages [J]., 2021, 49(3): 719-735.
[7] Han S K, Joo M K, Kim J K,. Bifidobacteria-fermented red ginseng and its constituents ginsenoside rd and protopanaxatriol alleviate anxiety/depression in mice by the amelioration of gut dysbiosis [J]., 2020, 12(4): E901.
[8] Ju C, Jeon S M, Jun H S,. Diol-ginsenosides from Korean red ginseng delay the development of type 1 diabetes in diabetes-prone biobreeding rats [J]., 2020, 44(4): 619-626.
[9] Rhule A, Navarro S, Smith J R,.attenuates LPS-induced pro-inflammatory mediators in RAW264.7 cells [J]., 2006, 106(1): 121-128.
[10] Tao H J, Yang X Y, Wang W X,. Regulation of serum lipidomics and amino acid profiles of rats with acute myocardial ischemia byandherb pair [J]., 2020, 67: 153162.
[11] Xie L, Zhai R, Chen T,.ameliorates podocyte EMT by targeting the wnt/β-catenin signaling pathway in STZ-induced diabetic rats [J]., 2020, 14: 527-538.
[12] Liang Q, Yu X, Qu S,.senticosides B ameliorates oxidative damage induced by hydrogen peroxide in cultured neonatal rat cardiomyocytes [J]., 2010, 627(1/2/3): 209-215.
[13] Miyazaki S, Oikawa H, Takekoshi H,. Anxiolytic effects ofHARMS occur via regulation of autonomic function and activate hippocampal BDNF-TrkB signaling [J]., 2018, 24(1): E132.
[14] Bu Y, Jin Z H, Park S Y,. Siberian ginseng reduces infarct volume in transient focal cerebral ischaemia in Sprague-Dawley rats [J]., 2005, 19(2): 167-169.
[15] Song M Y, Kim B S, Kim H. Influence ofon obesity and gut microbiota in obese middle-aged Korean women [J]., 2014, 38(2): 106-115.
[16] Ju S, Seo J Y, Lee S K,. Oral administration of hydrolyzed red ginseng extract improves learning and memory capability of scopolamine-treated C57BL/6J mice via upregulation of Nrf2-mediated antioxidant mechanism [J]., 2021, 45(1): 108-118.
[17] Wajima T, Kinugawa R, Yamada T,.extract possesses significant antibacterial activity against pathogenic streptococci [J]., 2019, 103(5/6): 221-227.
[18] 宋建平, 张志信, 娄洁. 三七叶提取物抑制酪氨酸酶及抗氧化活性研究 [J]. 文山学院学报, 2020, 33(3): 1-4.
[19] 王恒禹, 董艳萍. 三七花提取物对小鼠NK细胞活性的增强作用 [J]. 西华大学学报: 自然科学版, 2018, 37(5): 64-67.
[20] Jung H W, Seo U K, Kim J H,. Flower extract ofattenuates lipopolysaccharide-induced inflammatory response via blocking of NF-kappaB signaling pathway in murine macrophages [J]., 2009, 122(2): 313-319.
[21] Kawano Y, Tanaka M, Fujishima M,.Harms extract causes G0/G1cell cycle arrest and autophagy via inhibition of Rubicon in human liver cancer cells [J]., 2021, 45(3): 1193-1201.
[22] Soo Kim H, Young Park S, Kyoung Kim E,.has a heme oxygenase-1 signaling-dependent effect onlipopolysaccharide-stimulated macrophages [J]., 2012, 142(3): 819-828.
[23] Wang J, Feng W W, Zhang S Y,. Ameliorative effect ofessential oil combined withtotal saponins on 5-fluorouracil induced diarrhea is associated with gut microbial modulation [J]., 2019, 238: 111887.
[24] Meng Y Q, Du Z Y, Li Y,. The synergistic mechanism of total saponins and flavonoids in Notoginseng-Safflower pair against myocardial ischemia uncovered by an integrated metabolomics strategy [J]., 2020, 130: 110574.
[25] Chen L, Chen M Y, Shao L,.saponins prevent colitis-associated colorectal cancer development: The role of gut microbiota [J]., 2020, 18(7): 500-507.
[26] Xu Y, Wang N, Tan H Y,.saponins modulate the gut microbiota to promote thermogenesis and beige adipocyte reconstruction via leptin-mediated AMPKα/STAT3 signaling in diet-induced obesity [J]., 2020, 10(24): 11302-11323.
[27] Xie W J, Meng X B, Zhai Y D,.saponins: A review of its mechanisms of antidepressant or anxiolytic effects and network analysis on phytochemistry and pharmacology [J]., 2018, 23(4): E940.
[28] 岳斌, 徐丽, 李影娜. 刺五加皂苷抗小鼠酒精性肝氧化损伤作用及机制研究 [J]. 中南药学, 2018, 16(9): 1221-1224.
[29] 梁睿, 翟溯澜, 吕梦雨, 等. 刺五加皂苷B/E对乳腺癌MDA-MB-231细胞迁移能力的影响及作用机制研究 [J]. 药学与临床研究, 2020, 28(1): 15-19.
[30] Lee Y Y, Kim S W, Youn S H,. Biological effects of Korean red ginseng polysaccharides in aged rat using global proteomic approach [J]., 2020, 25(13): 3019.
[31] Youn S H, Lee S M, Han C K,. Immune activity of polysaccharide fractions isolated from Korean red ginseng [J]., 2020, doi: 10.3390/molecules25163569.
[32] 万浩芳, 应佳妮, 关旸, 等. 人参多糖对冠心病大鼠心肌细胞线粒体的保护作用 [J]. 现代食品科技, 2020, 36(11): 24-28.
[33] Liu Y H, Qin H Y, Zhong Y Y,. Neutral polysaccharide fromenhanced cyclophosphamide antitumor efficacy in hepatoma H22-bearing mice [J]., 2021, 21(1): 37.
[34] You S Q, Shi X Q, Yu D,. Fermentation ofroot extract polysaccharides attenuates oxidative stress and promotes type I procollagen synthesis in human dermal fibroblast cells [J]., 2021, 21(1): 34.
[35] Sun D, Chen J, Hu H,.senticosus polysaccharide suppressing proliferation and metastasis of the human non-small cell lung cancer NCI-H520 cells is associated with Wnt/β-catenin signaling [J]., 2019, 66(4): 555-563.
[36] Xie Y L, Zhang B, Zhang Y J. Protective effects ofpolysaccharides on cerebral ischemia-reperfusion injury and its mechanisms [J]., 2015, 72: 946-950.
[37] 孙非, 衣同辉, 梁重阳, 等. 三七总黄酮对病毒性心肌炎模型治疗作用的药效学研究 [J]. 中国药理学通报, 2006, 22(4): 476-479.
[38] Hong J, Hu J Y, Liu J H,.antioxidant and antimicrobial activities of flavonoids fromflowers [J]., 2014, 28(16): 1260-1266.
[39] 林晓, 于恩江, 刘珊珊, 等. 三七渣总黄酮提取及其抗氧化活性的研究 [J]. 食品研究与开发, 2015, 36(11): 43-46.
[40] 都宏霞, 陶劲强, 王翔, 等. 响应面优化人参花黄酮提取工艺及抗氧化活性 [J]. 食品工业科技, 2018, 39(12): 216-221.
[41] 段贤春, 夏伦祝, 汪永忠, 等. 人参炔醇对氧糖剥夺神经细胞损伤的保护作用 [J]. 中国实验方剂学杂志, 2011, 17(16): 180-183.
[42] 王泽剑, 陈红专, 薛庆生, 等. 人参炔醇对大鼠原代培养的神经细胞过氧化氢损伤的影响 [J]. 中草药, 2005, 36(1): 72-75.
[43] 王满霞, 李凤文, 李晓光, 等. 人参挥发油对体外培养SGC-823胃癌细胞化学成分的影响 [J]. 中国中药杂志, 1992, 17(2): 110-112.
[44] Marco M L, Sanders M E, Gänzle M,. The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on fermented foods [J]., 2021, 18(3): 196-208.
[45] Cunningham M, Azcarate-Peril M A, Barnard A,. Shaping the future of probiotics and prebiotics [J]., 2021, 29(8): 667-685.
[46] Peng M F, Tabashsum Z, Anderson M,. Effectiveness of probiotics, prebiotics, and prebiotic-like components in common functional foods [J]., 2020, 19(4): 1908-1933.
[47] Jin L, Schmiech M, El Gaafary M,. A comparative study on root and bark extracts ofand their effects on human macrophages [J]., 2020, 68: 153181.
[48] Li R, Zhou R, Wang H,. Gut microbiota-stimulated cathepsin K secretion mediates TLR4-dependent M2 macrophage polarization and promotes tumor metastasis in colorectal cancer [J]., 2019, 26(11): 2447-2463.
[49] Alvarez-Silva C, Kashani A, Hansen T H,. Trans-ethnic gut microbiota signatures of type 2 diabetes in Denmark and India [J]., 2021, 13(1): 37.
[50] Li R M, Andreu-Sánchez S, Kuipers F,. Gut microbiome and bile acids in obesity-related diseases [J]., 2021, 35(3): 101493.
[51] Benakis C, Brea D, Caballero S,. Commensal microbiota affects ischemic stroke outcome by regulating intestinal γδ T cells [J]., 2016, 22(5): 516-523.
[52] Budden K F, Gellatly S L, Wood D L,. Emerging pathogenic links between microbiota and the gut-lung axis [J]., 2017, 15(1): 55-63.
[53] Yang T, Richards E M, Pepine C J,. The gut microbiota and the brain-gut-kidney axis in hypertension and chronic kidney disease [J]., 2018, 14(7): 442-456.
[54] 吕宁. 泻下药/补益药与肠道菌群相互作用的初步研究 [D]. 郑州: 河南中医药大学, 2018.
[55] 孙艺凡, 张霞, 王晓艳, 等. 长期服用人参提取物对大鼠肠道菌群结构的影响 [J]. 中国中药杂志, 2018, 43(19): 3927-3932.
[56] Sun Y, Chen S, Wei R,. Metabolome and gut microbiota variation with long-term intake ofextracts on rats [J]., 2018, 9(6): 3547-3556.
[57] Qu Q, Yang F, Zhao C,. Effects of fermented ginseng on the gut microbiota and immunity of rats with antibiotic-associated diarrhea [J]., 2021, 267: 113594.
[58] Fan J J, Wang Y S, You Y,. Fermented ginseng improved alcohol liver injury in association with changes in the gut microbiota of mice [J]., 2019, 10(9): 5566-5573.
[59] 刘艳艳, 张凯, 关家伟, 等. 人参皂苷对BALB/c小鼠肠道菌群的影响 [J]. 现代生物医学进展, 2015, 15(6): 1041-1045.
[60] Bai X, Fu R Z, Duan Z G,. Ginsenoside Rk3alleviates gut microbiota dysbiosis and colonic inflammation in antibiotic-treated mice [J]., 2021, 146: 110465.
[61] Jia L Q, Ju X, Ma Y X,. Comprehensive multiomics analysis of the effect of ginsenoside Rb1 on hyperlipidemia [J].(Albany NY), 2021, 13(7): 9732-9747.
[62] Liang W Y, Zhou K, Jian P,. Ginsenosides improve nonalcoholic fatty liver diseaseintegrated regulation of gut microbiota, inflammation and energy homeostasis [J]., 2021, 12: 622841.
[63] Wang J C, Hou Y L, Jia Z Y,. Metabonomics approach to comparing the antistress effects of fourcomponents in rats [J]., 2018, 17(2): 813-821.
[64] Li J, Li R G, Li N,. Mechanism of antidiabetic and synergistic effects of ginseng polysaccharide and ginsenoside Rb1on diabetic rat model [J]., 2018, 158: 451-460.
[65] Shen H, Gao X J, Li T,. Ginseng polysaccharides enhanced ginsenoside Rb1and microbial metabolites exposure through enhancing intestinal absorption and affecting gut microbial metabolism [J]., 2018, 216: 47-56.
[66] Zhou S S, Xu J, Zhu H,. Gut microbiota-involved mechanisms in enhancing systemic exposure of ginsenosides by coexisting polysaccharides in ginseng decoction [J]., 2016, 6: 22474.
[67] 刘耀晨, 张铁军, 郭海彪, 等. 三七的研究进展及其质量标志物预测分析 [J]. 中草药, 2021, 52(9): 2733-2745.
[68] Li H F, Xiao J C, Li X N,. Low cerebral exposure cannot hinder the neuroprotective effects ofnotoginsenosides [J]., 2018, 46(1): 53-65.
[69] 王佳丽.-半乳糖诱导血管衰老大鼠肠道菌群的变化及人参三七川芎提取物的干预作用 [D]. 北京: 中国中医科学院, 2020.
[70] 镇立. 三七注射液对慢性肾衰竭大鼠肠道菌群结构及移位的研究 [D]. 南宁: 广西中医药大学, 2019.
[71] Zhang T, Dong K L, Xiao L,. Effects of co-administration of icariin andsaponins on intestinal microbiota and hippocampal protein expression in a mouse model of Alzheimer’s disease [J]., 2020, 16: 2169-2179.
[72] 李丽, 马文娟, 贾琪, 等. 实时荧光定量PCR联合高通量测序分析杠柳毒苷与三七总皂苷配伍对大鼠肠道菌群的影响 [J]. 药物评价研究, 2019, 42(3): 432-436.
[73] Zhang H, Wang S H, Jin L H.polysaccharide regulates the intestinal homeostasis disruption induced by toxic chemicals in[J]., 2020, 34(1): 193-200.
[74] Liu C Z, Chen W, Wang M X,.Kimura et Migo and American ginseng mixture: A Chinese herbal formulation for gut microbiota modulation [J]., 2020, 18(6): 446-459.
[75] Li F T, Yang D, Song F Y,.effects of ginseng and the seed ofvar.on gut microbiota of rats with spleen deficiency [J]., 2020, 17(9): e2000199.
[76] Kim D H. Gut microbiota-mediated pharmacokinetics of ginseng saponins [J]., 2018, 42(3): 255-263.
[77] 陈玲. 乳酸菌发酵对人参皂苷的影响及抗肿瘤活性研究 [D]. 长春: 吉林大学, 2017.
[78] 李雪晴, 李丽, 刘秀峰, 等. 三七皂苷的人肠道菌群体外代谢研究 [J]. 药物生物技术, 2017, 24(3): 218-223.
[79] Guo Y P, Chen M Y, Shao L,. Quantification ofsaponins metabolites in rat plasma withgut microbiota-mediated biotransformation by HPLC-MS/MS [J]., 2019, 17(3): 231-240.
[80] Zhang X Y, Chen S, Duan F P,. Prebiotics enhance the biotransformation and bioavailability of ginsenosides in rats by modulating gut microbiota [J]., 2021, 45(2): 334-343.
Research progress on pharmacological effects of traditional Chinese medicine from Araliaceae via modulating gut microbiota
YANG Ya-nan, ZHANG Fang, WU Chong-ming
Pharmacology and Toxicology Research Center, Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100193, China
Recently, the plants from Araliaceae have attracted extensive attention due to their extensive pharmacological effects and healthy functions. Although there were many studies on their pharmacological effects, only a few studies revealed the relationship between its pharmacological effects and gut microbiota. Simutaneously, there were still some problems, such as insufficient thorough research as well as a lack of single component research, which resulting in a lack of systematic understanding of the relationship between their pharmacological effects and gut microbiota. Therefore, this review focuses on the medicinal plants (traditional Chinese medicine) from Araliaceae, mainly Renshen (et) and Sanqi (et), reviews their past-present research, efficacy, active compounds and pharmacological effects, summarizes the regulatory effects of their extracts, saponins, polysaccharides and other monomer components on gut microbiota, and connects this regulatory effects with related pharmacological effects, aiming to reveal the mechanisms ofetandeton regulating body function and promoting human health. All of these suggested that the plants from Araliaceae have the potential to be developed into new prebiotics.
Araliaceae;et;et; gut microbiota; prebiotics
R285
A
0253 - 2670(2022)01 - 0308 - 09
10.7501/j.issn.0253-2670.2022.01.035
2021-05-12
杨娅楠(1996—),女,在读硕士研究生,主要从事肠道菌群与中医药理论方向研究。E-mail: 1187943619@qq.com
吴崇明,男,博士,副研究员,研究方向为肠道菌群与中医药理论。Email: cmwu@implad.ac.cn
[责任编辑 潘明佳]