补阳还五汤对脑缺血大鼠海马组织circRNA-miRNA-mRNA转录网络的影响
2022-01-13陈博威唐荣梅龙红萍刘柏炎
陈博威,唐荣梅,易 健,龙红萍,刘柏炎*
补阳还五汤对脑缺血大鼠海马组织circRNA-miRNA-mRNA转录网络的影响
陈博威1,唐荣梅1,易 健2,龙红萍2,刘柏炎1*
1. 湖南中医药大学,湖南 长沙 410208 2. 湖南中医药大学第一附属医院,湖南 长沙 410007
研究补阳还五汤对脑缺血大鼠海马组织环状RNA(circular RNA,circRNA)-微小RNA(microRNA,miRNA)-mRNA转录网络的影响,探讨其治疗脑缺血的作用机制。运用超高效液相色谱-四极杆-飞行时间质谱联用仪(UPLC-Q-TOF/MS)分析补阳还五汤化学成分;SD大鼠随机分为对照组、模型组、补阳还五汤(5 g/kg)组及丁苯酞组(54 mg/kg)组,除对照组外,其余各组采用大脑中动脉栓塞法复制脑缺血模型,给予药物干预7 d后,采用神经行为学评分、苏木素-伊红(HE)染色法及免疫组化法评估补阳还五汤疗效,采用竞争性内源RNA(competing endogenous RNA,ceRNA)芯片筛选差异表达的circRNAs及mRNAs,通过基因本体(gene ontology,GO)功能及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析差异基因参与的主要生物学过程,采用qRT-PCR法验证基因芯片结果,最后构建circRNA-miRNA-mRNA转录网络。补阳还五汤中共鉴定出黄芪甲苷IV、芒柄花素、阿魏酸及芍药内酯苷等21个成分。大鼠脑缺血后出现神经功能障碍及海马神经细胞损伤,补阳还五汤能部分逆转上述损伤并提高海马齿状回区增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)及巢蛋白(Nestin)蛋白表达。ceRNA芯片筛选出大鼠脑缺血后有27个差异表达的circRNAs和767个差异表达的mRNAs,补阳还五汤治疗后有70个差异表达的circRNAs和692个差异表达的mRNAs。构建了由7个circRNAs、9个miRNAs及15个mRNAs组成的三元转录网络。生物信息学分析显示这些靶点可能通过自噬、血管内皮生长因子(vascular endothelial growth factor,VEGF)信号通路、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)信号通路等发挥作用。补阳还五汤可能通过影响脑缺血大鼠海马组织的circRNA-miRNA-mRNA转录网络促进海马神经前体细胞增殖,诱导神经再生,涉及多条通路及多个生物学过程。
补阳还五汤;脑缺血;环状RNA;微小RNA;竞争性内源RNA;基因芯片;神经再生;黄芪甲苷IV;芒柄花素;阿魏酸;芍药内酯苷
脑缺血具有高发病率和高致残率的特点,造成了极大的医疗负担[1],目前西医治疗脑缺血的临床效果具有局限性。补阳还五汤是治疗缺血性脑卒中的经典方剂,其疗效已得到循证医学的证实[2]。本课题组前期研究发现补阳还五汤能通过诱导神经再生[3]、促进血管新生[4]等,进而发挥抗脑缺血损伤的作用。然而以往研究均基于单一通路或单一靶点,无法系统阐明补阳还五汤治疗脑缺血的作用机制。
与常规的线性RNA不同,环状RNA(circular RNA,circRNA)特有的共价闭合环状结构使其具有良好的稳定性,更难以被降解。研究表明,circRNA在脑梗死的早期诊断和有效治疗中发挥着重要作用[5]。circRNA虽不能直接编码翻译蛋白质,但是其能充当“微小RNA(microRNA,miRNA)海绵”,通过海绵吸附miRNA的方式,间接降低miRNA与下游靶向mRNA的结合,从而影响靶基因的表达,即竞争性内源RNA(competing endogenous RNA,ceRNA)调控机制[6]。目前,circRNA-miRNA-mRNA转录网络已成为研究脑缺血病理生理机制的热点[7]。
研究表明,哺乳动物大脑海马区域存在静默的神经干细胞。当脑缺血时,由于微环境变化激活了神经干细胞,促进其增殖并移行至损伤部位,分化成熟为各类神经细胞,重建大脑的组织结构[8]。快速恢复缺血侧脑组织血流供应,促进海马区神经干细胞增殖、迁移、分化和成熟,是促进脑缺血后神经功能重建的有效途径。因此,本研究拟采用脑缺血模型大鼠,运用ceRNA芯片分析补阳还五汤对脑缺血大鼠海马组织circRNA-miRNA-mRNA转录网络的影响,以期系统探究补阳还五汤治疗脑缺血的作用机制。
1 材料
1.1 动物
SPF级雄性SD大鼠,体质量(230±10)g,6~8周龄,购自湖南斯莱克景达实验动物有限公司,动物许可证号SCXK(湘)2019-0004。动物饲养于湖南中医药大学第一附属医院SPF级动物房,实验单位使用许可证号SYXK(湘)2020-0010,室温22~26 ℃,湿度45%~55%,通风,照明昼夜规律,适应性饲养1周,自由进食饮水。动物实验通过湖南中医药大学第一附属医院实验动物伦理委员会批准(批准号ZYFY20201215-1)。
1.2 药材
黄芪饮片(批号CK20122902)、赤芍饮片(批号NG20112502)、川芎饮片(批号20091001120)、桃仁饮片(批号2020050402)、当归饮片(批号TH20122201)、地龙饮片(批号2020090902)及红花饮片(批号2020062001)购自湖南中医药大学第一附属医院,经湖南中医药大学第一附属医院龙红萍副研究员鉴定分别为豆科植物蒙古黄芪Bunge的干燥根、毛茛科植物川赤芍Pall.的干燥根、伞形科植物川芎Hort.的干燥根、蔷薇科植物桃(L.) Batsch的干燥成熟种子、伞形科植物当归(Oliv.) Diels的干燥根、钜蚓科环毛蚓(E. Perrier)的动物全体、菊科植物红花L.的干燥花。
1.3 药品与试剂
丁苯酞软胶囊(0.1 g/粒,批号H20050299)购自石家庄恩必普药业有限公司;动脉栓线购自北京西浓科技有限公司;RNA wait非冻型组织保存液购自大连美仑生物技术有限公司;TRIzol试剂购自美国Life Technologies公司;ceRNA基因芯片由美国Agilent公司定制;PCR引物由生工生物工程(上海)股份有限公司合成;增殖细胞核抗原(proliferating cell nuclear antige,PCNA)鼠抗、即用型SABC试剂盒购自武汉博士德生物工程有限公司;巢蛋白(Nestin)兔抗购自英国Abcam公司;对照品黄芪甲苷IV(批号SA8640,质量分数≥98%)、芒柄花素(批号YZ-1248S,质量分数≥99%)、阿魏酸(批号SF8030,质量分数≥98%)、芍药内酯苷(批号SA8140,质量分数≥98%)购自北京索莱宝科技有限公司。
1.4 仪器
2100型生物分析仪、G2505C型芯片扫描仪、1290型超高效液相-四级杆-飞行时间质谱仪(UPLC-Q-TOF/MS,美国Agilent公司);9700型qRT-PCR仪(美国ABI公司);5418型离心机(德国Eppendorf公司);Vectra3智能组织切片成像系统(美国PerkinElmer公司)。
2 方法
2.1 补阳还五汤的制备
将黄芪、当归、赤芍、地龙、川芎、桃仁及红花按120∶6∶4.5∶3∶3∶3∶3混合,加入5倍量蒸馏水浸泡1 h后,武火煎煮0.5 h,文火煎煮1.5 h,使用3层纱布滤过;继续加入3倍量蒸馏水后采用相同方法提取滤液,合并2次滤液后使用旋转蒸发仪将药液制备为以生药量计2 g/mL的浓缩液,放至冰箱备用。
2.2 对照品溶液的配制
精密称取适量黄芪甲苷IV、芒柄花素、阿魏酸、芍药内酯苷对照品,分别加甲醇定容在10 mL棕色量瓶中,依次配成质量浓度分别为0.2、0.1、0.1、0.4 mg/mL的对照品储备液。精密量取各对照品储备液200 μL,混匀置于进样瓶中备用。
2.3 补阳还五汤的UPLC-Q-TOF/MS分析
2.3.1 补阳还五汤供试品的制备 取10 mL补阳还五汤浓缩液置于50 mL锥形瓶中,加入70%甲醇30 mL,超声振荡溶解30 min,静置后取2 mL溶液,8000 r/min离心5 min,上清液经0.22 μm微孔滤膜滤过,置于进样瓶中。
2.3.2 色谱及质谱条件 参照本课题组前期摸索条件[9],Agilent ZORBAX Eclipse Plus C18色谱柱(100 mm×2.1 mm,1.8 μm);正离子流动相为乙腈-0.1%甲酸水溶液,负离子流动相为乙腈-5 mmol/L乙酸铵水溶液;梯度洗脱:0~10 min,5%~15%乙腈;10~20 min,15%~30%乙腈;20~30 min,30%~70%乙腈;30~40 min,70%~95%乙腈;体积流量为0.4 mL/min;进样量为2 μL。质谱仪全扫质量扫描范围/90~1500;分辨率为30 000;干燥气和鞘气均为氮气;毛细管电压为4.0 kV,温度为320 ℃。
2.3.3 数据处理 根据Agilent Masshunter Qualitative Analysis工作站的特点,设置阈值>90,对补阳还五汤正负离子模式下采集的数据进行解析,并参考相关文献及对照品图谱进行成分定性及定量分析[10]。
2.4 模型的制备与评价
采用Longa等[11]报道的线栓法复制大鼠脑缺血模型:大鼠术前禁食禁水12 h,ip 0.3%戊巴比妥钠麻醉,取颈正中切口,钝性分离左侧颈总、颈内、颈外动脉,将线栓经颈总动脉送入颈内动脉,当线栓上黑色标记点恰好位于颈总分叉时固定线栓,消毒并缝合皮肤。术后2 h进行神经行为学评分,参照Longa等[11]报道的方法,1~3分表明造模成功。
2.5 分组与给药
本课题组前期研究表明补阳还五汤以5 g/(kg·d)干预疗效确切[4],因此以该剂量进行后续研究。将SD大鼠随机分为对照组、模型组、补阳还五汤(5 g/kg)组及丁苯酞组(54 mg/kg,临床等效剂量),每组8只。术后6 h各给药组ig药物(10 mL/kg),对照组和模型组ig等体积蒸馏水,1次/d,连续7 d。所有动物均进行神经行为学评估,同时每组随机选取3只大鼠进行ceRNA芯片分析及qRT-PCR验证,剩余大鼠进行病理形态学及免疫组化检测。
2.6 神经行为学评估
末次给药后,运用Ayelet Levy 14分评分法[12]对大鼠神经行为学进行评估。
2.7 病理形态学检测
末次给药后,大鼠ip 0.3%戊巴比妥钠麻醉,分别用预冷的0.9%氯化钠溶液、4%多聚甲醛进行灌注处理后断头取脑,脑组织于4%多聚甲醛中固定,常规脱水、透明、包埋及切片,进行苏木素-伊红(HE)染色,于显微镜下观察并拍照。
2.8 免疫组化检测
采用免疫组化法检测海马齿状回区PCNA及Nestin阳性细胞数量,分别代表增殖细胞和神经前体细胞增殖的情况。脑组织切片依次脱蜡、抗原修复及封闭,分别加入PCNA、Nestin抗体(1∶100),4 ℃孵育过夜;分别加入生物素标记的山羊抗小鼠或兔IgG抗体,室温孵育1 h;常规DAB染色后用苏木素复染并封片,使用智能组织切片成像系统进行全片扫描,并从缺血侧海马区采集图像,运用Image Pro Plus 6.0图像分析软件计算单位面积阳性细胞数[13]。
2.9 ceRNA芯片检测
大鼠麻醉后直接断头取脑,冰上迅速分离缺血侧海马组织,放入预先盛满RNA wait液的冻存管中,严格按照操作流程保存,送至上海欧易生物进行芯片检测。采用TRIzol法提取总RNA,RNA浓度及质量经检测合格后,扩增RNA并转录成荧光cRNA;然后纯化标记的cRNA,将50 μL杂交溶液分布在ceRNA微阵列载玻片上,将载玻片放在Agilent杂交炉65 ℃温育17 h;洗涤,固定和扫描混合阵列,扫描完成后通过Feature Extraction软件进行数据的抽提,生成的原始数据文件经Genespring软件标准化后进行后续的数据分析。
2.10 基因本体(gene ontology,GO)功能分析及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析
将差异表达的circRNAs母源基因及mRNAs进行GO功能及KEGG通路富集分析。
2.11 qRT-PCR验证
将ceRNA芯片检测后的剩余样本进行qRT-PCR验证。随机选取5个差异表达的circRNAs,以及5个与神经保护作用密切相关的mRNAs:小窝相关蛋白2(caveolae associated protein 2,)、小窝蛋白3(caveolin 3,)、血管性血友病因子(von willebrand factor,)、WNT家庭成员5B(Wnt family member 5B,)以及B淋巴细胞瘤-2类似物1(B-cell lymphoma 2 like 1,)。实验过程严格参照试剂盒步骤,内参基因选用,使用2−ΔΔCt法计算基因的相对表达量,各引物序列详见表1。
2.12 circRNA-miRNA-mRNA转录网络的构建
根据先前报道的方法及筛选条件[14-15],首先以Pearson系数>0.8筛选与差异mRNAs显著正相关的circRNAs,随后运用miRBase 22.0数据库预测circRNA-miRNA和miRNA-mRNA关系对,最后以miRNA为桥梁构建circRNA-miRNA-mRNA三元转录网络。
表1 引物序列
Table 1 Sequences of primers
基因引物序列(5’-3’)片段大小/bp β-actinF: CCCTAAGGCCAACCGTGAAAAG70 R: TACGTACATGGCTGGGGTGT RNO_CIRCpedia_9127F: CTGAGGGAAGTTTCCATGGTGA172 R: CAGTGCAAAGCCACAAGCAG RNO_CIRCpedia_2223F: CTATGGAGCCGAACTGGATGC121 R: CTTGGCTAGGGCACCAACTTC RNO_CIRCpedia_2904F: TTCTATTGCCACTCTGCTGATG145 R: GTCGAACAATTCACCTCCAGAC RNO_CIRCpedia_9145F: AGAGGAGACGCAGACATAGAC75 R: TGCAATGATGTCTGCTACACTG RNO_CIRCpedia_10080F: TCTCACACTCCGAGCCCAGTT146 R: GGAATCTTGAAGCATGGTAGTTCG Cav3F: GAGGACATTGTGAAGGTGGA87 R: AAAGTGGTGTAGCTCACCC Cavin2F: CACATCTGGATCCTAATGCCT80 R: TGTCACACTCTTCCATATCGT VWFF: GTGAAATGCAAGAAACGGG80 R: TCTCTTAACATTCACCTCTCCA Wnt5bF: AGCACATGTCCTACATCGG138 R: TCTCGGCTACCTATCTGCA Bcl2l1F: GGACAGCATATCAGAGCTTTGAACA88 R: TTGTCTACGCTTTCCACGCA
2.13 统计分析
采用差异倍数(fold change,FC)≥1.5及<0.05筛选差异基因[16]。计量资料均以进行统计,采用单因素方差分析的统计学方法来比较多组间均数,运用Graphpad Prism 8作图软件分析。
3 结果
3.1 补阳还五汤化学成分分析
经UPLC-Q-TOF-MS检测得到补阳还五汤中各化学成分保留时间(R)及质谱数据,通过对采集的数据进行解析,共鉴定出黄芪甲苷IV、芒柄花素、阿魏酸、芍药内酯苷等21个成分,质量浓度分别为78.14、46.70、45.60、468.40 μg/mL,见图1。
3.2 补阳还五汤对脑缺血大鼠神经行为学及海马齿状回区病理形态的影响
如图2-A所示,与对照组相比,模型组大鼠神经行为学评分明显升高(<0.01);与模型组相比,补阳还五汤组大鼠神经行为学评分明显降低(<0.01),补阳还五汤组与丁苯酞组组间无明显差异,提示补阳还五汤能改善脑缺血大鼠神经行为学评分。如图2-B所示,与对照组相比,模型组大鼠海马齿状回区神经元排列不规整,细胞间隙增宽,细胞核固缩;与模型组相比,补阳还五汤组与丁苯酞组大鼠海马齿状回区神经元排列相对整齐,细胞间隙减小,核仁清晰。

A-正离子模式 B-负离子模式 C-混合对照品正离子模式 1-腺嘌呤 2-鸟苷 3-染料木苷 4-苦杏仁苷 5-芍药内酯苷 6-芍药苷 7-毛蕊异黄酮苷 8-阿魏酸 9-没食子酰芍药苷 10-美迪紫檀苷 11-芒柄花苷 12-美迪紫檀苷 13-黄芪异黄烷苷 14-毛蕊异黄酮 15-黄芪甲苷IV 16-黄芪皂苷II 17-芒柄花素 18-大豆皂苷I 19-异黄芪皂苷II 20-棕榈酸 21-蒿本内酯

与对照组比较:**P<0.01;与模型组比较:##P<0.01,图5同
3.3 差异circRNA与富集分析
基于ceRNA芯片,发现大鼠脑缺血后有17个差异表达的circRNAs,其中3个上调,14个下调;经补阳还五汤干预后,大鼠海马组织有70个差异表达的circRNAs,其中67个上调,3个下调(图3-A、B)。对经补阳还五汤干预后差异表达circRNAs的母源基因进行GO功能及KEGG通路富集分析,发现GO功能的生物过程主要为细胞突触的各类调控、神经递质分泌及细胞衰老等;细胞组成主要为细胞突触、蛋白质复合物及钙通道复合物等;分子功能主要为Rab GTPase蛋白结合、蛋白质末端结合及离子通道结合等(图3-C);KEGG通路富集分析主要涉及自噬、血管内皮生长因子(vascular endothelial growth factor,VEGF)信号通路、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)信号通路等(图3-D)。
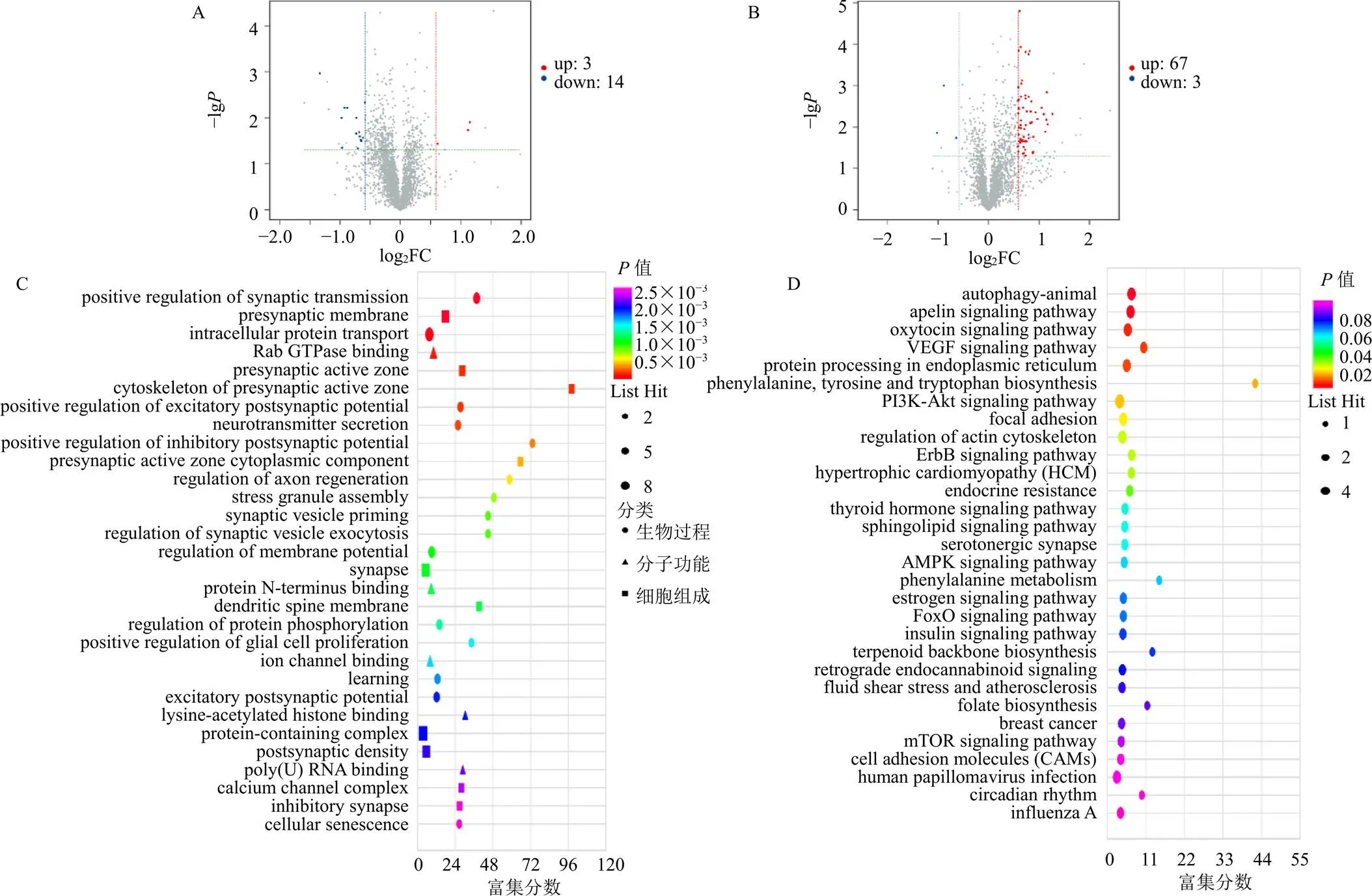
A-模型组与对照组差异circRNAs的火山图 B-补阳还五汤组与模型组差异circRNAs的火山图 C-GO功能富集分析 D-KEGG通路富集分析
3.4 差异mRNA与富集分析
如图4-A、B所示,大鼠脑缺血后有767个差异表达的mRNAs,其中443个上调,324个下调;经补阳还五汤干预后,大鼠海马组织有692个差异表达的mRNAs,其中236个上调,456个下调。补阳还五汤干预后差异表达的mRNAs GO功能富集的生物过程主要为G蛋白偶联受体信号通路、钾离子跨膜转运及内吞作用等;细胞组成主要为细胞膜、肌球蛋白丝及细胞间隙连接等;分子功能主要为G蛋白偶联受体活性、清道夫受体活性及多糖结合等(图4-C);KEGG通路富集分析涉及细胞外基质受体相互作用、血管平滑肌收缩及各类代谢等(图4-D)。

A-模型组与对照组差异mRNAs的火山图 B-补阳还五汤组与模型组差异mRNAs的火山图 C-GO功能富集分析 D-KEGG通路富集分析
3.5 补阳还五汤对脑缺血大鼠海马齿状回区PCNA及Nestin蛋白表达的影响
基因芯片KEGG主要富集结果中的自噬及PI3K-Akt信号通路等均与细胞周期、细胞增殖及神经再生密切相关[17-18],因此进一步验证补阳还五汤对脑缺血大鼠海马齿状回区PCNA及Nestin蛋白表达的影响。如图5所示,对照组大鼠海马齿状回区有极少量的PCNA及Nestin阳性细胞;与对照组比较,模型组大鼠海马齿状回区PCNA及Nestin阳性细胞数量增加(<0.01);补阳还五汤或丁苯酞干预后,PCNA及Nestin阳性细胞数量进一步增多(<0.01),提示补阳还五汤能促进脑缺血大鼠缺血海马齿状回区神经前体细胞增殖,诱导神经再生。
3.6 差异表达基因的验证
通过qRT-PCR验证基因芯片结果(图6),发现挑选的5个circRNAs中、及经补阳还五汤干预后显著上调(<0.05、0.01),经补阳还五汤干预后显著下调(<0.01),经补阳还五汤干预后有上调趋势,但无统计学意义;另外挑选的5个mRNAs经补阳还五汤干预后均显著上调(<0.01),结果均与芯片结果相似,证明基因芯片结果具有一定的可靠性。
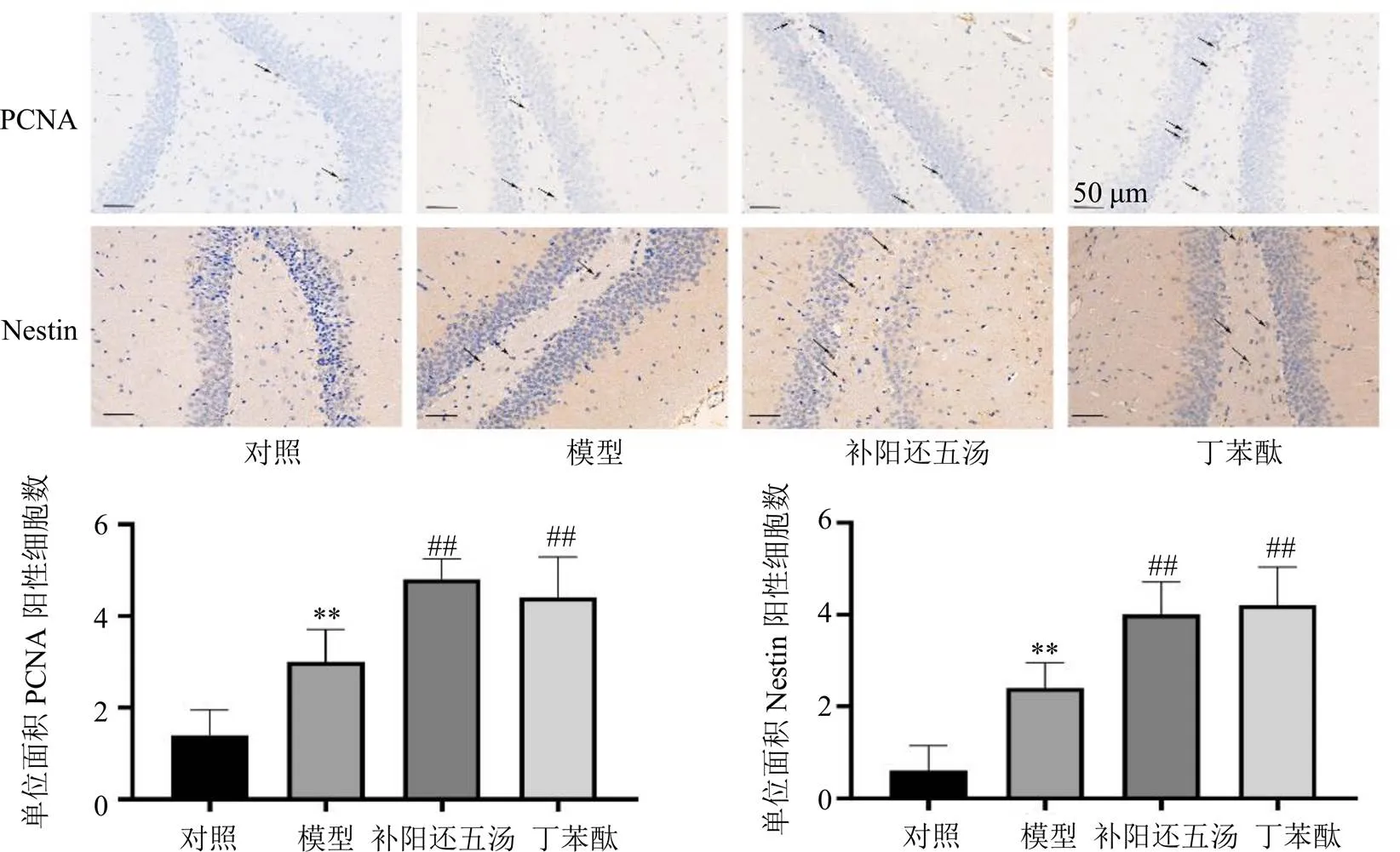
图5 补阳还五汤对脑缺血大鼠海马齿状回区PCNA及Nestin蛋白表达的影响(, n = 5)

与模型组比较:#P<0.05 ##P<0.01
3.7 circRNA-miRNA-mRNA三元转录网络的构建
为了进一步阐明差异circRNAs的生物学功能,首先筛选出与差异mRNAs显著正相关的circRNAs,接着以miRNA为核心,预测具有结合位点的circRNA-miRNA和miRNA-mRNA关系对,最终构建出由7个circRNA、9个miRNA及15个mRNA组成的circRNA-miRNA-mRNA三元转录网络(图7)。

圆形:circRNA;方形:miRNA;三角形:mRNA;红色:上调基因;绿色:下调基因
4 讨论
中医学将脑缺血归纳于“中风”范畴,并认为气虚血瘀为中风病的基本证候之一[19]。补阳还五汤由清代著名医家王清任所创,专用于中风气虚血瘀证的诊治。方中重用黄芪,补益元气使气旺以促血行;当归长于活血,有化瘀而不伤血之妙;佐以赤芍、川芎、红花、桃仁辅以活血祛瘀,地龙通经活络,为益气活血的代表方。临床研究亦表明补阳还五汤能改善脑梗死患者的血脑屏障,降低缺血再灌注损伤,促进脑内微血管新生[20]。
中药汤剂药效物质基础极其复杂,仅依靠传统研究方法无法系统阐明中药基于“整体观念”治疗的作用机制。目前,基于基因芯片的高通量检测手段能够从整个转录组水平探讨药物的治疗机制,并已逐渐用于筛选中医证候特异性标志物及中药治疗机制研究[21]。但截至目前,还未见补阳还五汤对脑缺血大鼠海马组织circRNA-miRNA-mRNA三元转录网络的报道。本研究结果表明,补阳还五汤能够改善脑缺血大鼠的神经行为学评分及缺血侧海马组织的病理形态,与之前的报道一致[22-23]。此外,还发现了70个差异表达的circRNAs和692个差异表达的mRNAs可能与补阳还五汤抗脑缺血损伤有关。通过生物信息学方法,本研究进一步构建了补阳还五汤影响的脑缺血大鼠海马circRNA- miRNA-mRNA三元转录网络,为揭示补阳还五汤多靶点协同治疗脑缺血的作用机制提供了新思路。
本研究发现补阳还五汤干预后有70个差异表达的circRNAs,其中67个上调、3个下调。其中经过验证的亦被称为,研究表明可作为ceRNA海绵,形成//金属基质蛋白酶2(matrix metalloproteinase 2,MMP2)轴,影响VEGFA的表达,敲除后MMP2与VEGFA表达下降,而的过表达逆转了MMP2和VEGFA的表达降低,并可促进血管新生[24]。另外,作为circRNA分子功能的效应器,本研究发现经补阳还五汤干预后共有692个差异表达的mRNAs,其中236个上调、456个下调,并挑选了5个与神经保护作用密切相关的基因进行验证。其中、均属于小窝蛋白家族,细胞膜小窝为细胞膜上的特殊凹陷,是各类细胞信号分子的聚集地,在血管内皮细胞及神经元细胞中有丰富的表达[25]。本课题组前期系列研究表明,补阳还五汤在脑缺血后能够通过小窝蛋白调控VEGF通路[26]、Notch信号通路[27]及PI3K/Akt/哺乳类动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路[28-29]发挥神经保护作用。主要由血管内皮细胞及巨核细胞合成和分泌,在脑缺血后与血管密度呈显著正相关,已有研究表明补阳还五汤能够增强脑缺血大鼠的表达,促进神经功能恢复[23]。归属于与神经再生密切相关的WNT信号通路,先前的研究发现补阳还五汤能在脑缺血后激活海马区组织WNT信号通路,减轻脑缺血损伤[30]。为一类癌基因,具有调控细胞周期的作用,补阳还五汤类方能够上调Bcl2蛋白表达,抑制细胞凋亡[17]。上述报道表明补阳还五汤能够通过多靶点发挥脑缺血后的神经保护作用,也验证了本研究的准确性。
KEGG通路富集分析进一步预测了差异circRNAs及mRNAs的潜在功能,结果发现VEGF信号通路与PI3K-Akt信号通路可能与补阳还五汤的抗脑缺血机制密切相关。VEGF信号通路是调控脑缺血后血管生成的经典通路,VEGF是胚胎发生和血管生成过程中血管形成的关键调节因子,研究表明VEGF可在细胞膜上与其受体VEGFR结合,触发磷酸化细胞外信号调节激酶(phosphorylated extracellular regulated kinase,p-ERK)、内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)等多个下游信号,从而促进血管生成[31]。已有研究表明补阳还五汤能在脑缺血后上调VEGF及其受体的表达,促进血管新生,发挥神经保护作用[4]。PI3K/Akt信号通路是参与细胞增殖、分化及存活的重要通路,有研究发现脑缺血后PI3K/Akt信号通路被激活,促进多种生长刺激因子的释放,诱导神经再生[32];而补阳还五汤能通过PI3K/Akt信号通路,促进缺血侧海马的神经发生,促进神经功能恢复[33]。PCNA与细胞DNA合成关系密切,只存在于增殖细胞中,为细胞增殖的标志物[34]。Nestin是神经干细胞的特异性标记物,常被用来标记神经前体细胞增殖[35]。本研究发现脑缺血后大鼠海马齿状回区PCNA及Nestin阳性细胞数量增加,补阳还五汤干预后PCNA及Nestin阳性细胞数量进一步增加。结合KEGG通路富集结果及已有报道,推测补阳还五汤可能通过多条信号通路促进脑缺血大鼠缺血海马区神经前体细胞增殖,诱导神经再生。
目前的主流观点认为,circRNA主要利用自身的miRNA反应元件,通过竞争性结合miRNA的方式,间接减小miRNA对其靶mRNA的抑制作用,从而实现对生物过程的调控[6]。因此,本研究构建了circRNA-miRNA-mRNA三元转录网络,以期进一步明确相关circRNA的ceRNA机制。最终发现补阳还五汤可能通过及等7个circRNAs,靶向海绵吸附、及等9个miRNAs,间接调控15个mRNAs的表达,发挥神经保护作用。相关研究亦证实了上述部分靶点的作用,如在脑缺血大鼠的血浆及缺血侧脑组织中表达降低,使用拮抗剂后能减少脑水肿及脑梗塞面积,并抑制细胞凋亡[36];是血管新生的抑制分子,下调的表达能够在大鼠脑缺血后促进缺血侧半暗带的血管新生[37]。但针对该三元转录网络的具体ceRNA轴,还需要进一步的验证。
综上所述,本研究探讨了补阳还五汤对脑缺血大鼠海马组织circRNA及mRNA表达谱的影响,并初步构建了circRNA-miRNA-mRNA三元转录网络,这些差异基因能够通过多条信号通路等发挥抗脑缺血损伤的作用,为后续研究奠定了基础。
利益冲突 所有作者均声明不存在利益冲突
[1] Mendelson S J, Prabhakaran S. Diagnosis and management of transient ischemic attack and acute ischemic stroke: A review [J]., 2021, 325(11): 1088-1098.
[2] Jiang C, Xu Y C, Zhang W,. Effects and safety of Buyang-Huanwu Decoction for the treatment of patients with acute ischemic stroke: A protocol of systematic review and meta-analysis [J].: Baltimore, 2020, 99(23): e20534.
[3] Liu B, Cai G, Yi J,. Buyang Huanwu Decoction regulates neural stem cell behavior in ischemic brain [J]., 2013, 8(25): 2336-2342.
[4] Cai G X, Liu B Y, Liu W,. Buyang Huanwu Decoction can improve recovery of neurological function, reduce infarction volume, stimulate neural proliferation and modulate VEGF and Flk1 expressions in transient focal cerebral ischaemic rat brains [J]., 2007, 113(2): 292-299.
[5] Hanan M, Soreq H, Kadener S. CircRNAs in the brain [J]., 2017, 14(8): 1028-1034.
[6] Hansen T B, Jensen T I, Clausen B H,. Natural RNA circles function as efficient microRNA sponges [J]., 2013, 495(7441): 384-388.
[7] Li S, Chen L, Xu C,. Expression profile and bioinformatics analysis of circular RNAs in acute ischemic stroke in a South Chinese Han population [J]., 2020, 10(1): 10138.
[8] dos Santos I R C, Dias M N C, Gomes-Leal W. Microglial activation and adult neurogenesis after brain stroke [J]., 2021, 16(3): 456-459.
[9] 张尚霞, 王宇红, 龙红萍, 等. 基于UPLC-Q-TOF-MS法的郁金水提物的化学成分研究 [J]. 中南药学, 2021, 19(5): 820-826.
[10] 曹东敏, 黄广枭, 胡旭光, 等. 基于核壳色谱技术的补阳还五汤指纹图谱构建及共有峰液质分析 [J]. 中草药, 2019, 50(21): 5239-5245.
[11] Longa E Z, Weinstein P R, Carlson S,. Reversible middle cerebral artery occlusion without craniectomy in rats [J]., 1989, 20(1): 84-91.
[12] Levy A, Bercovich-Kinori A, Alexandrovich A G,. CD38 facilitates recovery from traumatic brain injury [J]., 2009, 26(9): 1521-1533.
[13] Xie X R, Zhang L, Li X,. Liangxue Jiedu Formula improves psoriasis and dyslipidemia comorbidityPI3K/Akt/mTOR pathway [J]., 2021, 12: 591608.
[14] Xiang Y W, Kuai L, Ru Y,. Transcriptional profiling and circRNA-miRNA-mRNA network analysis identify the biomarkers in Sheng-ji Hua-yu Formula treated diabetic wound healing [J]., 2021, 268: 113643.
[15] Xiao Y. Construction of a circRNA-miRNA-mRNA network to explore the pathogenesis and treatment of pancreatic ductal adenocarcinoma [J]., 2020, 121(1): 394-406.
[16] Zhang Z G, Yue L F, Wang Y H,. A circRNA-miRNA-mRNA network plays a role in the protective effect of diosgenin on alveolar bone loss in ovariectomized rats [J]., 2020, 20(1): 220.
[17] 刘芳, 朱炎贞, 赵冯岩, 等. 补阳还五汤类方提取物对PC12细胞氧化应激损伤模型凋亡与自噬的调控[J]. 中草药, 2020, 51(20): 5228-5236.
[18] 李妍, 时悦, 李巍, 等. 开心散调控PI3K/Akt/GSK3β信号通路促进AD模型小鼠脑内神经再生 [J]. 中药药理与临床, 2020, 36(5): 73-78.
[19] 刘建勋, 陈进成, 郭浩, 等. 气血交互于脉的理论基础与实践 [J]. 中医杂志, 2020, 61(2): 98-102.
[20] 路永坤, 杨海燕, 刘向哲, 等. 补阳还五汤佐治超早期脑梗死患者对静脉溶栓后出血性转化的影响 [J]. 中国中药杂志, 2019, 44(8): 1696-1703.
[21] Cui H, Liu T, Li P,. An intersectional study of LncRNAs and mRNAs reveals the potential therapeutic targets of Buyang Huanwu Decoction in experimental intracerebral hemorrhage [J]., 2018, 46(5): 2173-2186.
[22] 冯雪枫, 李慢中, 詹宇, 等. 补阳还五汤促进脑缺血大鼠脑组织微结构重塑的作用 [J]. 北京中医药大学学报, 2021, 44(6): 500-509.
[23] 诸葛陆杰, 方燕, 金华倩, 等. 补阳还五汤上调miR-199a-5p表达促进脑缺血大鼠神经发生和血管生成 [J]. 浙江大学学报: 医学版, 2020, 49(6): 687-696.
[24] Liu X B, Shen S Y, Zhu L,. SRSF10 inhibits biogenesis of circ-ATXN1to regulate glioma angiogenesis via miR-526b-3p/MMP2 pathway [J]., 2020, 39(1): 121.
[25] Lisanti M P, Scherer P E, Vidugiriene J,. Characterization of caveolin-rich membrane domains isolated from an endothelial-rich source: Implications for human disease [J]., 1994, 126(1): 111-126.
[26] 王华. 补阳还五汤对caveolin-1敲除小鼠脑缺血后血管新生的作用及机理研究 [D]. 长沙: 湖南中医药大学, 2014.
[27] 周胜强, 易健, 刘柏炎. 补阳还五汤对Cav1/Notch1/ Hes1通路在小鼠脑缺血后海马NSCs增殖中的作用 [J]. 中药新药与临床药理, 2016, 27(6): 804-810.
[28] 陈博威, 周胜强, 易健, 等. 补阳还五汤对Cav-1−/−小鼠脑缺血模型PI3K、Akt、PTEN表达的影响 [J]. 中国中医药信息杂志, 2020, 27(4): 35-40.
[29] 陈博威, 周胜强, 易健, 等. 补阳还五汤对Cav-1敲除小鼠脑缺血后mTOR通路的影响 [J]. 湖南中医药大学学报, 2020, 40(4): 418-422.
[30] 罗东. 补阳还五汤对局灶性脑缺血 (MCAO) 小鼠脑内Wnt信号通路构成因子的影响 [D]. 长沙: 湖南中医药大学, 2017.
[31] Hatakeyama M, Ninomiya I, Kanazawa M. Angiogenesis and neuronal remodeling after ischemic stroke [J]., 2020, 15(1): 16-19.
[32] Beker M C, Caglayan B, Caglayan A B,. Interaction of melatonin and Bmal1 in the regulation of PI3K/AKT pathway components and cellular survival [J]., 2019, 9(1): 19082.
[33] Chen X, Chen H S, He Y C,. Proteomics-guided study on Buyang Huanwu Decoction for its neuroprotective and neurogenic mechanisms for transient ischemic stroke: Involvements of EGFR/PI3K/Akt/Bad/14-3-3 and Jak2/ Stat3/cyclin D1 signaling cascades [J]., 2020, 57(10): 4305-4321.
[34] 李霞, 曹旺, 刘彩霞, 等. 黄芪-当归配伍对家兔血管内膜增生、平滑肌细胞表型转化和增殖的影响 [J]. 中草药, 2021, 52(15): 4598-4606.
[35] Park D, Xiang A P, Mao F F,. Nestin is required for the proper self-renewal of neural stem cells [J]., 2010, 28(12): 2162-2171.
[36] Zuo W, Yan F, Liu Z,. miR-330 regulates Drp-1 mediated mitophagy by targeting PGAM5 in a rat model of permanent focal cerebral ischemia [J]., 2020, 880: 173143.
[37] 靳兰洁, 李莎莎, 周璇, 等. 电针脑缺血大鼠水沟穴调节微小RNA-328促进血管新生的机制研究 [J]. 中华老年心脑血管病杂志, 2017, 19(3): 308-311.
Effect of Buyang Huanwu Decoction on circRNA-miRNA-mRNA transcriptional network in hippocampus of rats with cerebral ischemia
CHEN Bo-wei1, TANG Rong-mei1, YI Jian2, LONG Hong-ping2, LIU Bai-yan1
1. Hunan University of Chinese Medicine, Changsha 410208, China 2. The First Affiliated Hospital of Hunan University of Chinese Medicine, Changsha 410007, China
To reveal the effects of Buyang Huanwu Decoction (补阳还五汤, BHD) on circular RNA (circRNA)-microRNA (miRNA)-mRNA transcriptional network in hippocampal of rats with cerebral ischemia, explore its mechanism for treatment of cerebral ischemia.UPLC-Q-TOF/MS was used to analyze the chemical composition of BHD. SD rats were randomly divided into control group, model group, BHD (5 g/kg) group and butylphthalide (54 mg/kg) group. The middle cerebral artery embolization method was used to replicate cerebral ischemia model in all groups except control group. After 7 d of intervention, neurobehavioral scores, HE staining and immunohistochemistry were used to evaluate the efficacy of BHD, competing endogenous RNA (ceRNA) microarray was used to screen circRNAs and mRNAs differentially expressed. Main biological processes involved in differential genes was analyzed by gene ontology (GO) function and Kyoto encyclopedia of genes and genomes (KEGG) pathway enrichmen; qRT-PCR was used to validate the gene microarray results. Finally, circRNA-miRNA-mRNA transcriptional network was constructed.A total of 21 compounds including astragaloside IV, dormononetin, ferulic acid and paeonilactone glycosides were identified in BHD. Rats developed neurological dysfunction and hippocampal neuronal cell damage after cerebral ischemia, and BHD could partially reverse the above injury, increase the expression of proliferating cell nuclear antigen (PCNA) and Nestin in hippocampal dentate gyrus. The ceRNA microarray identified 27 differentially expressed circRNAs and 767 differentially expressed mRNAs after cerebral ischemia in rats, and 70 differentially expressed circRNAs and 692 differentially expressed mRNAs after BHD treatment. A ternary transcriptional network consisting of seven circRNAs, nine miRNAs and 15 mRNAs was constructed. Bioinformatics analysis showed that these targets may play a therapeutic role through autophagy, vascular endothelial growth factor (VEGF) signaling pathway and phosphatidylinositol 3-kinase (PI3K)-protein kinase B (Akt) signaling pathway.BHD may promote the proliferation of hippocampal neural progenitor cells and induce nerve regeneration by affecting circRNA-miRNA-mRNA transcriptional network in the hippocampus of cerebral ischemia rats, involving multiple pathways and multiple biological processes.
Buyang Huanwu Decoction; cerebral ischemia; circRNA; miRNA; ceRNA; gene microarray; nerve regeneration; astragaloside IV; dormononetin; ferulic acid; paeonilactone glycosides
R285.5
A
0253 - 2670(2022)01 - 0143 - 11
10.7501/j.issn.0253-2670.2022.01.018
2021-09-30
国家自然科学基金资助项目(82074251);湖南中医药大学中医学一流学科开放基金项目(2021ZYX38)
陈博威(1994—),男,博士研究生,研究方向为中医药防治心脑血管疾病的研究。Tel: (0731)88536925 E-mail: clewaychan@stu.hnucm.edu.cn
刘柏炎(1970—),男,教授,博士生导师,研究方向为中医药防治心脑血管疾病的研究。Tel: (0731)88536925 E-mail: liubaiyan@126.com
[责任编辑 李亚楠]
