南水北调东线工程运行3年后东平湖浮游植物群落特征及环境驱动因子*
2022-01-12董贯仓冷春梅丛旭日朱士文孙鲁峰高云芳李秀启
董贯仓,冷春梅,丛旭日,刘 超,朱士文,孙鲁峰,高云芳,客 涵,李秀启
(1:山东省淡水渔业研究院,济南 250013)
(2:山东省淡水水产遗传育种重点实验室,济南 250117)
东平湖(35°30′~36°20′N,116°00′~116°30′E)位于山东省东平县境内,总面积627 km2(其中新湖区418 km2,老湖区209 km2). 其属浅水草型湖泊,大致经历了原始自然捕捞、1980s起“以养为主”的“三网”养殖以及2005年同步增殖放流并于2017年后全面发展生态渔业3个渔业发展阶段[1-2]. 目前,作为南水北调东线最后一个调蓄湖和山东省第二大淡水湖,东平湖承担着分滞黄河洪水和接纳大汶河水的重任,是“南水北调”的重要枢纽以及山东省的重要淡水渔业生产基地[3]. 南水北调在实现水资源跨流域转移的同时,水体理化性质及沿线水体水文动力特征必将改变,并将会对水体生态系统造成复杂和不确定的影响. 同时,《南水北调总体规划》对输水干线的水质要求达到地表水Ⅲ类标准,东平湖对保障华北和胶东用水安全至关重要. 栗文佳等[4]对近40年东平湖水质及驱动因素的分析认为,东平湖水质主要受入湖径流量、工业废水和城市污水、湖区网围养殖、流域农业面源污染、旅游业、水环境综合治理以及工程调水等影响. 胡尊芳[5]通过对调水通水前的2012年及通水后的2015年的不同水文时期的东平湖水环境的监测,认为工程调水有利于东平湖水环境的改善,但需加强湖区环境保护及污染源管控. 随着南水北调东线工程2013年底的试通水及其后常态化调水,以及湖区渔业养殖的全面退出,东平湖水域环境的适时监测有助于进一步完善调水工程措施并保障下游用水安全.
浮游植物是湖泊水域生态系统的重要组成部分,作为水体中的主要初级生产者及水域食物链的基础,对维持水域生态系统的平衡、物质循环与能量流动具有十分重要的作用[6-7];同时,作为鱼、虾、贝等水生动物的食物来源,与渔业生产关系密切;此外,浮游植物群落对环境变化敏感,其种类组成、群落结构和数量变化可反映水环境状况[8-9],相比理化监测具有长期性和综合性等优点,能较好地反映出污染物的综合效应并客观、全面地反映水环境质量状况[10],故被广泛应用于湖泊水域环境监测和评价. 现有东平湖浮游植物群落的调查研究[11-15],多发生在增殖放流后及调水工程通水前,并且集中于种类组成、生物量等群落结构调查;在调水工程通水后,则仅见冷春梅等[16]于调水初期试运行阶段对浮游植物群落结构的调查. 近年来,南水北调东线工程已实现调水常态化,东平湖水域的渔业生产方式、资源养护活动及水环境治理工程均发生较大转变,必然造成湖泊水域生境与浮游植物群落的变动. 一方面,浮游植物群落可反映工程调水下东平湖水体理化性质的变动状况;另一方面,探究浮游植物群落变动的驱动因子有助于预测工程调水等人类活动对水域生境的影响,并对进一步完善调水保障措施和指导渔业生产具有重要作用. 本研究通过2017年对东平湖浮游植物及水质的调查,分析调水工程运行后东平湖浮游植物群落结构变化特征及其环境驱动因子,以期为合理评估东平湖水质状况及针对性地实施水质涵养措施提供科学依据,并将为保障南水北调用水安全与沿线水体综合管护增添基础资料.
1 材料与方法
1.1 位点设置
依据地理方位、水源汇入及湖区开发利用等状况,在东平湖内设置18个采样点(图1,其中D16、D17和D18分别为南水北调出湖口、入湖口及大汶河入湖口),基本涵盖了入湖河流、调水渠道、历史养殖区、自然保护区等水域,并分别于2017年3月初(冬季)、5月(春季)、8月(夏季)和11月(秋季)进行了调查采样.

图1 东平湖调查站点分布
1.2 样品采集与处理
1.2.1 浮游植物 用有机玻璃采水器采集表水样(0.5 m),取1 L水样加入15 mL鲁哥试剂固定后带回实验室,静置沉淀24 h后浓缩镜检. 镜检计数在10×40倍光学显微镜下进行,首先充分摇匀浓缩液,然后取出并放入0.1 mL计数框中,观察100个视野,每样品计数两次,若两片计数个数相差15%以上则进行第3片计数,取相近两片平均值换算成每升水样的细胞个数,即为浮游植物密度. 根据形态相似的几何学方法计算浮游植物体积,并转换为生物量[17],浮游植物种类鉴定参考《中国淡水藻类——系统、分类及生态》[18].
1.2.2 水质 透明度(SD)用塞式罗盘测定,水温(WT)、溶解氧(DO)、pH等采用YSI-MP556型水质仪现场测定;并参照《水与废水监测分析方法》[19],主要测定高锰酸盐指数(CODMn)、氨氮(NH3-N)、总氮(TN)和总磷(TP)等指标.
1.3 数据处理
1.3.1 浮游植物群落结构 用物种数(S)、密度(d)、生物量(B)、优势度指数(Y)、Shannon-Wiener多样性指数(H′)[20]和Margalef丰富度指数(D)[21]等,分析浮游植物群落特征,将优势度指数Y≥0.02的藻类设为优势种[22].
1.3.2 水质状况评价 水体质量状况的评价主要参照《湖泊(水库)富营养化评价方法及分级技术规定》中的综合营养状态指数(TLI)法.
1.3.3 浮游植物群落结构与环境因子的相关性分析 所有数据通过Excel软件整理,使用SPSS 21.0软件进行差异显著性和Pearson相关分析. 用CANOCO 4.5软件进行冗余分析(RDA),分析浮游植物物种信息与环境因子的相关关系,进入分析的物种需满足至少在一个采样点的相对密度≥1%并且出现频率≥30%[23],去趋势分析(DCA)显示,各轴梯度长度最大的为1.3(小于3),故选用RDA. 为保证数据的正态性,所有数据均进行lgx转换;RDA分析中,先对环境变量进行预选(forward selection),并检验各环境变量贡献率的显著性(蒙特卡洛置换检验,Monte Carlo permutation test, 499次),最后选取具有显著贡献的环境变量应用CanoDraw软件绘制RDA图. 数据显著性水平确定为P<0.05.
2 结果
2.1 东平湖水域浮游植物群落特征
2.1.1 种类组成及优势种 东平湖调查中,共鉴定浮游植物191种属(包括变种),其中硅藻门、绿藻门、裸藻门、蓝藻门、金藻门、黄藻门、甲藻门和隐藻门分别为64、57、28、22、8、5、4和3种属,优势种属分别为蓝藻门的漂浮泽丝藻(Limnothrixplanctonica)和色球藻(Chroococcussp.),绿藻门的小球藻(Chlorellavulgaris),硅藻门的小环藻(Cyclotellasp.)、舟形藻(Nauiculasp.)和针杆藻(Synedrasp.)(表1).
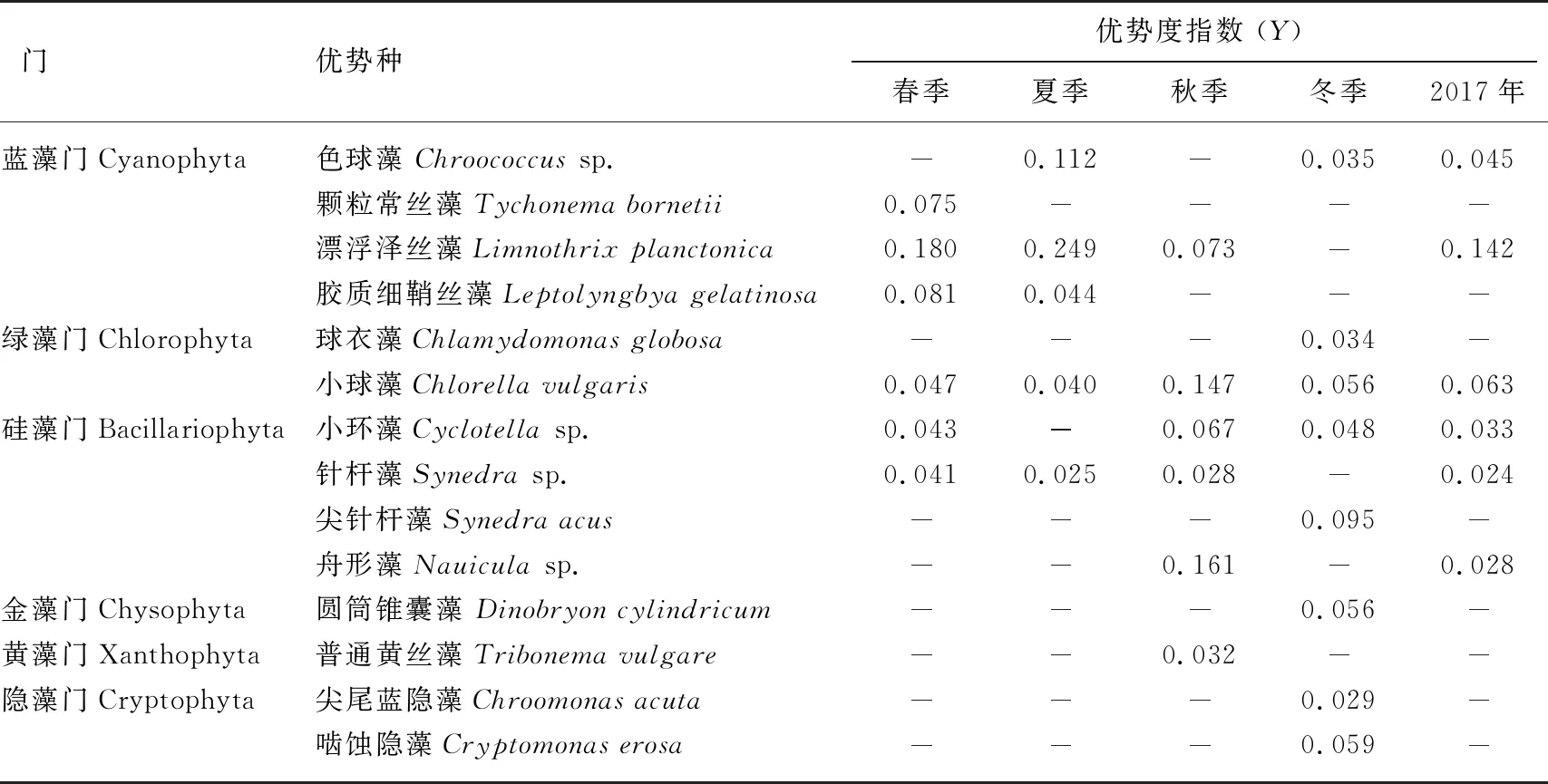
表1 东平湖不同季节浮游植物的优势度
从季节来看,物种数大小顺序为冬季>夏季>春季>秋季,其中冬季125种属,优势种为蓝藻门的色球藻,绿藻门的球衣藻(Chlamydomonasglobosa)、小球藻,硅藻门的小环藻、尖针杆藻(Synedraacus),金藻门的圆筒锥囊藻(Dinobryoncylindricum)以及隐藻门的尖尾蓝隐藻(Chroomonasacuta)、啮蚀隐藻(Cryptomonaserosa);夏季78种属,优势种为蓝藻门的色球藻、漂浮泽丝藻和胶质细鞘丝藻(Leptolyngbyagelatinosa),绿藻门的小球藻以及硅藻门的针杆藻;春季71种属,优势种为蓝藻门的颗粒常丝藻(Tychonemabornetii)、漂浮泽丝藻和胶质细鞘丝藻,绿藻门的小球藻以及硅藻门的小环藻和针杆藻;秋季53种属,优势种为蓝藻门的漂浮泽丝藻,绿藻门的小球藻,硅藻门的小环藻、针杆藻和舟形藻以及黄藻门的普通黄丝藻(Tribonemavulgare).
2.1.2 密度和生物量 东平湖不同季节不同站位的浮游植物密度变化范围为0.24×106~27.42×106cells/L(年平均值为6.74×106cells/L),呈现单峰模式并在夏季呈现峰值(图2),全年最低值出现在秋季的D9站位和最大值出现在夏季的D11站位,其季节差异显著(P<0.05),但无显著空间差异(P>0.05);生物量变化范围为0.20~38.25 mg/L(年平均值为5.71 mg/L),亦呈现单峰模式并在夏季呈现峰值(图3),全年最低值出现在春季的D15站位,最大值出现在秋季的D5站位,其季节差异显著(P<0.05),而空间差异仅D5显著高于D1、D3、D4、D6、D7和D14站位(P<0.05).

图2 2017年东平湖浮游植物密度的时空变化

图3 2017年东平湖浮游植物生物量的时空变化
2.1.3 多样性指数 本调查中,东平湖浮游植物Shannon-Wiener多样性指数和Margalef丰富度指数呈现显著的时间差异(P<0.05),而基本无显著空间差异(P>0.05,图4). 其中,Shannon-Wiener多样性指数介于0.63~2.99之间,4个季度均值分别为1.90、1.84、1.76和2.52,不同站位均值介于1~3之间;Margalef丰富度指数介于0.68~6.37之间,4个季度均值分别为3.07、3.98、2.79和4.75,不同站位均值介于2.84~4.82之间.

图4 2017年东平湖浮游植物生物多样性指数
2.2 主要环境因子状况
东平湖2017年主要水环境因子的季节变化特征见表2. 调查期间,水温介于8.81~31.20℃之间,最高水温(31.20℃)出现在夏季. 水体透明度介于0.20~1.70 m之间,最高值为春季D15的1.70 m,最低值为春季调水期间调水工程入湖口(D17)的0.20 m. pH介于7.65~10.27之间,最高值出现在春季而最低值出现在秋季. DO浓度介于4.62~17.08 mg/L之间,最高值出现在冬季而最低值出现在春季. NH3-N浓度在0.0039~0.3044 mg/L之间,冬季的D15站位全年最高而D1站位全年最低. TN浓度在0.5032~2.8609 mg/L之间,夏季的D18站位全年最高而D14站位全年最低. TP浓度在0.0093~0.1262 mg/L之间,夏季的D12站位全年最高而冬季的D1站位全年最低. CODMn在1.25~31.25 mg/L之间,冬季的D12站位全年最高而秋季的D8站位全年最低. 此外,东平湖水体相关加权TLI介于42.13~62.47之间,总体属轻度富营养.

表2 2017年东平湖主要环境因子的季节变化*
对不同环境因子时空分布的ANOVA分析结果显示,东平湖不同的水环境因子均呈现显著的时间差异(P<0.05),但同时基本无显著空间差异(P>0.05).
2.3 浮游植物群落对水环境因子的响应
2.3.1 Pearson相关性分析 将不同季节的浮游植物物种数、生物量、密度、Shannon-Wiener多样性指数和Margalef丰富度指数与环境因子进行相关性分析,结果表明物种数与NH3-N和CODMn浓度呈极显著正相关,与TN浓度呈显著正相关,与SD呈显著负相关;密度与WT、TN、TP、Chl.a浓度及TLI呈极显著正相关,与pH、SD呈极显著负相关,与DO浓度呈显著负相关;生物量与Chl.a浓度呈极显著正相关,与NH3-N及TLI呈显著正相关,与pH及SD呈显著负相关;Shannon-Wiener多样性指数与DO、NH3-N及CODMn浓度呈极显著正相关,与pH呈显著正相关,与WT和Chl.a浓度呈显著负相关;Margalef丰富度指数与NH3-N及CODMn呈极显著正相关,与DO浓度呈显著正相关(表3).

表3 东平湖浮游植物与环境因子的相关性矩阵
2.3.2 冗余分析 环境因子与浮游植物群落结构以及13个代表物种间的RDA分析结果(图5)显示,共筛选出5个对浮游植物群落的结构多样性变化起重要作用的显著环境影响因子,即TLI、CODMn、NH3-N、pH、WT和DO,它们共同解释了48.3%的浮游植物群落多样性信息,其中TLI解释率为22% (P=0.002,F=19.87)、CODMn为11%(P=0.002,F=11.69)、NH3-N为6%(P=0.002,F=6.33)、pH为5%(P=0.002,F=5.36)、WT为4%(P=0.006,F=5.41)、DO为3%(P=0.002,F=3.69). 从图5还发现,TLI与WT呈显著正相关,二者具有协同影响作用,pH与DO亦如此,且两组因子均主要对色球藻、漂浮泽丝藻、卵形衣藻、小球藻、双对栅藻、四尾栅藻、小型黄丝藻、针杆藻、蓝隐藻等代表物种的密度及浮游植物的密度d和Shannon-Wiener多样性指数H′等指标产生较高影响但相关性相反,表明了两组环境因子对群落截然相反的生态影响;CODMn和NH3-N亦具有协同作用,二者主要对小环藻、舟形藻、球衣藻和啮蚀隐藻等代表物种的密度及浮游植物生物量B、物种数S和Margalef丰富度指数D等指标产生较高正相关影响.
3 讨论
3.1 东平湖浮游植物群落结构的演替特征
本次调查中,东平湖共获得浮游植物191种属,优势种为蓝藻门的漂浮泽丝藻和色球藻,绿藻门的小球藻,硅藻门的小环藻、舟形藻和针杆藻,密度和生物量分别为6.74×106cells/L和5.71 mg/L. 以南水北调东线工程全线贯通并试通水的2013年度为界,东平湖浮游植物在调水前[11-15]、调水初期[16]及调水后的历年调查情况见表4. 本次调查获得191种属,与路学堂[15]2010-2012年调查到的207种(包括变种)相当,略高于Tian等[14]2010-2011年的132种,明显高于冷春梅等[16]2013年和郭沛涌等[12]1994年的99种属以及冷春梅等[13]2007年的83种属,远高于1980年的68种属[11],表明了长期以来尤以21世纪以来浮游植物物种数的显著增加.

表4 近现代东平湖浮游植物群落结构特征
同时,东平湖浮游植物群落结构发生了较大改变,蓝藻门逐步占据浮游植物群落的优势地位. 1980年调查中,东平湖浮游植物优势种群主要为一些绿藻门、硅藻门、甲藻门和裸藻门种类[11];至1994年,冷季仍以硅藻、绿藻和隐藻占据数量优势,但暖季蓝藻已逐步占据数量优势[12];进入21世纪以来,历次调查特别是在夏、秋季节蓝藻门均为优势种群[13-16].
此外,东平湖浮游植物密度和生物量的变化趋势与物种数相似,2010年以来虽稍波动,但在较长时间尺度上均显著升高. 本次调查浮游植物密度为6.74×106cells/L,近现代调查中仅稍低于2010-2012年的9.65×106cells/L[15],而稍高于2010-2011年的5.11×106cells/L[14]和2013年的4.59×106cells/L[16],并显著高于相对久远的1994年的1.21×106cells/L[12]和1980年的2.40×106cells/L[11].
3.2 东平湖浮游植物群落的主要环境影响因子
一般而言,水体深度、温度[24]、透明度、pH[25]、DO[26]、营养盐[27]等水环境因子均影响浮游植物的群落组成、密度及分布. Pearson相关性分析结果表明,东平湖水体温度、pH、透明度、DO、NH3-N、TN、TP、Chl.a及CODMn等水环境因子分别与不同的浮游植物群落结构特征指标呈较强的相关性(表3);RDA分析结果也显示,TLI、CODMn、NH3-N、pH、WT和DO是浮游植物群落的显著环境影响因子,共同解释了48.3%的群落多样性信息(图5).
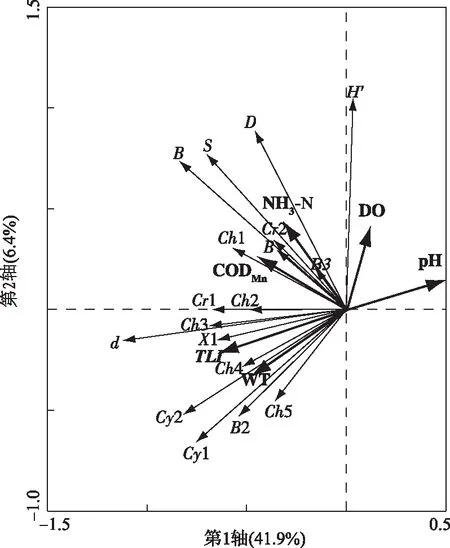
图5 东平湖浮游植物物种信息与非生物环境因子的RDA排序图(Cy1:色球藻Chroococcus sp.;Cy2:漂浮泽丝藻Limnothrix planctonica;Ch1:球衣藻Chlamydomonas globosa;Ch2:卵形衣藻Chlamydomonas ovalis;Ch3:小球藻Chlorella vulgaris;Ch4:双对栅藻Scenedesmus bijuga;Ch5:四尾栅藻Scenedesmu quadricauda;B1:小环藻Cyclotella sp.;B2:针杆藻Synedra sp.;B3:舟形藻Nauicula sp.;X1:小型黄丝藻Tribonema minus;Cr1:蓝隐藻Chroomomonas sp.;Cr2:啮蚀隐藻Cryptomonas erosa)
首先,营养盐作为浮游植物生长繁殖的必需物质,影响着浮游植物的生长及生物量[27-28].TLI体现了水体N、P营养物质的综合积累状况,本研究的RDA分析表明TLI解释了22%的浮游植物群落信息,并对Cy1、Cy2、Ch2、Ch3、Ch4、Ch5、X1、B2、Cr1等代表物种及浮游植物群落的密度产生较高正相关影响,对Shannon-Wiener多样性指数产生较高负相关影响,表明水体的富营养化会导致浮游植物密度的升高及群落多样性的降低. 同时,RDA分析显示水体TN与TP浓度对浮游植物无显著影响. 雷沛等[29]研究认为,当水体氮、磷浓度分别超过0.2和0.02 mg/L的临界浓度即可满足藻类的生长需要. 可能由于东平湖水体氮磷元素较丰富且相对均衡,未表现出单一元素的限制作用. 此外,浮游植物对于维持其新陈代谢所必需的氮元素多偏好氨氮盐类[30],营养盐类的存在形态对浮游植物也具有重要影响. Mengesha等[31]研究发现,氨氮占浮游植物摄取氮元素的60%以上. Zhang等[32]对太湖的研究也发现,氨氮是夏秋季蓝藻种群增长的重要驱动因子. RDA分析中,NH3-N解释了6%的浮游植物群落信息,并对B1、B3、Ch1和Cr2等代表物种的密度及浮游植物群落的生物量、物种数和Margalef丰富度指数等指标产生较高正相关影响,表明氨氮盐类是浮游植物生物量的重要影响因子. 另外,CODMn是水体有机污染的表现特征,亦与浮游植物群落具有较大相关性,其在浮游植物大量繁殖的水体中往往较高[33]. 本研究中,CODMn和NH3-N具有协同作用,均对B1、B3、Ch1和Cr2等代表物种的密度及浮游植物群落的生物量、物种数和Margalef丰富度指数等指标产生较高正相关影响,表明氨氮盐类和CODMn共同促进浮游植物生物量及物种丰富度的升高.
同时,pH[25]、DO[26]等水体理化状况对浮游植物群落结构及其分布也具有重要影响[34-35]. 弱碱性环境有利于浮游植物吸收空气中的CO2,促进其光合作用从而具有较高的初级生产力;而浮游植物在酸性水体中普遍生长较慢[36]. 宋任彬等[37]对滇池的研究也发现,水体pH值与浮游植物的光合作用强度呈显著正相关. 同时,DO也是影响湖泊浮游植物群落的重要环境因子,充足DO的水体中浮游生物密度、生物量和多样性指数一般较高,大量研究即表明DO浓度与浮游植物的生长呈显著正相关[38-39]. 本研究中,RDA分析表明pH与DO浓度呈显著正相关,均对Cy1、Cy2、Ch2、Ch3、Ch4、Ch5、X1、B2、Cr1等代表物种及浮游植物群落的密度产生较高负相关影响并对Shannon-Wiener多样性指数产生较高正相关影响,其与浮游植物密度的关系与上述结果存在一定差异. 赵旭辉等[40]认为,浮游生物的大量生长可能消耗水体CO2,进而引起了水体pH的升高. 同时,赵海超等[41]对洱海水环境的研究表明,浮游植物过量增加会成为DO浓度降低的“助推器”;欧阳潇然等[42]对太湖梅州湾的研究也表明,浮游植物的呼吸作用及消亡后被降解是水体DO浓度降低的主要原因. 本研究中东平湖水体pH和DO浓度与浮游植物密度呈负相关关系,可能是东平湖大量浮游植物的生长代谢造成了水体pH和DO水平的差异.
另外,水温也可对浮游植物的种类和季节变化产生重要影响[43]. 一般来讲,较高温度更适宜蓝藻的增殖,硅藻在低温更具竞争力以及绿藻对水温适应范围较广[25]. 东平湖浮游植物的密度主要取决于蓝藻门、硅藻门和绿藻门类群(图2),其中蓝藻随水温上升在春季逐步占据优势并于夏季占据绝对优势,而硅藻虽在秋季和冬季占据优势但绿藻和硅藻数量的季节波动均较蓝藻小,故而夏季浮游植物密度最高但多样性指数较低. RDA分析也表明,WT解释了4%的浮游植物群落信息,并对Cy1、Cy2、Ch2、Ch3、Ch4、Ch5、X1、B2、Cr1等代表物种及浮游植物群落的密度产生较高正相关影响并对Shannon-Wiener多样性指数产生较高负相关影响. 同时,本研究RDA分析表明WT与TLI呈显著正相关,二者具有协同作用. 而水温变化主要与季节有关,也说明了东平湖水质在不同季节有明显变化且以高温的夏秋季水质较差,浮游植物多样性即随夏秋季富营养化程度的升高而呈下降趋势. 此外,全球气候变暖的趋势下,水温的升高会促进多数浮游植物的生长[44],且因不同种类对温度变化响应的差异,在全球暖化下发生生态位的改变[45]. 于东平湖浮游植物而言,季节温度变化下呈现以绿藻和硅藻向蓝藻占据绝对优势的演替趋势,并且在春季即已呈现出蓝藻优势. 在全球气候变暖的形势下,水温的上升可能会导致蓝藻优势时期的延长,并且调水过程中南水的汇入可能会提升受水水体水温以及将高温种提前带入,其是否加重蓝藻优势仍需进一步的验证分析.
3.3 南水北调工程等驱动因子的影响
除水体理化状况外,捕食压力[46]、鱼类的丰度和群落组成[47]以及水流流速、水团混合状况等水文和水体动力学特征[48]也会影响湖泊水域浮游植物的生长及群落演替.
南水北调东线工程将水资源从长江流域向淮河、黄河流域的调度,被转移水体及沿线水体的理化状况及其水文、水动力学特征势必改变,该改变在一定程度上也将影响受水水域浮游植物群落特征的变化[49]. 李庆等[50]研究发现,调水水文脉冲影响下浮游植物群落在一个调水周期的优势种更替剧烈,并认为优势种的变动可能受调水与季节变化共同的影响. 赵立宾等[51]对引黄济青棘洪滩水库近15年的调查分析却认为,温度和光照是水库浮游植物生长的主要驱动因子. 根据优势种的分布结果(表1),非调水期的夏季与调水期的春季及秋季的优势种重复率高于调水期间的冬季与春季以及秋季与冬季间的重复率,说明优势种的更替主要受季节变化引起的温度变化影响而非调水工程影响. 田家怡等[52]调查发现南水北调东线输水沿线主要优势种特别是12种富营养化藻类分布广、密度高,而本调查中不同季节的优势种与调水前的2007年[13]和调水初期的2013年[16]基本一致,可能由于南水北调东线沿线湖库水体浮游植物种类的高度同质性,调水工程未造成东平湖浮游植物种类的剧烈变动. 同时,当前东平湖浮游植物的密度和生物量低于调水前[15]而高于调水初期[16],可能湖区养殖逐步撤除[1]及流域内水质调控工程下湖区水质的逐步改善造成了调水前期浮游植物量的降低;而调水期间调水工程入湖口(D17)的水体营养物质浓度多高于大汶河入湖河段(D18)并均高于调水工程出湖口(D16),可能外源营养物质的汇入引起浮游植物量的再次升高,浮游植物密度D18>D17>D16及生物量D17>D18>D16亦验证了该点(图2,3). 2013年南水北调东线工程通水以来,工程调水已成为东平湖重要的补给水源之一. 依据工程设计,东平湖具备年度调江水14.67亿m3的能力,且截至2018-2019调水年度已累计调引长江水达38.3亿m3[53]. 除2013年试通水并运行调水3400万m3[15]外,东平湖年平均调水约7.6亿m3. 而在调水工程前,大汶河为东平湖的主要补给水源,流域多年平均径流量为11.49亿m3[54]. 于调水工程后的东平湖而言,其年汇入水量已增加约2/3,而本研究中工程调水水体(D17)的营养物质浓度多高于大汶河入湖河段(D18)并均高于出湖口(D16),南水北调的常态化运营下更多更高营养物质浓度水体的汇入,其带来的物质积累可能造成水体富营养化的加剧,增加夏、秋季主要优势种蓝藻的暴发风险,必然成为东平湖生态调控能力的巨大挑战,而其长期的复杂影响更有待进一步的监测及环境治理措施的持续加强实施. 此外,东平湖浮游植物的Shannon-Wiener多样性指数稍高于调水初期[16]而显著低于调水前[15],与李庆等[50]发现的调水后南四湖浮游植物Shannon-Wiener多样性指数整体呈下降趋势的研究结果基本一致. 虽然目前调水工程尚未对东平湖浮游植物优势种更替造成剧烈影响,但可能已通过带入营养物质影响湖区水质并导致浮游植物密度和生物量的升高,其在更长时期的常态化运营后可能会造成浮游植物群落结构的变化.
同时,渔业生产作为湖泊的重要功能之一,一方面无序的投饲养殖会造成营养物质的富集,另一方面增养殖鱼类也会直接摄食或间接影响浮游生物群落. 东平湖自1980s起坚持“以养为主”的渔业,2005年开始实施增殖放流,后随调水工程建设至2017年全部清退湖区养殖转而发展生态渔业. 与之对应,1980年浮游植物主要由绿藻门、硅藻门、甲藻门和裸藻门种类组成[11],后随养殖业快速发展至1994年蓝藻在暖季占据一定数量优势[12]. 自1990s[55]特别是21世纪[56]以来,湖区活跃的渔业生产及外源废污水的汇入造成水体营养物质的大量富集,蓝藻2007年[13]及其后占据了浮游植物群落的主要优势. 但是,浮游植物密度在1994和2007年却稍低于1980年[11-13],其中1994年为湖泊养殖快速发展期及2007年为同步实施湖区增殖的快速发展期,可能湖区大规模网箱养殖及主要增殖的鲢鳙鱼有效控制了浮游植物的生长繁殖. Xiao等[46]研究即认为,一定放养密度的鲢鳙鱼可有效控制浮游植物的现存量. 此外,东平湖浮游植物密度与生物量在2010年后呈波动升高并显著高于2007年以前,可能是由于随湖区养殖的逐步全部清退,虽然增殖放流稳定于较大规模但湖内鲢鳙鱼总量显著减少. 由此可见,虽然湖区养殖的清退降低了水体营养物质积累及富营养化风险,但浮游植物生物量却存在一定程度的升高,渔业利用方式对湖区浮游植物群落的复杂影响也有待进一步研究.
综上所述,伴随南水北调东线工程的建成通水及近年来湖区渔业生产方式的巨大转变,东平湖水文条件、水环境质量已发生较大变化[1],湖泊水生生态系统也在逐步改变[16]. 一方面,湖泊水域内营养物质的积累以及南水北调大量调水等外来水源的营养物质汇入,将是当前东平湖生态系统良好水质调控功能的巨大挑战,应通过加强调水上游的水质改善和湖区水质调控工程建设以及湖泊生境承载能力的跟踪监测,以防止湖泊水体的富营养化并保障下游用水安全;另一方面,伴随湖区渔业生产方式的转变,虽然湖区养殖的全面退出可在一定程度降低富营养化风险,但蓝藻尤在夏、秋季仍将长期占据东平湖浮游植物的主要优势,且养殖清退后湖区鲢鳙鱼总量的降低可能会引起浮游生物量的升高. 由此可见,湖区渔业生产方式的改变、南水北调东线工程的大量调水、流域水体营养物质的汇入及全球气候的长期性变化,都会直接或间接影响东平湖浮游植物群落,而其种群组成、群落特征及其分布等响应变化也有待长期的跟踪分析.
4 结语
1)东平湖共有浮游植物191种属,优势种主要为蓝藻门的漂浮泽丝藻和色球藻,绿藻门的小球藻以及硅藻门的小环藻、舟形藻和针杆藻,密度和生物量分别为6.74×106cells/L和5.71 mg/L;21世纪以来蓝藻已逐步占据东平湖浮游植物的优势地位,调水工程通水以来浮游植物量稍有升高.
2)TLI、CODMn、NH3-N和WT为影响东平湖浮游植物生长的主要环境驱动因子.
3)南水北调东线工程可能通过营养物质带入影响东平湖水质并引起浮游植物量的升高,但未对其优势种更替造成剧烈影响;湖区养殖的退出及增殖放流的实施,虽降低了水体营养物质积累与富营养化风险,但仍存在浮游植物生物量特别是蓝藻生物量升高的风险.
