circ_0000515靶向miR-1258调控结肠癌细胞增殖和凋亡的机制研究
2022-01-12汪景坤樊丽伟付晓霞赵彦焕张东姣赵玉红
汪景坤,樊丽伟,李 洵,付晓霞,赵彦焕,张东姣,赵玉红,张 磊
结肠癌是世界上最高发的恶性肿瘤之一,尽管外科手术治疗取得一定进展,但其死亡率一直居高不下,对于晚期及转移性结肠癌,多学科的综合治疗是其重要手段,其中靶向治疗越来越受到关注[1-3]。研究[4]表明circRNA参与调控结肠癌的进展,可作为潜在的生物标志物,为结肠癌提供潜在的治疗靶点。circ_0000515位于chr14:20811305-20811534,又名circRPPH1,circ_0000515低表达与宫颈癌病人预后良好相关;circ_0000515充当miR-326海绵通过上调ELK1促进宫颈癌的进展[5]。circRPPH1在体内促进乳腺癌细胞的增殖、迁移、侵袭和血管生成以及肿瘤生长[6]。然而circ_0000515对结肠癌细胞增殖和凋亡的影响及机制尚不清楚。研究[7-8]报道上调的miR-1258可抑制结直肠癌细胞的增殖和迁移。miR-1258上调显著抑制骨肉瘤细胞增殖,并促进细胞周期停滞在G0/G1[9]。circ_0101432通过靶向miR-1258和miR-622并上调MAPK1表达来抑制肝癌细胞凋亡,促进细胞增殖,侵袭能力和肿瘤生长[10]。然而circ_0000515是否通过调控miR-1258影响结肠癌细胞增殖和凋亡尚不清楚。
1 材料与方法
1.1 组织材料 选取我院病理科存档且已确诊的结肠癌病人癌组织及癌旁组织标本41例,其中男24例,女17例,年龄33~75岁,平均(39.9±1.1)岁;所有病人均知情且同意。
1.2 细胞与主要试剂 结肠癌细胞株SW620购自美国ATCC;RPMI-1640培养基购自美国Gibco公司;Trizol试剂和荧光定量PCR试剂盒购自日本Takara公司;MTT试剂盒、Annexin V-FITC/PI凋亡检测试剂盒购自日本同仁研究所;蛋白提取试剂盒购自上海碧云天生物有限公司;双荧光素酶报告基因检测试剂盒购自上海沪震实业有限公司。
1.3 细胞处理与分组 结肠癌细胞株SW620用RPMI-1640培养基常规培养,将circ_0000515干扰表达载体及其阴性对照、miR-1258模拟物及其阴性对照转染至SW620细胞中,记为si-circ_0000515组、si-NC组、miR-1258组、miR-NC组;将circ_0000515干扰表达载体分别与miR-1258抑制剂及其阴性对照转染至SW620细胞中,记为si-circ_0000515+anti-miR-1258组、si-circ_0000515+anti-miR-NC组。
1.4 实时荧光定量PCR(RT-qPCR)检测circ_0000515和miR-1258的表达水平 提取结肠癌组织及细胞总RNA,按试剂盒使用说明进行RT-qPCR,PCR反应条件:95 ℃预变性3 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环;融解曲线:95 ℃ 15 s,60 ℃ 15 s,95 ℃ 15 s。相对表达量用2-△△Ct法计算。
1.5 MTT检测细胞增殖活性 细胞培养48 h,按试剂盒说明操作,用酶标仪于450 nm处检测吸光度(OD)值。
1.6 流式细胞术检测细胞凋亡 收集培养48 h细胞,按试剂盒说明书操作,上流式细胞仪检测。
1.7 蛋白质印迹(Western blotting)法检测蛋白表达 收集细胞,提取总蛋白,取50 μL样品进行SDS-PAGE,电转至PVDF,封闭后加入一抗,4 ℃过夜,加入二抗室温1 h,显影、定影,成像后检测蛋白条带灰度水平,以GAPDH为内参计算蛋白表达水平。
1.8 双荧光素酶报告实验 构建circ_0000515的野生型和突变型荧光素酶载体WT-circ_0000515和MUT-circ_0000515,将其分别与miR-NC和miR-1258共转染至SW620细胞中,按照说明书检测荧光素酶活性。
将circ_0000515干扰表达载体、过表达载体及其阴性对照转染至SW620细胞中,按1.4中方法检测miR-1258表达水平。
1.9 统计学方法 采用两独立样本t(或t′)检验、配对t检验、单因素方差分析和q检验。
2 结果
2.1 结肠癌组织中circ_0000515和miR-1258的表达 与癌旁组织比较,结肠癌组织中circ_0000515表达水平升高,miR-1258表达水平降低,差异均有统计学意义(P<0.01)(见表1)。

表1 circ_0000515和miR-1258在结肠癌组织中的表达
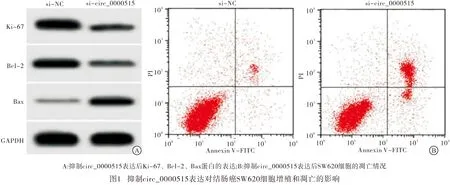
2.2 抑制circ_0000515表达对结肠癌SW620细胞增殖和凋亡的影响 与si-NC组比较,si-circ_0000515组circ_0000515表达水平降低,SW620细胞活性降低,SW620细胞的凋亡率升高,SW620细胞中Ki-67、Bcl-2表达水平降低,Bax表达水平升高,差异均有统计学意义(P<0.01)(见图1、表2)。

表2 抑制circ_0000515表达对结肠癌SW620细胞增殖和凋亡的影响
2.3 circ_0000515靶向调控miR-1258的表达(Circular RNA Interactome)Circular RNA Interactome预测显示circ_0000515的序列中含有与miR-1258互补的核苷酸序列(见图2);miR-1258与WT-circ_0000515共转染的SW620细胞荧光素酶活性降低,差异有统计学意义(P<0.01),而与MUT-circ_0000515共转染的SW620细胞荧光素酶活性差异无统计学意义(P>0.05)(见表3)。过表达circ_0000515后miR-1258表达水平降低,抑制circ_0000515表达后miR-1258表达水平升高,差异均有统计学意义(P<0.05)(见表4)。
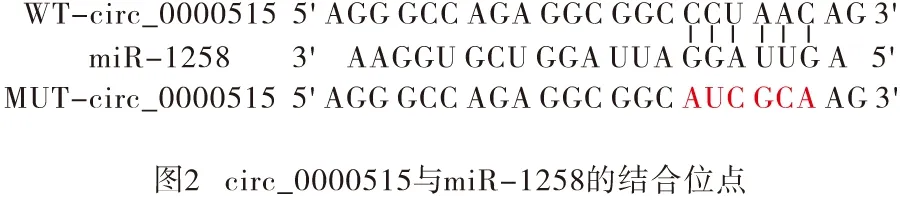

表3 双荧光素酶报告实验

表4 circ_0000515调控miR-1258的表达
2.4 miR-1258过表达对结肠癌SW620细胞增殖和凋亡的影响 与miR-NC组比较,miR-1258组miR-1258表达水平升高,SW620细胞活性降低,SW620细胞的凋亡率升高,SW620细胞中Ki-67、Bcl-2表达水平降低,Bax表达水平升高,差异均有统计学意义(P<0.01)(见图3、表5)。

表5 过表达miR-1258对结肠癌SW620细胞增殖和凋亡的影响
2.5 干扰miR-1258表达逆转了抑制circ_0000515表达对结肠癌SW620细胞增殖和凋亡的作用 与si-circ_0000515+anti-miR-NC组比较,si-circ_0000515+anti-miR-1258组miR-1258表达水平降低,SW620细胞活性升高,SW620细胞的凋亡率降低,SW620细胞中Ki-67、Bcl-2表达水平升高,Bax表达水平降低,差异均有统计学意义(P<0.01)(见图4、表6)。

表6 干扰miR-1258表达逆转了抑制circ_0000515表达对结肠癌SW620细胞增殖和凋亡的作用
3 讨论
分子靶向治疗作为新型癌症治疗方法,其在结肠癌的治疗中也具有重要意义,而寻找可靠的分子靶点是实现靶向药物治疗的关键[11-12]。研究[13]报道circ_0000515在肝癌组织和细胞系中上调,可用于预测肝癌的肿瘤分期,淋巴转移和预后;敲除circ_0000515可减弱肝癌Hep3B和MHCC88H细胞的增殖和迁移能力。circ_0000515通过调控miR-296-5p/CXCL10轴促进乳腺癌细胞的增殖和侵袭[14]。circ_0000515在肿瘤中可能起促癌作用。本实验结果显示,结肠癌组织中circ_0000515表达水平升高;抑制circ_0000515表达后,SW620细胞活性降低,SW620细胞的凋亡率升高,SW620细胞中Ki-67、Bcl-2表达水平降低,Bax表达水平升高;说明抑制circ_0000515表达可抑制结肠癌细胞增殖、促进细胞凋亡。

研究[15]报道miR-1258通过GRB2/Ras/Erk途径抑制非小细胞肺癌细胞增殖并诱导衰老和凋亡。miR-1258的过表达抑制了甲状腺乳头状癌KTC-1细胞的活力以及迁移和侵袭的能力[16]。本实验结果显示,结肠癌组织中miR-1258表达水平降低;过表达miR-1258抑制SW620细胞增殖,促进细胞凋亡。研究发现circ_0046599可以通过使miR-1258海绵化而增加RPN2表达来促进肝细胞癌的发展[17]。circ_002178通过调节miR-1258/KDM7A轴来促进乳腺癌细胞的生长和迁移[18]。说明circRNA可通过调控miR-1258影响肿瘤进展。本实验结果显示,circ_0000515靶向调控miR-1258;干扰miR-1258表达逆转了抑制circ_0000515表达对结肠癌SW620细胞增殖和凋亡的作用。
综上所述,抑制circ_0000515表达通过靶向上调miR-1258抑制结肠癌细胞增殖,促进凋亡。
