miR-503-5p对IL-1β诱导的血管内皮细胞增殖、迁移、凋亡和黏附的影响
2022-01-12刘华长杨彦立薛增明
刘华长,杨彦立,薛增明,任 珊
血管内皮细胞覆盖于血管内膜的表面,是血管壁与血液之间的天然屏障,对维持人体生命活动的运行具有重要作用。研究[1-3]显示,血管内皮细胞的激活、增殖、迁移、黏附和凋亡与冠心病、动脉粥样硬化、高血压、脓毒症等诸多心血管疾病的发生和发展密切相关。微小RNA(miRNA)是一类保守的内源性非编码RNA分子,近年研究表明,miRNA表达异常可调控内皮细胞增殖、迁移、黏附等功能,参与血管发育、新血管形成、血管炎症等的调节,与多种心血管疾病病理生理进程有关[4]。有研究[5]指出,在模拟微重力条件下,miR-503-5p可以通过抑制B细胞淋巴瘤2(Bcl-2)表达,在一定程度上诱导人肺微血管内皮细胞凋亡,提示miR-503-5p可能参与调节内皮细胞功能。血管内皮细胞在受到血液中各种危险因子刺激后产生过度的炎症反应导致细胞凋亡。因此,本研究以促炎因子白细胞介素1β(IL-1β)诱导血管内皮细胞,探讨miR-503-5p对IL-1β刺激下血管内皮细胞增殖、迁移、凋亡和黏附的影响和作用机制,以期为临床基于血管内皮细胞预防心血管疾病提供参考。
1 材料与方法
1.1 实验材料 人脐静脉内皮细胞(HUVECs)购自美国模式菌种保藏中心;胎牛血清、RPMI-1640培养基、青链霉素双抗购于美国Hyclone公司;IL-1β购于美国Sigma公司;miR-503-5p抑制物及其对照由上海吉玛制药公司提供;Opti-MEM培养基、脂质体Lipofectamine 2000、Trizol试剂购于美国Invitrogen公司;一步法miRNA反转录试剂盒购于哈尔滨新海基因检测有限公司;SYBR Premix Ex Taq购于大连TAKARA生物科技公司;噻唑蓝(MTT)试剂购于北京索莱宝生物科技公司;膜联蛋白-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)双染细胞凋亡检测试剂盒购于上海贝博生物;Transwell小室购于美国BD公司;兔源细胞间黏附分子1(ICAM-1)抗体、鼠源血管细胞黏附分子1(VCAM-1)抗体、鼠源β-actin抗体购于美国Proteintech公司;兔源半胱氨酸蛋白酶3(caspase-3)抗体和兔源裂解的半胱氨酸蛋白酶3(Cleaved caspase-3)抗体、山羊抗兔IgG、山羊抗鼠IgG购于上海艾博抗生物技术公司。
1.2 细胞培养 HUVECs采用含10%胎牛血清、1%青链霉素双抗的F12K培养基在含5% CO2、湿润的、37 ℃恒温细胞培养箱中培养。
1.3 实验分组及处理 将HUVECs分为4组:正常对照(NC)组为正常培养的HUVECs;IL-1β组参照CHEN等[6]实验方法用10 ng/mL的IL-1β诱导HUVECs 24 h;IL-1β+anti-miR-con组为转染anti-miR-con后进行IL-1β诱导;IL-1β+anti-miR-503-5p组为转染anti-miR-503-5p后进行IL-1β诱导。细胞转染步骤:将常温溶解好的anti-miR-503-5p加入到500 μL无血清Opti-MEM培养基中,同时将转染试剂Lipofectamine 2000加入到500 μL无血清Opti-MEM培养基中,轻轻混匀,室温静置孵育5 min。将二者混合后,室温静置孵育20 min。将混合好的脂质体加入到细胞培养皿中,培养6 h后,吸取旧的培养基,加入完全培养基后继续培养24 h,检测转染效果后继续进行后续实验。
1.4 RT-qPCR检测miR-503-5p表达 Trizol试剂提取各组细胞的miRNA,利用一步法miRNA反转录试剂盒合成cDNA,以cDNA为扩增模板,按照SYBR Premix Ex Taq使用说明进行qPCR反应。引物序列如下:miR-503-5p上游5′-CCT ATT TCC CAT GAT TCC TTC ATA-3′,下游5′-GTA ATA CGG TTA TCC ACG CG-3′;内参U6上游5′-ATT GGA ACG ATA CAG AGA AGA TT-3′,下游5′-GGA ACG CTT CAC GAA TTT G-3′。2-ΔΔCt法量化miR-503-5p的相对表达水平。
1.5 MTT法检测细胞活力 收集各组细胞,按照5×103个/孔的密度种植到96孔板,培养24、48、72 h时各取出一板细胞,每孔加入20 μL MTT溶液,继续培养4 h。终止培养,小心吸去孔内培养液。每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪测量各孔490 nm处吸光度值(OD)。
1.6 黏附实验检测细胞黏附能力 细胞按照上述分组处理后,进行黏附实验。用无血清细胞培养基洗涤单核细胞THP-1 2次,调整为1×106个/毫升的单细胞悬液。向1 mL THP-1细胞悬液中加入5 μL的Calcein AM染料,培养箱孵育30 min。用磷酸盐缓冲液(PBS)洗涤2次已标记的THP-1细胞,用细胞培养液重悬,取200 μL THP-1细胞加入含有内皮细胞的24孔板中,培养箱继续孵育30 min,PBS洗涤2次。荧光显微镜下拍照,计算黏附细胞数。
1.7 流式细胞术检测细胞凋亡 收集各组细胞,用预冷的PBS液轻柔吹打洗涤细胞2次,向细胞沉淀中加入适量的1×结合缓冲液,重悬细胞使细胞密度达到1×106个/毫升。吸取100 μL细胞悬液至一新管中,加入5 μL Annexin V-FITC和5 μL PI,轻轻混匀,室温避光孵育15 min。补加400 μL的1×结合缓冲液混匀后,上机检测细胞凋亡情况。
1.8 Transwell实验检测细胞迁移能力 将各组细胞重悬于无血清培养基中,取5×104个细胞接种于Transwell上室,24孔板下室用含20%胎牛血清的RPMI-1640培养基作为趋化剂。细胞培养箱中培养12 h后,取出小室,用无菌棉签擦去未过膜细胞,用4%多聚甲醛、结晶紫分别进行固定和染色。显微镜下观察细胞过膜情况,拍照,进行细胞计数。
1.9 Western blotting检测ICAM-1、VCAM-1、caspase-3和Cleaved caspase-3蛋白表达情况 RIPA裂解缓液提取各组细胞的总蛋白。取等量的蛋白样品进行SDS-PAGE电泳,并利用常规湿法转膜装置将分离的细胞蛋白转移至聚偏氟乙烯膜上。用5%脱脂牛奶封闭膜后,加入一抗溶液(ICAM-1、VCAM-1、β-actin为1∶500稀释,caspase-3和Cleaved caspase-3为1∶1 000稀释)4 ℃条件下孵育膜过夜。用洗膜缓冲液清洗膜3次后,加入二抗溶液室温孵育膜1 h。用化学发光试剂室温下孵育膜15 min,X线曝光显影。以β-actin为内参,凝胶成像系统分析目的蛋白相对表达水平。
1.10 统计学方法 采用方差分析和q检验。
2 结果
2.1 转染anti-miR-503-5p对IL-1β诱导内皮细胞增殖的影响 与NC组比较,IL-1β组HUVECs在24~72 h细胞活力显著降低,细胞中miR-503-5p表达显著升高;与IL-1β+anti-miR-con组比较,IL-1β+anti-miR-503-5p组HUVECs在24~72 h细胞活力显著升高,细胞中miR-503-5p表达显著降低(P<0.01)。在同一处理组,培养24 、48、72 h细胞活力逐渐升高(P<0.01)(见表1)。
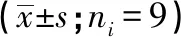
表1 转染anti-miR-503-5p对IL-1β诱导内皮细胞增殖的影响
2.2 转染anti-miR-503-5p对IL-1β诱导内皮细胞黏附的影响 与NC组比较,IL-1β组HUVECs在24~72 h时细胞黏附数显著增加(P<0.01);与IL-1β+anti-miR-con组比较,IL-1β+anti-miR-503-5p组HUVECs在24~72 h时细胞黏附数显著减少(P<0.01)。同一处理组,培养24 、48、72 h内皮细胞黏附数量逐渐增加(P<0.01)(见表2)。
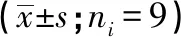
表2 转染anti-miR-503-5p对IL-1β诱导内皮细胞黏附的影响
2.3 转染anti-miR-503-5p对IL-1β诱导内皮细胞凋亡的影响 与NC组比较,IL-1β组HUVECs凋亡率、Cleaved caspase-3蛋白表达增加(P<0.01);与IL-1β+anti-miR-con组比较,IL-1β+anti-miR-503-5p组HUVECs凋亡率、Cleaved caspase-3蛋白表达显著降低(P<0.01)(见图1~2、表3)。
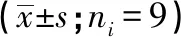
表3 转染anti-miR-503-5p对IL-1β诱导内皮细胞凋亡、caspase-3和Cleavedcaspase-3蛋白表达的影响
2.4 anti-miR-503-5p对IL-1β诱导内皮细胞迁移的影响 与NC组比较,IL-1β组HUVECs迁移细胞数显著降低(P<0.01);与IL-1β+anti-miR-con组比较,IL-1β+anti-miR-503-5p组HUVECs迁移细胞数显著升高(P<0.01)(见表4)。
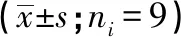
表4 转染anti-miR-503-5p对IL-1β诱导内皮细胞迁移的影响
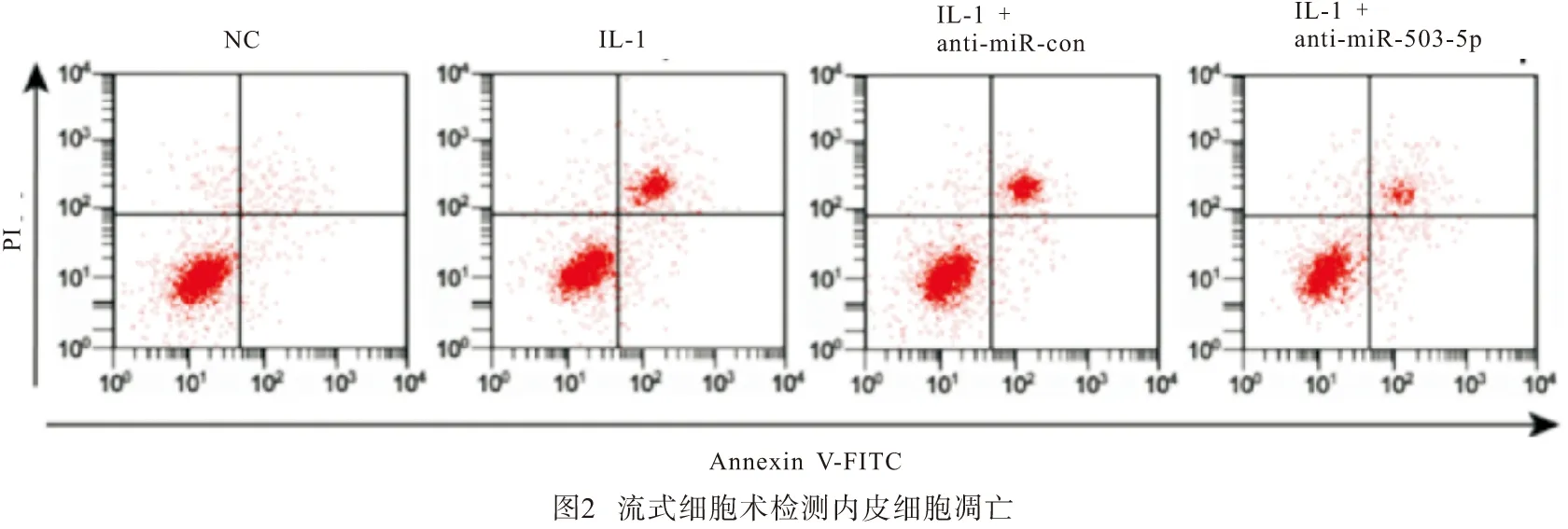
2.5 转染anti-miR-503-5p对IL-1β诱导内皮细胞ICAM-1、VCAM-1蛋白表达的影响 与NC组比较,IL-1β组HUVECs中ICAM-1和VCAM-1蛋白表达显著升高(P<0.01);与IL-1β+anti-miR-con组比较,IL-1β+anti-miR-503-5p组HUVECs中ICAM-1和VCAM-1蛋白表达显著降低(P<0.01)(见图3、表5)。
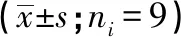
表5 转染anti-miR-503-5p对IL-1β诱导内皮细胞ICAM-1、VCAM-1的影响
3 讨论
多项研究[7-8]表明,miRNA在内皮细胞功能调控中发挥重要作用。研究[9-11]显示,一氧化氮(NO)是血管舒张和血流调控的重要因子,miR-182、miR-155通过调节NO的释放,参与调控血管内皮细胞的黏附,通过改变miRNA表达可改善内皮细胞功能,预防高血压病人的血管炎症和血管舒张功能受损。低氧诱导的内皮微颗粒通过携带miR-19b进入内皮细胞抑制其靶基因转化生长因子2(TGFβ2)表达,抑制内皮细胞迁移以及血管形成,对早期动脉粥样硬化进展具有抑制作用[12]。miR-381可促进氧化低密度脂蛋白(OX-LDL)诱导的血管内皮细胞增殖,减少细胞凋亡,抑制炎症反应,保护内皮细胞免受炎症损伤[13]。miR-503-5p是近年发现的miRNA,目前对miR-503-5p的研究主要集中在肿瘤方面。研究显示,卵巢癌[14]、肝癌[15]等恶性肿瘤中miR-503-5p表达下调,上调其表达可抑制其增殖、迁移能力,促进细胞凋亡,遏制肿瘤进展。本研究探讨miR-503-5p在IL-1β诱导的血管内皮细胞增殖、迁移、凋亡和黏附的作用发现,IL-1β诱导后血管内皮细胞miR-503-5p的表达显著增加,转染miR-503-5p抑制物下调miR-503-5p表达可提高血管内皮细胞增殖活力和迁移能力。以上结果说明,抑制miR-503-5p表达对血管内皮细胞增殖、迁移具有促进作用。

caspases是一个高度保守的半胱氨酸蛋白酶家族,在细胞凋亡执行阶段起着重要作用。在细胞凋亡信号刺激下caspase-9、Caspases-8等凋亡启动因子活化,通过一系列途径促进效应因子caspase-3活化,剪切细胞凋亡过程中许多关键酶,促进细胞凋亡[16]。因此,caspase-3的激活是细胞凋亡的一个重要指标。本研究显示,IL-1β诱导后血管内皮细胞caspase-3的激活产物cleaved caspase-3表达量、细胞凋亡率显著升高,抑制miR-503-5p表达可降低cleaved caspase-3表达水平,减轻IL-1β诱导的细胞凋亡。静息状态下,内皮细胞不表达或仅表达低水平的黏附分子,对白细胞募集具有抵抗作用。在各种刺激作用下,内皮细胞活化并表达多种黏附分子如VCAM-1、ICAM-1,这些黏附分子可募集白细胞,调节白细胞在血管内皮细胞上的黏附,进而导致早期心血管疾病的发生和发展[17-18]。本研究显示,IL-1β诱导后细胞黏附分子VCAM-1和ICAM-1表达、增加,而抑制miR-503-5p表达可降低VCAM-1和ICAM-1水平,减轻IL-1β诱导的细胞黏附。以上研究说明,抑制miR-503-5p表达可保护IL-1β诱导的血管内皮细胞炎性损伤和凋亡。
综上所述,本研究发现抑制miR-503-5p表达可促进血管内皮细胞增殖和迁移,保护其免受IL-1β诱导的炎性损伤和凋亡。这些发现有助于进一步了解血管内皮细胞损伤机制,并为临床开发基于血管内皮细胞的心血管疾病防治策略提供新的视角。
