不同郁闭度和海拔高度对海南风吹楠叶片及生长指标的影响
2022-01-11吴海霞杜尚嘉陈国德
王 鑫,吴海霞,符 溶,杜尚嘉,陈国德
(1.海南大学 热带作物学院,海口,570228;2.海南省林业科学研究院,海口,571100)
海南风吹楠(Horsfieldia hainanensisMerr.)属肉豆蔻科(Myristicaceae),风吹楠属(Horsfieldia),俗称假玉果、海南荷斯菲木、海南霍而飞、水枇杷、咪桉,为常绿乔木,树高可达15 m,在我国主要分布于云南、广西和海南等地,平均海拔150~1 012 m 的山谷、峰丛或丘陵荫湿的密林中[1-6]。它对研究热带雨林区系构成、地理分布和生态特征具有重要价值,是湿润热带雨林的标识性植物之一[7-8]。由于其分布区域狭小,雨林过度毁坏,数量极少,加之人为破坏和盗砍,天然更新极差等原因,濒临灭绝,于1999 年被列为国家Ⅱ级重点保护野生植物[4-6]。海南风吹楠的应用比较广泛,有绿化、材料、添加剂和医用等价值[4]。我国对海南风吹楠的研究主要集中在林业的播种育苗技术[9]和施肥管理[10]、生物学的种群特征[4]和化学成分分析[2-3]等方面,而对于海南风吹楠的自然生境回归种植尚未见报道。对珍稀濒危植物的保护主要有就地保护、迁地保护和野外回归等方式[11]。回归自然是野生植物种群重建的重要途径,其保护效果超出了单纯的就地保护和单一的物种保护,能更有效地对珍稀濒危野生植物进行拯救和保护[11]。从世界范围看,植物回归的研究与实践主要发生在植物园,这是因为植物园可为植物回归提供全方位的知识、植物材料、技术支撑与人力资源。全世界珍稀濒危植物的回归研究主要集中在影响回归植株定居的因素、回归的遗传多样性、全球生境变化对回归的影响和成功回归的标准等4 方面[12]。研究发现,繁殖体类型、材料来源、种源是直接野外收集还是贮藏、种源的数量及处理、不同种群与地点的适合度、回归地点、生境观测数据、生境的处理、种植时间等都对回归植物的成功定居有影响[13]。回归时会因居群的时空隔离而导致高的遗传分化和减少遗传多样性丧失风险,但增强型回归会导致亚种群间遗传同质化并降低遗传多样性[14-15]。在全球生境变化情况下,回归可增加1 个物种的分布和多度,改进基因流,加强复合种群动态并降低种群灭绝的风险[16],但是,回归种群也面临着外来种入侵、生境破碎化、气候变化等影响。为了减少这些影响,拟回归物种的历史分布区不再是回归时的唯一考虑地点,可利用生境分布模型为拟回归的物种找到合适的地点开展异地回归。这类模型会考虑回归过程中的生态相似性、源种群的遗传性以及生境质量的影响3 个重要因素[17]。关于成功回归的标准虽然还未形成共识,但一般会分为短期和长期成功。短期成功是指回归个体的成活、种群的建立和扩散,而长期成功是指回归种群能自我维持并在生态系统中发挥功能作用。最成功的回归包括产生二代个体,回归种群融入种群动态、种群遗传、个体行为、生态系统功能等生态系统过程[18]。因此,本研究通过不同海拔和郁闭度回归种植风吹楠,观测其生长指标、叶性和叶型的变化,旨在探究海南风吹楠自然回归种植的适应情况,为促进林业的可持续发展提供依据。
1 材料与方法
1.1 试验地概况试验点位于海南省五指山区域,(109°19′~109°44′E、18°38′~19°02′N),平均海拔328.5 m,气候温和,热带山区气候,冬暖夏凉。年平均气温22.4 ℃左右,1 月份平均气温17.0 ℃,7 月份平均气温26.0 ℃,极端最高气温35.9 ℃。年平均降雨量为1 690.0 mm,极端最大年降雨量为2 810.4 mm,极端最少年降雨量为1 055.5 mm,年平均相对湿度为84%,年平均日照时数约2 000 h[19]。
1.2 试验材料供试的海南风吹楠(Horsfieldia hainanensisMerr.)幼苗为生长健壮、长势一致的3 年生实生苗。
1.3 试验设计试验于2019 年4 月在海南五指山阿陀岭地势较平缓的地区进行,立地环境见表1。根据现有环境条件设置4 个处理组:0~0.2 郁闭度处理组;0.3~0.5 郁闭度处理组;0.6~0.8 郁闭度处理组;>0.8 郁闭度处理组。每处理组3 次重复,每个重复10 株,并挂牌标记。同时,将3 年生海南风吹楠回归种植在五指山市海拔分别为300、600、900 m 的地区,开展不同海拔海南风吹楠回归种植试验,每个处理为1 个种植小区,每个小区3 次重复,每个重复10 株幼苗。

表1 试验地立地环境条件Tab.1 Site environmental conditions in the land under trial
1.4 生长观测2019 年5 月,开始在每个重复中固定选取3 株,每2 个月采用卷尺和游标卡尺测定植株的株高(Tree Height,H)和地径(Diameter,D)。
1.5 叶片形态和性状测定试验结束后,于2020 年11 月每个重复选取3 株,采用手持式叶面积仪(YMJ-B,浙江托普云农科技服份有限公司)测定海南风吹楠的叶长(Leaf long,LL)、叶宽(Leaf width,LW)、叶面积(Leaf area,LA)、长宽比(Aspect ratio,LB)。
同时,叶片含水量(Leaf water content,CLWC)采用烘干法测定,从每株幼苗上剪取功能叶片1 片,每个重复取3 株,先称量叶片鲜质量(Fresh weight,FW),置于烘箱中100 ℃杀青1 h,再把温度调到85 ℃,直至恒重,称量叶片干质量(Dry weight,DW),并计算含水量、比叶面积(Specific leaf area,SLAM)和比叶重(Specific leaf weight,mLMA)。
1.6 光合色素测定方法光合色素含量的测定参考GU 等[20]和吴艳等[21]的方法,采用φ=95%乙醇法测定。从每株幼苗上剪取1 片成熟的功能叶片,每个重复取3 株,用分析天平称取0.200 g(FW),剪碎并浸没于φ=95%乙醇,常温暗处理72 h 后,直至叶片绿色退去,用紫外可见分光光度计(UV-2400,上海舜宇恒平科学仪器有限公司)在3 个波段测量吸光值(A),分别为470、649、665 nm。叶片光合色素含量的计算公式如下:
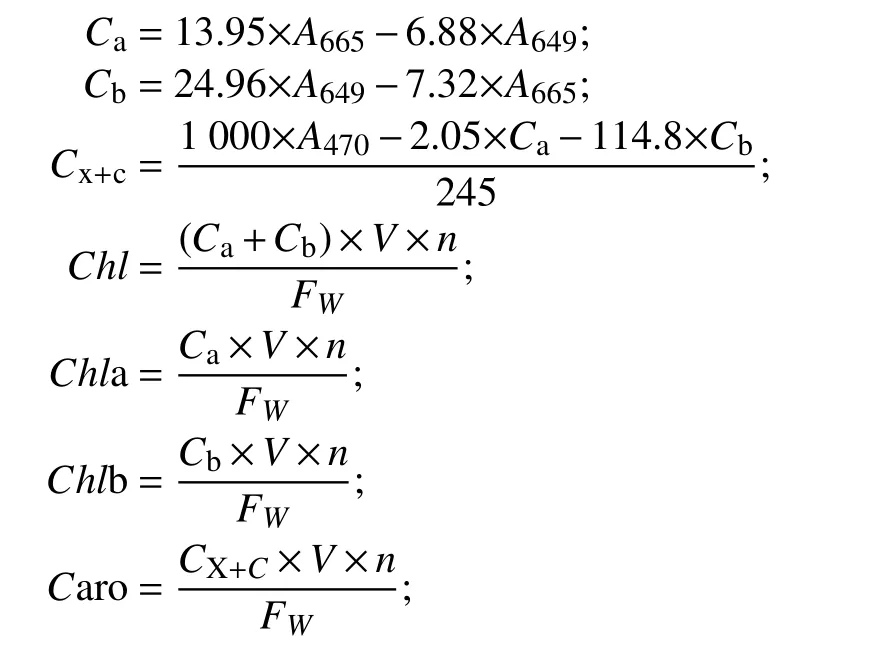
式中:Ca为叶绿素a 浓度(mg·L-1);Cb为叶绿素b 浓度(mg·L-1);Cx+c为类胡萝卜素浓度(mg·L-1);Chl为总叶绿素含量(mg·g-1);Chla 为叶绿素a 含量(mg·g-1);Chlb 为叶绿素b 含量(mg·g-1);Caro 为类胡萝卜素含量(mg·g-1);V为提取液体积(mL);n为稀释倍数;FW为叶片取样鲜质量(g)。
1.7 数据处理与分析采用Excel 2016 记录数据,采用IBM SPSS 26.0 软件进行方差数据分析和邓肯显著性检验,用OriginPro 2021 软件作图。所有试验数据均采用均值±标准差展示。
2 结果与分析
2.1 不同郁闭度对回归种植的海南风吹楠的影响
2.1.1 不同郁闭度对回归种植的海南风吹楠株高的影响不同郁闭度对回归种植的3 年生海南风吹楠株高的影响如图1 所示,各处理组均表现出株高增加的趋势,各处理组之间在2019 年5 月海南风吹楠株高无显著性差异。在2019 年5 月份后,均表现出>0.8 郁闭度处理组株高最小值,在2019 年7 月、9 月、11 月、翌年1 月、3 月、5 月分别为25.003、26.513、26.233、27.433、26.933、32.933 cm,其他处理组株高分别比2019 年7 月份多24.528%、21.859%、28.550%,2019 年9 月,其他处理组分别是>0.8 郁闭度处理组的1.427、1.461、1.433 倍,2019 年11 月,其他处理组分别是>0.8 郁闭度处理组株高的1.517、1.480、1.505 倍,翌年1 月,其他处理组分别是>0.8 郁闭度处理组的1.578、1.547、1.527 倍,翌年3 月,其他处理组分别是>0.8 郁闭度处理组的1.522、1.527、1.470 倍,翌年5 月,其他处理组分别是>0.8 郁闭度处理组的1.552、1.556、1.521 倍,在9 月、11 月、翌年1 月均表现出极显著小于其他处理组,7 月、翌年3 月和5 月,与其他处理组表现出显著性差异。说明较大(>0.8)郁闭度回归种植下对3 年生海南风吹楠的株高增加不利。

图1 不同郁闭度对回归种植的海南风吹楠株高的影响不同大写字母表示0.01 水平下的极显著性差异;不同小写字母表示0.05 水平下的显著性差异。下同。Fig.1 Effects of different canopy densities on the plant height of H.hainanensis Merr.reintroducedDifferent capital letters indicate highly significant difference at the 0.01 level;different lowercase letters indicate significant difference at the 0.05 level.Similarly hereinafter.
2.1.2 不同郁闭度对回归种植的海南风吹楠地径的影响从图2 可知,各处理组地径在一年中均呈现增长趋势,在2019 年5、7 月,各处理组之间无显著性差异。2019 年9 月,>0.8 郁闭度处理组的地径达到最小值,为7.349 mm,0~0.2、0.3~0.5、0.6~0.8 郁闭度处理组地径分别是>0.8 郁闭度处理组的1.145、1.099、1.126 倍,与>0.8 郁闭度处理组相比较,表现出差异显著性。2019 年11 月份>0.8 郁闭度处理组的地径达到最小值,为7.735 mm,0.6~0.8 郁闭度处理组地径达到最大值(9.360 mm),是>0.8 郁闭度处理组的1.210 倍,并且两者之间表现出差异显著性。翌年1 月,>0.8 郁闭度处理组的地径是最小值(8.233 mm),0~0.2、0.3~0.5、0.6~0.8 郁闭度处理组地径分别是>0.8 郁闭度处理组的1.259、1.278、1.267 倍,并都与>0.8 郁闭度处理组表现出差异显著性,翌年3 月,0~0.2 郁闭度处理组达到最大值,为12.263 mm,是>0.8 郁闭度处理组的1.247 倍,两者之间表现出差异显著性。翌年5 月,0~0.2、0.3~0.5、0.6~0.8 郁闭度处理组地径达到最大值,分别为13.159、12.851、12.550 mm,是>0.8 郁闭度处理组的1.357、1.325、1.294 倍,存在差异显著性,说明较高(>0.8)郁闭度回归种植不利于3 年生海南风吹楠地径的增加。

图2 不同郁闭度对回归种植的海南风吹楠地径的影响Fig.2 The influence of different canopy closures on the ground diameter of H.hainanensis Merr.reintroduced
2.1.3 不同郁闭度对回归种植的海南风吹楠叶片的影响从表2 可知,可知,不同林分郁闭度对3 年生海南风吹楠叶片的LS、LW、CLWC、SLAM、mLMA均无显著性影响,>0.8 郁闭度处理组的叶长最小,为265.877 cm,而0~0.8 郁闭度处理组的叶长表现出较大值,分别为369.453、367.110、381.067 cm,是>0.8 郁闭度处理组的1.390、1.381、1.433 倍。>0.8 郁闭度表现出显著小于其他处理组。长宽比的表现与叶长相似,>0.8 郁闭度处理组极显著小于0~0.8 郁闭度处理组,并且0~0.2、0.3~0.5、0.6~0.8 郁闭度处理组是>0.8 郁闭度处理组的1.184、1.227、1.227 倍。表明高(>0.8)郁闭度回归种植能够显著降低叶长,极显著减小长宽比。

表2 不同郁闭度对回归种植的海南风吹楠叶片性状和形状的影响Tab.2 Effects of different canopy closures on the leaf traits and shapes of H.hainanensis Merr.reintroduced
2.1.4 不同郁闭度对回归种植的海南风吹楠光合色素的影响从表3 可知,不同郁闭度回归种植对3 年生海南风吹楠Chl、Chla 含量、Chlb 含量以及Chla/b 无显著性差异,只表现在不同郁闭度回归种植对3 年生海南风吹楠Caro 含量影响不同,表现为0.3~0.5 郁闭度处理组的Caro 含量是0~0.2 郁闭度处理组的1.605 倍,相比较两者之间表现出差异显著性。表明不同郁闭度对回归种植的3 年生海南风吹楠的光合色素影响不大。
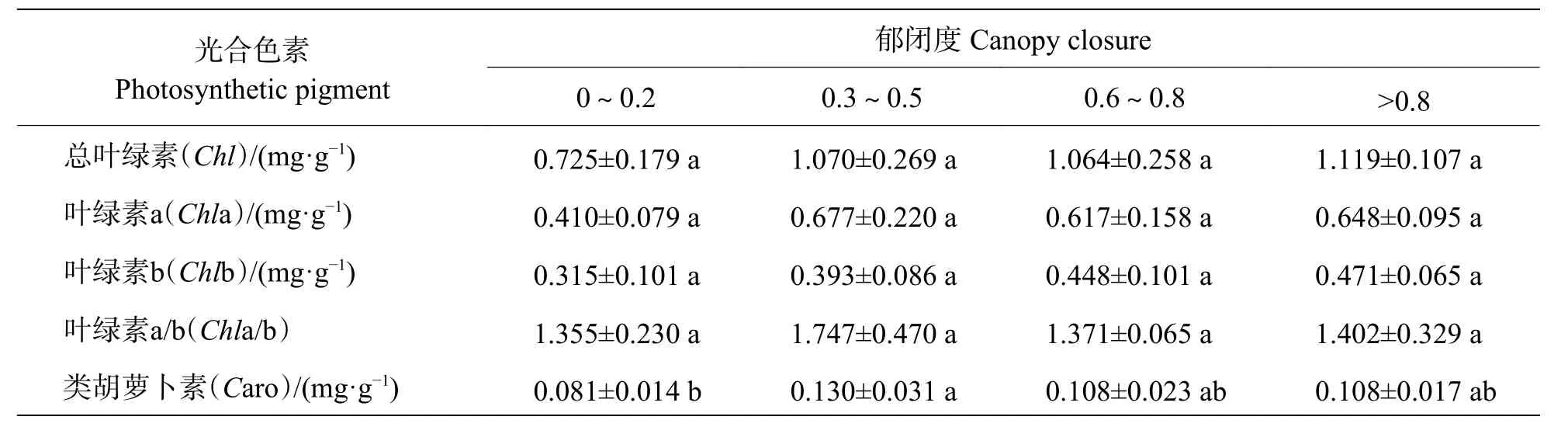
表3 不同郁闭度对回归种植的海南风吹楠光合色素的影响Tab.3 Effects of different canopy densities on photosynthetic pigments of H.hainanensis Merr reintroduced
2.1.5 不同郁闭度土壤养分分析从表4 可知,各郁闭度处理组的SOM、AP、AN、TK、TN、TP、Wg 无差异显著性,>0.8 郁闭度处理组的pH 值显著大于0~0.2 郁闭度,但均在6.5 以下,属于酸性土壤,AK 表现出0~0.2、>0.8 郁闭度处理组极显著大于其他处理组,说明各处理组之间的养分含量差异性不大。表明不同郁闭度处理组的土壤养分基本一致。

表4 不同郁闭度试验土壤养分分析Tab.4 Analysis of soil nutrients of the land under trial at different canopy closures
2.2 不同海拔对回归种植的海南风吹楠的影响
2.2.1 不同海拔对回归种植的海南风吹楠株高的影响在2019 年7 月,处理组表现出900 m 海拔显著小于其他处理组,在翌年5 月份,600 m 海拔处的海南风吹楠苗高显著大于900 m 处海南风吹楠苗高(图3)。说明经过长期适应后600 m 处更适宜海南风吹楠苗高的增加。

图3 不同海拔对回归种植的海南风吹楠株高的影响Fig.3 Effects of different altitudes on the plant height of H.hainanensis Merr.reintroduced
2.2.2 不同海拔对回归种植的海南风吹楠地径的影响从图4 可知,各处理组地径在2019 年5、7、9、11 月和翌年1、3、5 月均呈现增加的趋势。2019 年5 月,300 m 海拔的海南风吹楠地径显著大于其他2 个海拔,到2019 年9 月,只显著大于900 m 处海南风吹楠地径,而与600 m 处海南风吹楠无显著性差异,到翌年1 月,600 m 处理组的海南风吹楠地径显著大于900 m 处理组,但两者与300 m 处理组无显著性差异。说明不同海拔对回归种植的海南风吹楠的地径影响不明显。
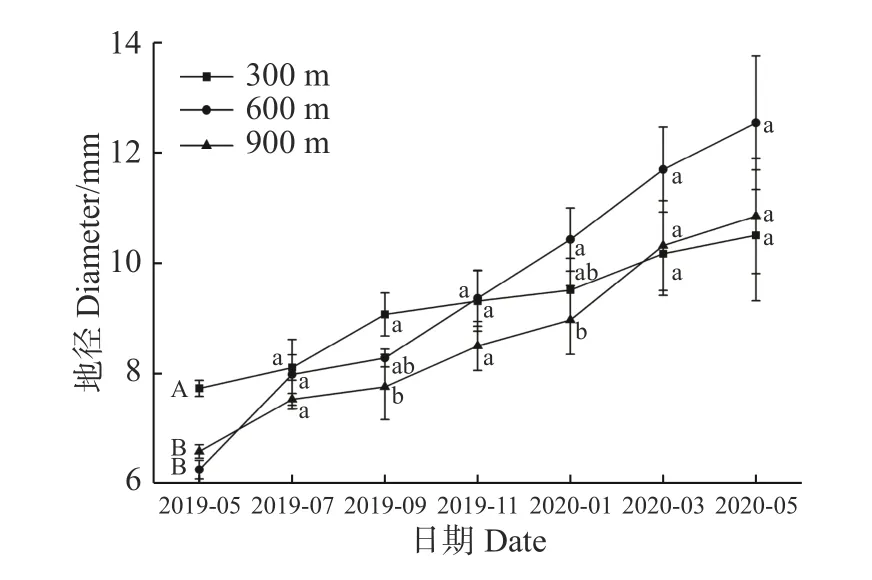
图4 不同海拔对回归种植的海南风吹楠地径的影响Fig.4 The Influence of different altitudes on the ground diameter of H.hainanensis Merr.planted
2.2.3 不同海拔对回归种植的海南风吹楠叶片的影响从表5 可知,600 m 海拔的海南风吹楠叶长和长宽比达到最大值,分别为381.067 mm 和2.360;900 m 和300 m 处理组的叶长显著小于600 m 处理组,而300 m 处理组的长宽比极显著小于600 m 处理组,900 m 处理组显著小于600 m 处理组。300、600、900 m处理组间的海南风吹楠叶面积、叶宽未表现出差异显著性。不同海拔高度对海南风吹楠叶片性状的影响不同,600 m 海拔处理组的叶片含水量、比叶面积达到最大值,分别为80.347%、153.537 cm2·g-1,并表现出极显著大于其他处理组,叶片含水量和比叶面积的变化均呈现出600 m>300 m>900 m,而900 m 处理组的比叶面积达最大值,为111.329 g·m-2,且极显著大于其他处理组,600 m 处理组显著小于300 m处理组,比叶重呈现出900 m>300 m>600 m 的规律。由此可知,600 m 海拔处理组有助于增加海南风吹楠叶片的含水量和比叶面积,900 m 海拔处理有助于增加海南风吹楠的比叶重。

表5 不同海拔对回归种植的海南风吹楠叶片形状和性状的影响Tab.5 Effects of different altitudes on the leaf shape and traits of H.hainanensis Merr.reintroduced
2.2.4 不同海拔对回归种植的海南风吹楠光合色素的影响从表6 可知,不同海拔高度对海南风吹楠的叶绿素、叶绿素 a 和类胡萝卜素差异不显著,600 m 处理组的海南风吹楠叶绿素 b 达到最大值(0.448 mg·g-1),而叶绿素 a/b 却达到最小值(1.371),600 m 处理组叶绿素 b 含量显著大于300 m 处理组,极显著大于900 m 处理组,900 m 与300 m 处理组之间无显著差异,600 m 处理组的叶绿素 a/b 值极显著小于900、300 m 处理组。由此可知,600 m 处理可以增加叶绿素 b 的含量,降低叶绿素 a/b 的值。

表6 不同海拔对回归种植的海南风吹楠叶片光合色素的影响Tab.6 Effects of different altitudes on photosynthetic pigments in the leaves of H.hainanensis Merr.reintroduced
2.2.5 不同海拔土壤养分差异性分析从表7 可知,各海拔的pH 值、AN、TK 含量无差异显著性。900 m 处理组的土壤SOM 含量达到最大值,为54.787 g·kg-1,是300 m 处理组的3.941 倍,并且两者之间达到极显著差异。AK 的含量表现为300 m 处理组达到最大值(87.130 mg·kg-1),是600 m 处理组(53.403 mg·kg-1)的1.632 倍,是900 m 处理组的1.277 倍,并表现为300 m 处理组极显著大于600 m 和900 m 处理组,900 m 处理组AK 含量是600 m 处理组的1.277 倍,两者之间表现出差异显著性,各处理组AK 含量大小表现为300 m>900 m>600 m。表明各海拔处理试验的土壤养分基本一致。

表7 不同海拔试验样地土壤养分分析Tab.7 Analysis of soil nutrients in the sampling plots at different altitudes
3 讨论
株高和地径能直接体现植物生长速度的状况,也是植物适应环境的直观表现[22]。本研究结果显示,较高(>0.8)郁闭度回归种植不利于海南风吹楠株高和地径的增加。因为光照作为重要的外部环境影响因素之一,对植物的生长发育起着决定性作用[23]。在高郁闭度下,植物受到的光照强度较小,植物光合作用速率降低,从而植物积累有机物的量变少,导致海南风吹楠相对于其他低郁闭度处理组的株高和地径变小。韩春丽[24]、何小燕[25]、何晓童[26]通过对红芸豆、油茶、脐橙的研究表明,弱光会使植物的叶片出现发育缓慢、叶色变淡、叶面积变大、比叶面积增大、比叶重显著减小等现象。本研究发现,高郁闭度(>0.8)回归种植能够显著降低叶长,与其研究结果相似,但也有研究表明,弱光对桃树叶面积、干湿重影响不大,叶型对光照强度的响应情况可能与树种,环境的温湿度也具有较强的相关性[27]。SINGH 等[28]的研究结果表明,弱光胁迫下植株功能叶片总叶绿素含量和类胡萝卜素含量均上升。叶绿素b 和类胡萝卜素含量的增加有利于吸收漫射光中的蓝紫光,使处于弱光中的植株充分对光的利用,而叶绿素b 的含量增加得更多,会使叶绿素a/b 的比值下降,叶绿体对2,6-二氯酚靛酚的还原能力增加,叶绿体光合磷酸化活性增高,从而影响植物光合作用的进行[29-30]。而本研究发现,不同郁闭度对回归种植的3 年生海南风吹楠的光合色素影响不大。虽然其中光是影响叶绿素形成的主要环境因子,而光照、水分、温度、氧气以及营养元素都是影响叶绿体形成环境因子,不能避免。从中可知,当海南风吹楠回归种植在0~0.8 郁闭度将会提高其生长速度,能使海南风吹楠快速适应环境。
海拔作为一个重要地形因子,环境中各种生态因子,如温度、湿度、降雨量太阳光以及紫外线辐射强度等,随着海拔的变化均会发生不同程度的变化。大量研究显示:随着海拔的升高,大多数植物叶面积逐渐减小[31],但也会出现增大或先增大后减小的现象[32],而叶绿素含量则随海拔的升高呈现下降趋势[33],但也存有变化不明显的结果[34]。本研究发现,600 m 海拔处理组能显著增加株高、叶片含水量、比叶面积、叶绿素b,对叶型指标无显著性差异,在300 m 海南风吹楠的株高较小可能是由于氧气充足,雨量较少等自然原因造成的。而900 m 处海南风吹楠的株高较低,但长势粗壮,原因可能是高海拔下低温,雨量充足,导致海南风吹楠长势粗壮抗逆能力比300 m 的高。可知600 m 海拔回归种植最适,能显著增加海南风吹楠的生长和叶型指标,使其快速适应环境。
速效钾含量是表征土壤钾素供应状况的重要指标之一。钾肥能促进植物进行光合作用,促进植物蛋白质的合成,使植物的枝叶更坚韧、厚实,还能提高植物抗病、抗寒、抗旱、抗倒伏、抗盐等抗逆性能,从而改善植物的质量,提高植物对氮元素的吸收[35]。在本研究中0~0.2 郁闭度和>0.8 郁闭度以及300 m 海拔的AK 值表现出较大值,但是>0.8 郁闭度、300 m 海拔的海南风吹楠长势并不理想。由此可见,AK 相对于海拔和郁闭度,并不是主要影响因子。此外,不同海拔的SOM 值不同,总体表现为900 m 海拔SOM 极显著大于300 m 海拔处理组,300 m 和900 m 海拔的海南风吹楠长势并不好。由此可见,SOM 相对于海拔因子不是主要影响因子。
综上可知,600 m 海拔、低郁闭度(0.3~0.8)的环境有益于3 年生海南风吹楠苗回归种植的生长。
