近红外荧光成像在食管癌淋巴结清扫术中的应用专家共识(2021版)
2022-01-11中国医院协会介入医学中心分会
中国医院协会介入医学中心分会
食管癌是常见的恶性肿瘤之一,在实体肿瘤中发病率排第6位,死亡率排第4位[1],我国每年新发病例数约占全球的50%以上,其中90%以上为食管鳞癌[2]。由于早期患者症状不明显,确诊时大部分患者已发展为中晚期[3]。根治性手术是早中期食管癌患者最有效的治疗方法,然而术后复发率仍高达42.5%~65.8%[4-5],其中淋巴结转移是肿瘤复发转移最危险的因素之一[6]。目前研究发现食管癌淋巴结转移存在以下特点:(1)淋巴结转移发生早:食管黏膜下层淋巴管网丰富且纵横交错,一旦肿瘤侵及食管黏膜下层,T1b期的食管癌患者淋巴结转移率可达20%左右[7];(2)存在跳跃性淋巴结转移:食管癌区域淋巴结范围包括颈部、胸部、上腹部,由于食管黏膜下毛细淋巴管存在广泛的网状交通,并沿食管长轴分布,因此,肿瘤细胞可沿着纵行淋巴管转移到远离原发灶的淋巴结,即跳跃性淋巴结转移,其发生率约为36.7%[8]。正常淋巴结是机体内重要的免疫器官,其主要功能是过滤淋巴、清除细菌和异物、产生淋巴细胞和抗体等功能,对机体具有保护作用,但是转移淋巴结是导致肿瘤远处转移的重要源头,严重影响患者的长期生存。因此,清扫转移淋巴结是根治性食管癌手术的重要环节之一。对于胸中下段及腹段食管癌患者,胸腹二野完全性淋巴结清扫是根治食管癌的基础;对于胸上段食管癌合并喉返神经旁淋巴结转移的患者,颈胸腹三野淋巴结清扫是推荐的标准手术操作。虽然扩大淋巴结清扫可减少食管癌患者术后复发的几率,使部分患者生存获益,但是同时也导致围手术期并发症发生率明显增加,如喉返神经麻痹、乳糜胸、肺炎等。因此,术中精准辨识淋巴结是否存在转移将有助于淋巴结的有效清扫,然而术中肉眼往往难以准确辨别正常和转移的淋巴结。因此,亟需针对上述难题,开发术中精准淋巴结清扫的新技术,以提高食管癌转移淋巴结的辨识度和清除率,同时又能保留正常的结构和组织,降低围手术期并发症发生率。
随着医疗技术的发展,现有的影像技术,包括电子计算机断层扫描(computed tomograhy,CT)、磁共振成像(magnetic resonance imaging,MRI)、单光子发射计算机断层扫描(single photon emission computed tomography,SPECT)、正电子发射断层扫描(positron emission tomography- CT,PET-CT)和超声内镜检测等,协助术前发现可疑转移淋巴结,并在诊断食管癌区域淋巴结转移的特异性及敏感性方面取得了显著进步,但因为难以在术中实时成像,故无法满足食管癌术中淋巴结精准清扫的要求。近十年来,近红外荧光成像已发展为一种新的术中成像模式,相对可见光成像,近红外荧光成像具有良好的组织穿透力、灵敏度、时间分辨率等优点[9-10],安全性和可行性更高,已被应用于多种恶性肿瘤术中导航,引导术中肿瘤切除和区域淋巴结清扫[11-14]。随着多个食管癌术中荧光成像临床研究的开展[15-18],结果已经显示出该技术在食管癌淋巴结精准辨识和清扫中的优势,但是也存在一些问题亟待解决。近期中国医院协会介入医学中心分会组织国内成熟开展食管癌术中近红外荧光成像的相关专家,在总结已发表的相关临床研究文献的基础上提出主要问题,采用Delphi调查法和专家讨论的方式,根据专家对现有证据的看法,从患者获益的角度权衡利弊,进行表决。我们将证据等级和推荐强度定义如下:
证据等级按照国际通行准则分为:1A级:基于高水平证据[随机对照试验(randomized controlled trial,RCT)结果或严谨的Meta分析],专家组有统一认识;1B级:基于高水平证据(RCT结果或严谨的Meta分析),专家组有小的争议;2A级:基于低水平证据,专家组有统一认识;2B级:基于低水平证据,专家组无统一认识,但争议不大;3级:专家组内存在较大争议。
推荐强度分为:(1)强:大多数患者会从推荐的治疗过程中受益,仅小部分不会,大多数外科医生就此达成共识;(2)弱:仅少数人从该治疗中获益,大多数患者不会获益,甚至可能对健康有害,大多数外科医生就此未达成共识;(3)无:如果所提及的治疗优缺点相等,或没有足够的证据支持该建议,归属为无推荐。
我们针对食管癌术中近红外荧光成像的荧光剂和成像系统使用、适应证及禁忌症、术前准备、手术方式、手术技术以及相关并发症等问题进行深入的讨论,并达成共识,现公布供同道们参考。
一、荧光剂和荧光成像系统
*吲哚菁绿是术中近红外荧光成像的首选荧光剂。
证据等级:2A级;推荐强度:弱;达成共识:78%同意。
*近红外一区荧光成像的组织穿透深度存在不足。
证据等级:2B级;推荐强度:弱;达成共识:83%同意。
术中近红外荧光成像依赖于荧光造影剂和荧光成像系统。吲哚菁绿(indocyanine green,ICG)是被美国食品药品监督管理局(Food and Drug Administration,FDA)、欧洲药品管理局(European Medicines Agency,EMA)以及我国国家药品监督管理局(National Medical Products Administration,NMPA)批准用于临床的近红外荧光显影剂(发射波长约830 nm)。虽然亚甲基蓝(methylene blue,MB)也是一种临床常用的荧光显影剂(发射波长约700 nm)[19-20],但是由于其注射部位染色深蓝,且容易弥散,术中不能分清组织解剖层次,现较少被采用。目前临床上主要选择ICG作为术中荧光造影剂,在使用说明允许的剂量内具有安全无毒、代谢稳定、价格低廉、应用方便、显影快速的特点,ICG发射荧光波长主要分布在近红外一区(发射波长650~950 nm),组织穿透深度约1 cm[21]。
荧光成像系统是一个重要的平台,近红外荧光手术导航设备示意和成像原理如图1所示。目前临床使用的近红外荧光腔镜系统基本能满足术中荧光成像需求,不同品牌的荧光腔镜系统在成像清晰度、视野范围、图像色彩、响应时间、荧光灵敏度等方面稍有差异,目前主要是近红外一区成像,其肿瘤背景比和组织穿透深度存在一定的不足。研究发现新型近红外二区(1 000~1 700 nm)成像,具有低光子吸收、最小散射和组织自体荧光弱、良好的信噪比和组织穿透性等优势[12],将成为未来的发展方向之一。随着近红外二区成像设备和荧光造影剂的开发,这些问题有望被逐渐解决。
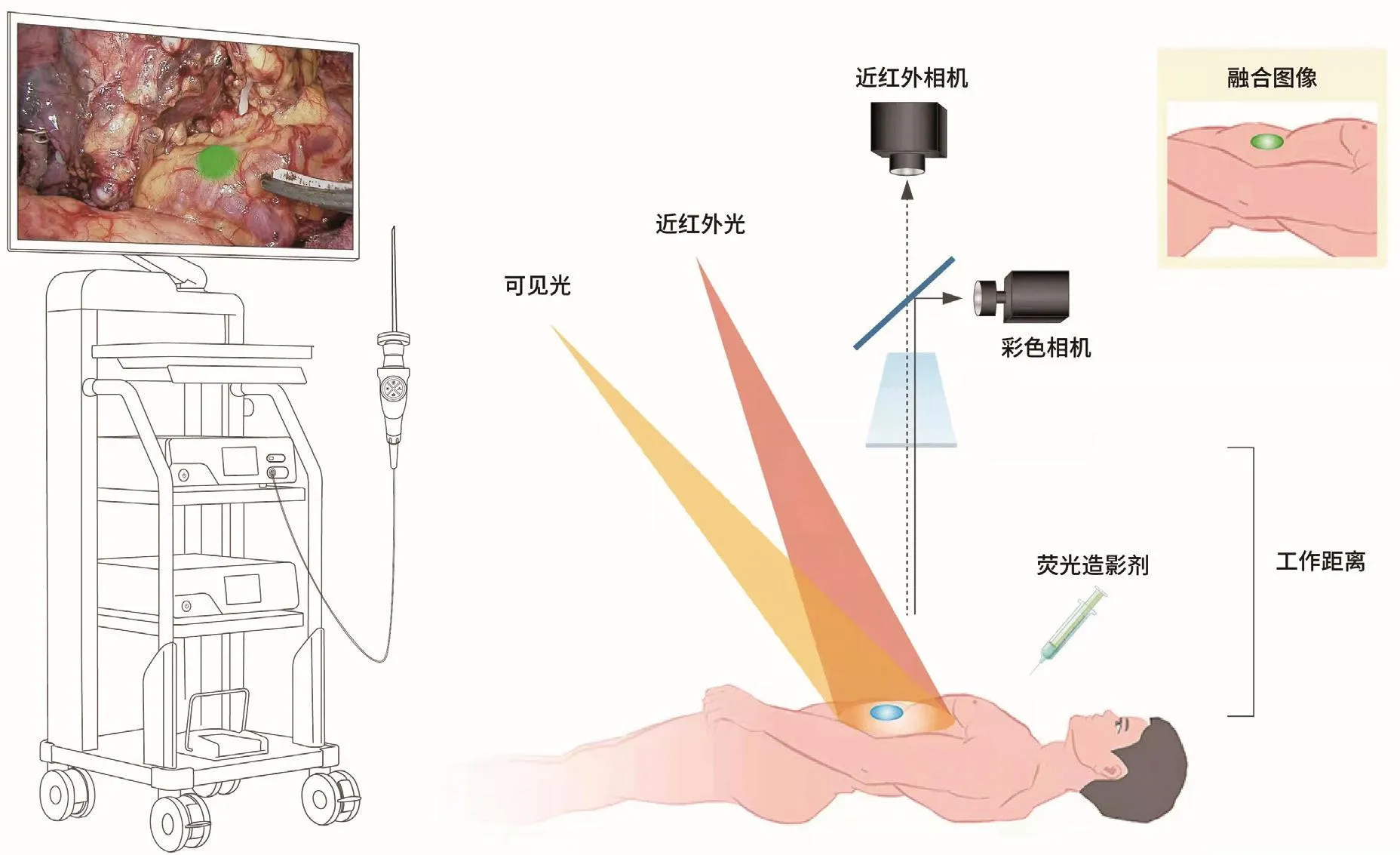
图1 近红外荧光手术导航设备示意图和成像原理示意
二、手术适应症和禁忌症
*近红外荧光成像技术可以常规用于食管癌手术中。
证据等级:2A级;推荐强度:弱;达成共识:78%同意。
近红外荧光成像技术帮助实现术中食管癌区域淋巴结的可视化,手术适应症同常规手术要求。适应症包括:(1)经细胞学或组织学确认为食管癌并且同意手术的患者;(2)UICC/AJCC分期(第8版)cT1b~2N0~1M0期患者;(3)cT3~4aN1~2M0期患者经新辅助放/化疗后评估肿瘤达到部分缓解可行手术切除者。
禁忌症包括:(1)对吲哚菁绿过敏的患者;(2)病变严重外侵(T4b,第8版UICC/AJCC分期),侵犯心脏、大血管、气管和邻近器官如肝、胰腺、脾等;多野和多个淋巴结转移(N3),全身其他器官转移(M1);(3)心肺肝脑肾重要脏器有严重功能不全者,如合并重度肺功能障碍,心力衰竭、半年以内的心肌梗死、严重肝硬化、严重肾功能不全;(4)一般状况和营养状况很差,合并恶病质者;(5)经手术和麻醉医生判断不能配合手术的患者。
三、手术准备及麻醉
*近红外荧光成像技术不需要额外增加术前检查项目。
证据等级:2B级;推荐强度:弱;达成共识:80%同意。
*近红外荧光成像技术对麻醉方式无特殊要求。
证据等级:2A级;推荐强度:弱;达成共识:80%同意。
(一)手术前准备
术前常规检查包括实验室检查和特殊检查。其中实验室检查有:血常规、尿常规、大便常规、肝肾功能、电解质分析、凝血功能、血液传染病筛查;特殊检查有:上消化道造影、胸部上腹部CT平扫+增强、头颅MRI、全身PET-CT或者骨ECT、根据情况选择心脏冠脉CTA必要时行冠脉造影、心电图、心脏彩超、肺通气和弥散功能、6分钟步行试验、电子胃镜(食管黏膜碘染色)或食管超声内镜检查及内镜下活检病理检查。
术前营养评估后,积极营养支持,并加强心肺功能锻炼。如近期有发热、咳嗽等呼吸道感染症状或严重的营养不良等均应治疗改善后手术[22]。
(二)麻醉方式
与常规食管癌手术的体位要求相同,均采用全身麻醉。根据手术方式决定气管插管方式,经胸食管癌手术,无论开胸或者腔镜下微创手术,一般采用双腔气管插管或者单腔气管插管联合二氧化碳气胸,实现单肺通气,满足手术操作的空间需求。经纵隔食管癌根治手术,一般采用平卧位,推荐进行单腔气管插管。在快速康复理念的推动下,近年来不插管胸部微创手术逐渐开展,该技术采用自主呼吸麻醉,进一步减少手术创伤[23]。目前尚无Tubeless食管癌微创手术结合近红外荧光导航的联合研究,值得探索。
四、ICG使用方法
*ICG在药物推荐剂量范围内均可实现近红外荧光成像。
证据等级:2B级;推荐强度:弱;达成共识:80%同意。
*ICG在食管肿瘤周围的粘膜下注射比静脉注射能更有效实现区域淋巴结成像。
证据等级:2A级;推荐强度:弱;达成共识:100%同意。
(一)药物配制及浓度
临床使用的ICG为固体粉末,水溶性良好,盐溶液容易促进ICG分子聚集[24],故推荐采用无菌注射用水配制,但ICG水溶液的稳定性有限[25],推荐现用现配,配制完成至注射完成之间不超过30 min,且避光保存,浓度在 0.5~1.25 mg/mL[15-18]。
(二)注射方法和部位
由于ICG进入血液循环后迅速与白蛋白结合,通过肝脏代谢,迅速被排入胆道,而且不再进行胆肠循环。在血液中ICG的半衰期为150~180 s,可以在15 min后重复注射ICG[26]。根据既往文献报道结合实践经验,本共识推荐术前0.5~1 h经电子胃十二指肠镜将ICG注入食管黏膜下层,便于吸收入淋巴系统,术程中均可检测淋巴结的荧光信号,不推荐采用静脉注射[15-19,27-28]。
根据食管肿瘤的位置和狭窄情况,来确定ICG注射位置。管腔明显狭窄且电子胃镜无法通过狭窄段者,可在食管肿瘤上缘2 cm内行食管黏膜下注射。如果电子胃镜能通过肿瘤狭窄段,推荐在肿瘤上下缘2 cm内食管黏膜下分别注射[17-18],这便于显影区域淋巴结的引流通路(图2)。
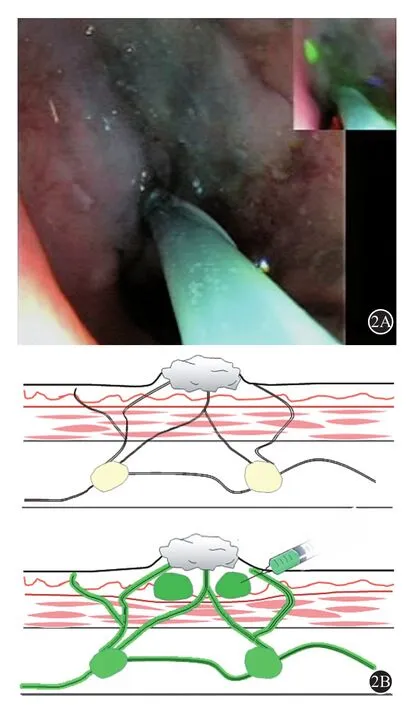
图2 胃镜监视下用内镜注射针在食管癌上下缘的黏膜下环周4点注射ICG
(三)注射剂量
麻醉完成后,患者取平卧位,内镜医生在成人电子胃镜监视引导下采用23G或25G的内镜注射针,将ICG注入食管黏膜下层,位置选择在食管肿瘤的上下缘2 cm内,环周4点,每点0.5 mL,共计2.5~5 mg[15-16,18,29]。也有研究显示:为了避免ICG注入食管肌层,先采用生理盐水0.5 mL注入食管黏膜下层建立一个囊泡,再将稀释的ICG注入囊泡内[17]。退镜之前用胃镜吸尽胃腔内的气体和液体,防止胃膨胀干扰手术操作。
五、手术方式
*术中近红外荧光淋巴结成像不受手术方式限制。
证据等级:2A级;推荐强度:弱;达成共识:100%同意。
近红外荧光成像在现有的食管癌手术方式中均能开展。手术方式可分为传统开胸和微创手术两类:经左胸入路食管癌根治术、经右胸+上腹入路食管癌根治术(Ivor-Lewis术式)或颈部+右胸+腹部三切口食管癌根治术(McKeown术式)、胸腹腔镜联合食管癌根治术、机器人辅助胸腹腔镜食管癌根治术、纵隔镜联合腹腔镜食管癌根治术、充气式纵隔镜联合腹腔镜食管癌根治术、机器人辅助食管癌根治术,这些手术方式均在临床上广泛开展,是安全可行的[15-18]。
六、手术操作
*近红外荧光成像实现肿瘤引流区域淋巴结的可视化。
证据等级:2A级;推荐强度:强;达成共识:80%同意。
*近红外荧光成像有助于辨识纵隔内重要解剖结构。
证据等级:2A级;推荐强度:强;达成共识:67%同意。
*近红外荧光成像可提高组织中淋巴结分拣数量。
证据等级:2B级;推荐强度:弱;达成共识:80%同意。
(一)区域淋巴结的可视化
ICG随着肿瘤淋巴液的流动,从肿瘤周围的毛细淋巴管进入了区域淋巴结内,在荧光激发模式下,可获取实时近红外荧光图像。监视器画面可设置为荧光图像和白光图像融合状态,全面观察被ICG染色的颈、胸部、腹部区域淋巴结和淋巴管分布情况,同时明确近红外荧光最强的位置即为肿瘤附近的注射点。荧光成像期间显示器画面可同时呈现3种视野:标准白光图像、单纯近红外荧光图像和融合图,根据需要选择任一种作为主要观察模式(图3)。对于术前进行了新辅助同期放化疗的患者,食管发生广泛纤维化,ICG在淋巴管吸收可能受影响,目前缺乏相关报道,值得探索。
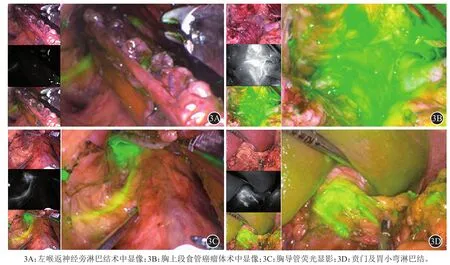
图3 3种视野下近红外荧光成像,实现区域内重要淋巴组织结构的可视化
(二)术中组织结构的辨识
在传统手术情况下,外科医生只能依靠视觉和触觉反馈来区分不同的组织结构,而术中荧光成像,有利于提高重要组织结构旁的淋巴结辨识度,也能更好地区分癌组织和正常组织,确定肿瘤组织边缘的准确性更高[10,18,26,30-31]。在食管癌的手术过程中涉及清扫胸导管和双侧喉返神经旁淋巴结,这些组织结构的损伤会导致乳糜胸和声音嘶哑等严重并发症[32]。术中近红外荧光淋巴成像将有利于辨认这些结构,降低损伤风险。所有切除的组织在离体后可再次进行近红外荧光检测,分离出组织块内隐藏的淋巴结,增加术后淋巴结送检数量。虽然ICG与肿瘤细胞的结合缺乏特异性,对转移淋巴结阳性预测率低,但能可视化显示肿瘤区域淋巴引流的路径,其阴性预测值高达94.38%~100%[17-19],表明ICG显示肿瘤淋巴引流区域有明显优势,方便术者判断淋巴结需要清扫的方向。
(三)肿瘤切除及淋巴结清扫
外科医生对区域淋巴结行en-block切除,包含站点内淋巴结、脂肪、结缔组织以及淋巴管等所有组织。对于T1/T2的食管癌患者,根治性淋巴结切除应该清扫不少于18个[32];对于T3/T4的患者,淋巴结清扫不能少于30个[33]。推荐在正常白光模式下,按照外科医生的个人操作习惯完成食管切除术和淋巴结清扫,期间可以根据手术需要随时在荧光或白光模式间切换,明确淋巴结组织的位置及范围,帮助术者确定手术范围。推荐用荧光模式进行全面评估术野,确保将带有荧光的淋巴结全部清除(图 4)。
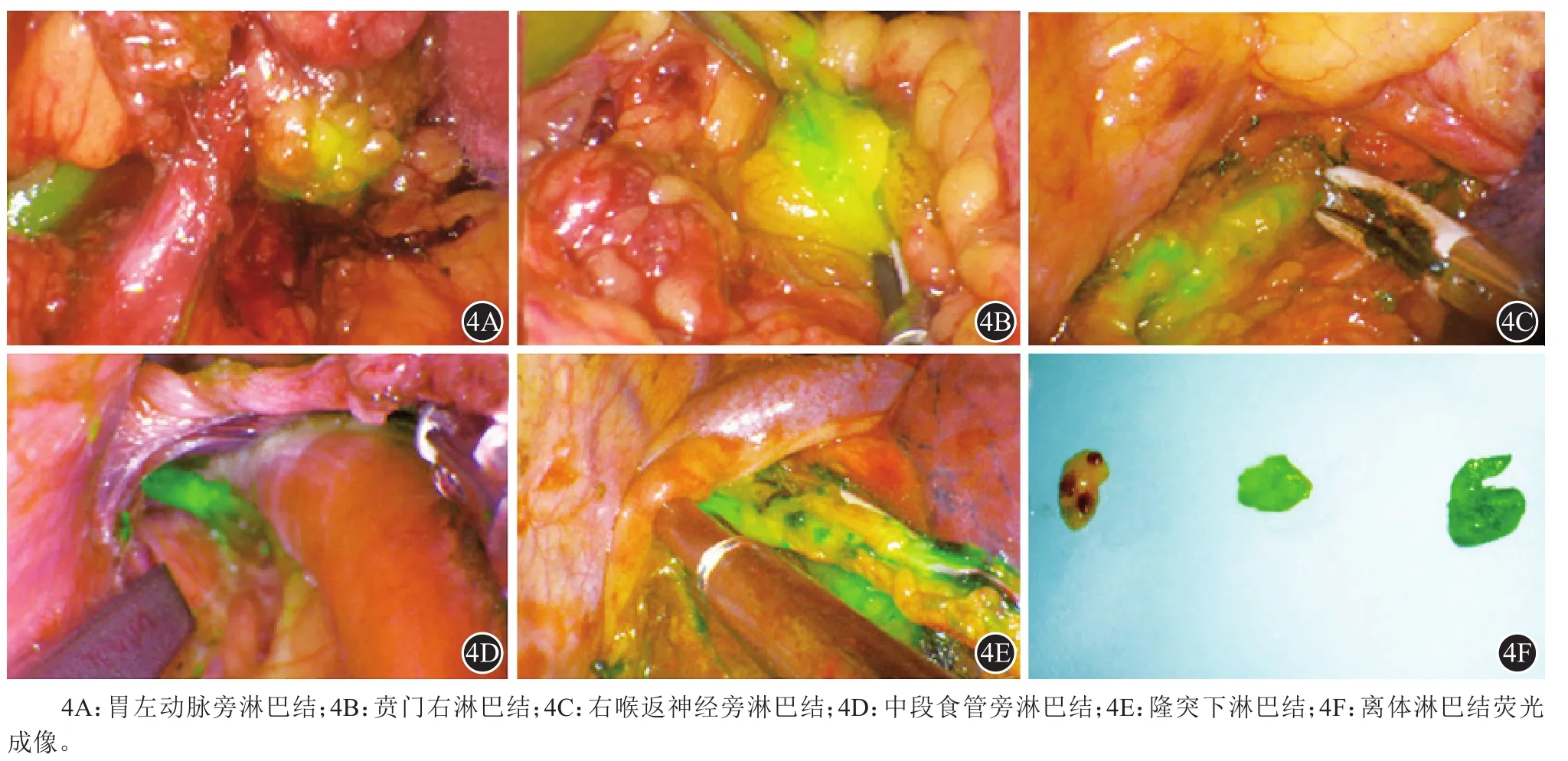
图4 ICG近红外荧光成像明确显示各站点淋巴结位置,引导定位切除及体外淋巴结分拣
七、术中不良事件
*术中ICG过敏反应发生率极低,可按药物过敏对症处理。
证据等级:低;推荐强度:强;达成共识:100%同意。
*与腔镜食管癌手术相比,近红外荧光成像可减少并发症的发生率。
证据等级:2B;推荐强度:强。达成一致意见:83%同意。
*术中静脉注射ICG,近红外荧光成像可以协助判断管状胃的血供状况。
证据等级:2A;推荐强度:强;达成共识:100%同意。
(一)ICG药物过敏及处理
仅有极少数报道ICG过敏导致休克,主要是由ICG中的碘引起[34-35]。本共识推荐用药前先于患者前臂掌侧皮内注射0.1 mL(2.5 mg/mL),10~15 min,观察有无红晕,确定无过敏反应后再使用。一般在≤0.5 mg/kg的范围内注射给药是非常安全的[26]。
根据患者不良反应危重程度,ICG的过敏反应可分为三度:轻度表现为恶心、呕吐、局部皮疹、打喷嚏和瘙痒,发生率在0.15%;中度表现为荨麻疹、低血压、晕厥、发热、局部组织坏死和神经麻痹,发生率在0.2%;重度表现为支气管痉挛、喉痉挛、循环性休克、心肌梗死、心脏骤停以及强直性阵挛发作等危及生命的情况,发生率为0.05%[34-35]。
处理措施:根据过敏反应的程度,进行严密观察处理,预防危及生命[36]。
轻度过敏反应:一般不需用药,严密观察半小时,症状多可自行缓解,少数症状持续时间较长,可用地塞米松5~10 mg静脉注射,或者非那根25 mg肌肉注射。
中重度过敏反应:(1)吸氧,保持呼吸道通畅;(2)抗过敏治疗,地塞米松5~10 mg静脉注射,或非那根25 mg肌肉注射;(3)低血压患者可给予肾上腺素0.25~0.5 mg皮下或肌肉注射;(4)合并心动过缓者,可用阿托品0.5~1 mg或者异丙肾上腺素0.25~0.5 mg静脉注射;(5)急性肺水肿伴休克者,甲强龙40 mg静脉注射,可重复。维持气道通畅,按过敏性休克治疗。
(二)术中出血
根据文献报道,近红外荧光成像组与对照组相比,术中出血量无统计学差异[37]。小出血往往可以通过能量器械[电凝钩、超声刀、血管闭合系统(Ligarsure)等]止血,对于较粗大的食管营养动脉可采用结扎或者钛夹夹闭处理再行离断。对于大出血,需术者保持镇定冷静,根据实际情况,判断出血位置和破口大小,先纱块压迫止血,通过加快补液、输血等措施,做好中转开胸准备,如果腔镜下无法处理,要果断选择中转开胸止血。
(三)误伤胃网膜右血管弓或结肠中动脉
食管癌术中重要步骤之一是用胃或者结肠替代切除的食管,完成消化道重建。大部分食管癌手术选择管状胃作为食管的替代物,是目前最符合生理情况的安排,胃网膜右血管弓是管状胃的唯一血供来源,如果在手术过程中被损伤将会导致术后管状胃坏死或者吻合口瘘[38]。一旦发生,必须果断寻找第二替代方案,切勿侥幸完成食管胃吻合。对于可疑血管弓损伤时可采用静脉注射ICG观察整个管胃的荧光分布情况,特别是胃的顶端部分,并利用荧光系统软件进行荧光强度定量分析,协助判断管状胃的血供状况[39-40],减少术后管状胃缺血坏死的可能。对于既往已行胃切除手术,需要采用结肠替代食管的患者,如果手术过程中结肠中动脉被损伤,其处理原则同上。如果缺少可以补救的替代物,建议食管近端旷置,远端空肠造瘘,待情况稳定后再行二期手术吻合。
(四)神经损伤
双侧喉返神经旁淋巴结是胸段食管癌清扫重点区域,由于神经行走于淋巴结清扫区域内,术中操作时容易损伤或误断,手术操作过程中应小心谨慎,找到左右喉返神经干并沿其走向逐渐游离出左右喉返神经,可借助荧光成像,分清结构,精细解剖。由于牵拉或者热传导引起的轴突损伤,术后经过神经营养支持和声带康复锻炼,多能逐渐康复或代偿[41]。对于误断的神经,可采用一期断裂缝合重建,但重建后的功能恢复情况,目前缺乏大样本随访数据支持,效果有待证实。
术中近红外荧光淋巴成像是一种安全且有应用前途的技术,在食管癌术中可视化肿瘤淋巴引流区域、指导清除有转移风险的淋巴结、识别肿瘤相关淋巴通路上的前哨淋巴结、缩短学习曲线等方面具有积极作用。但目前的临床研究显示ICG对转移淋巴结缺乏特异性,未来食管癌近红外淋巴成像的研究需要集中在提高特异性上。靶向性探针已经用于荧光内镜下切除食管腺癌的临床研究,证明可以显著提高病变检测率[42-43],而外科手术导航方面,已有学者开展切除食管鳞癌转移淋巴结的预临床研究,证明靶向性近红外探针可以识别微小转移灶[44]。在成像技术方面,组织穿透力更好的近红外二区荧光手术导航较一区荧光可提高肿瘤的检测率[45],随着食管鳞癌靶向性探针以及近红外二区荧光成像技术的成熟和转化,将进一步提高食管癌转移淋巴结切除的准确性。
共识制定人员(按姓氏拼音排序):
蔡开灿(南方医科大学南方医院)
曹庆东(中山大学附属第五医院)
陈嘉耀(中山大学附属第五医院)
陈龙奇(四川大学华西医院)
迟崇巍(中国科学院自动化研究所,中国科学院分子影像重点实验室)
何 伟(宁夏医科大学总医院)
何坤山(中国科学院自动化研究所,中国科学院分子影像重点实验室)
胡 坚(浙江大学附属第一医院)
胡 祎(中山大学肿瘤防治中心)
胡振东(南京大学医学院附属鼓楼医院)
胡振华(中国科学院自动化研究所,中国科学院分子影像重点实验室)
黄 杰(武汉大学人民医院)
姜 涛(空军第四军医大学唐都医院)
康明强(福建医科大学附属协和医院)
李 丹(中山大学附属第五医院)
李小兵(河南省安阳市肿瘤医院)
李志刚(上海市胸科医院)
李忠诚(青海大学附属医院)
连长红(长治医学院附属和平医院)
梁明柱(中山大学附属第五医院)
刘家宝(河北省石家庄市人民医院)
马建群(哈尔滨医科大学附属肿瘤医院)
马金山(新疆维吾尔自治区人民医院)
毛友生(中国医学科学院肿瘤医院)
单 鸿(中山大学附属第五医院)
唐 建(南昌大学第一附属医院)
田 辉(山东大学齐鲁医院)
田 捷(北航-首医大数据精准医疗高精尖创新中心,中国科学院自动化研究所,中国科学院分子影像重点实验室)
王 成(兰州大学第二医院)
王晓进(中山大学附属第五医院)
吴 楠(北京大学肿瘤医院)
吴相稳(中山大学附属第五医院)
熊 飞(湖北省肿瘤医院)
杨光煜(广西医科大学第二附属医院)
叶晓锋(宁夏医科大学总医院肿瘤医院)
游 宾(首都医科大学附属北京朝阳医院)
于修义(厦门大学附属第一医院)
喻本桐(南昌大学第一附属医院)
张 帆(中山大学附属第五医院)
张 康(山东省济宁市第一人民医院)
张 奕(福建医科大学附属漳州市医院)
张临友(哈尔滨医科大学附属第二医院)
赵志龙(大连大学附属中山医院)
