黄芩苷对子痫前期大鼠胎盘滋养细胞增殖侵袭的作用机制研究
2022-01-11王锋徐静高亚南崔利娜付秀虹
王锋 徐静 高亚南 崔利娜 付秀虹
漯河市中心医院 河南,漯河 462000
子痫前期是一种常见特发性妊娠期综合征,多发生于妊娠20周后,主要特征为初发高血压、蛋白尿[1]。子痫前期发病与子宫螺旋动脉重塑异常、胎盘滋养细胞增殖及侵袭等因素有关,可严重影响母婴健康,临床上需加强早期的诊断、治疗[2-3]。但目前尚无特效治疗方法,西医治疗多以对症处理为主,部分患者疗效欠佳,且西药长时间服用后不良反应较多。中医学的较多保胎处方中,中药黄岑发挥着重要作用,可安胎、止血、解毒等。黄岑苷为黄岑主要有效成分,具有抗炎、抗氧化、抗变态反应、抗癌等作用[4]。杨小颀等[5]研究发现,黄岑苷能够调节子宫母胎界面免疫状态,降低CD4+/CD8+细胞比值,减少流产发生。但目前关于黄岑苷对子痫前期胎盘滋养细胞增殖、侵袭的影响研究较少,作用机制尚不明确。本研究拟建立子痫前期大鼠模型,分离、培养大鼠原代滋养细胞,探讨黄岑苷对胎盘滋养细胞增殖、侵袭的影响,并分析其可能的作用机制。
1 材料和方法
1.1 材料
1.1.1 实验动物 健康清洁级SD大鼠36只,7周龄,体质量240~280 g,其中雌性24只,雄性12只,均购于河南省实验动物中心 [实验动物生产许可证号码:SCXK(豫)2017-0001]。所有大鼠均饲养于郑州大学药物研究院[实验动物使用许可证号码:SYXK(豫)2018-0004],在恒温恒湿环境内适应性喂养7 d,温度20~25℃,湿度50%~70%,自由进食、饮水。本研究经动物伦理委员会批准(批号:LHZXYY-190041),实验过程严格遵循减少(reduction)、替代(replacement)和优化(refinement)的“3R”原则。
1.1.2 药物、试剂和仪器 黄岑苷(药物纯度≥98.6%)购于武汉市俊泰生物科技有限公司(批号:110715),使用前以0.9%氯化钠溶液溶解,浓度为10.0 μg·mL-1;亚硝基左旋精氨酸甲酯、二氨基联苯胺 (3,3’-diaminobenzidine,DAB)显色剂均购于美国Sigma公司(批号:BCBF4375V、G7645);戊巴比妥钠购于德国默克公司(批号:P11011);磷酸缓冲盐溶液(phosphate buffer saline,PBS)购于武汉博士德生物工程有限公司(批号:AR1155);四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)检测试剂盒购于上海碧云天生物技术有限公司(批号:011918180508);杜尔伯克改良伊格尔培养基(Dulbecco'smodification of Eagle's medium,DMEM)/F12购于美国Hyclone公司(批号:SH30023.01B);免疫组化试剂盒购于武汉博士德生物公司 (批号:SA102100);兔抗大鼠细胞角蛋白-7(cytokeratin-7,CK-7) 一抗购于英国Novocastra公司(批号:1906247);异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的羊抗兔免疫球蛋白G(immunoglobulin G,IgG)抗体购于北京中山公司(批号:67905);实时荧光聚合酶链式反应(Real-time fluorescence quantitative polymerase chain reaction,Real-time qPCR)试剂盒购于湖北武汉富鑫远科技有限公司 (批号:180215); 兔抗大鼠微小RNA-30d(microRNA-30d,miR-30d)-抗、兔抗大鼠神经胶质细胞缺失同源物-1(glial cells missing homolog-1,GCM-1)一抗及山羊抗兔IgG二抗购于美国Santa Cruz公司(批号:180215、191023、25474)。
1.1.3 主要仪器 Transwell小室购于美国康宁公司;TGL-16G-A型高速冷冻离心机购于上海安亭仪器厂;SpectraMax M5多功能酶标仪为上海美谷分子仪器有限公司产品;DMi8-M型倒置相差显微镜为德国徕卡显微系统有限公司产品;FACSCalibur流式细胞仪购于美国Becton-Dickinson公司。
1.2 方法
1.2.1 动物处理及模型制备 每日18:00至次日8:00,按照2∶1比例安排雌雄鼠合笼,次日清晨对雌鼠进行阴栓和阴道涂片检查,若观察到精虫或阴栓,记为妊娠第1天。雌鼠自妊娠第13天起,给予10 mg·mL-1亚硝基左旋精氨酸甲酯皮下注射,剂量125 mg/(kg·d),1次/d,连续7 d[6]。 建模成功标准:建模后24 h,检测大鼠血压较实验前升高>20 mmHg(1 mmHg=0.133 kPa),尿蛋白(+)[7]。共20只雌鼠建模成功,成功率为83.33%。
1.2.2 原代滋养细胞分离、培养及传代 参考文献[8]的方法,从建模成功雌鼠中随机选择5只,妊娠第19~21天时以2%戊巴比妥钠50 mg·kg-1腹腔注射麻醉,无菌条件下剖宫取胎,分离胎盘组织,洗净表面血迹并剪碎,以含1%胶原酶Ⅰ和0.25%胰蛋白酶的Hank's液37℃下消化15 min。随后加入含20%胎牛血清的DMEM/F12培养基终止消化。1 800 r/min离心15 min,离心半径8 cm,弃去上清液后以PBS洗涤、重悬。配制浓度分别为30%、60%的Percoll分离液,依次加入15 mL离心管,细胞悬液沿管壁加入。2 000 r/min离心20 min,离心半径10 cm,取中间白膜层细胞,PBS洗涤2次后以含20%胎牛血清的DMEM/F12培养基重悬,调整细胞数量为1×104个·mL-1,接种于培养瓶,培养24 h,观察细胞贴壁情况。72~96 h后,待细胞成片生长,贴壁85%以上开始传代,此后每隔3 d传代1次,倒置显微镜下观察细胞形态。
1.2.3 滋养细胞纯度鉴定 采用免疫荧光法鉴定。收集细胞,吸净培养基,以Hank's液洗涤,4%多聚甲醛固定48 h,PBS洗涤后加入0.5% Triton X-100,室温下反应20 min,洗涤后加入3% H2O2,室温下反应20 min。PBS洗涤后加入血清封闭液,37℃反应20 min,甩干封闭液后加入兔抗大鼠CK-7一抗(稀释比例:1∶100),37 ℃孵育2 h。PBS洗涤后加入FITC标记的羊抗兔IgG(稀释比例:1∶1 500),孵育、洗涤后加入生物素化二抗工作液50 μL,室温孵育20 min。 PBS洗涤,加入链霉亲和素-生物素复合物(streptavidin-biotin complex,SABC)孵育20 min。PBS洗涤后分别加入50 μL DAB显色剂1和2,避光显色15 min,自来水冲洗后镜下观察阳性细胞数并计算阳性细胞百分率,以鉴定细胞纯度。
1.2.4 胎盘滋养细胞增殖活性检测 采用MTT法检测。选择生长良好的滋养细胞,调整细胞浓度为1.0×104个·mL-1,接种至96孔板培养24 h。 待细胞贴壁后,弃去培养基,分别加入不同浓度黄岑苷(20、40、60、80、100 μg·mL-1),另设空白组,加入不含黄岑苷的培养基,各组设5个复孔,培养24 h。培养结束前4 h,加入浓度为1 mg·mL-1的MTT液50 μL/孔, 继续培养。800 r/min离心10 min,离心半径8 cm,弃去上清液。各孔加入含0.1%二甲基亚砜(dimethyl sulfoxide,DMSO)的DMEM培养基,室温下振荡10 min。待细胞内紫蓝色结晶溶解后,酶标仪检测570 nm波长处吸光度(optical density,OD)值,评估细胞增殖活性。
1.2.5 含药血清制备及细胞分组 将其余15只建模成功的雌鼠随机分为对照组、黄岑苷低剂量组和黄岑苷高剂量组,每组各5只。黄岑苷按照成人与大鼠给药等效剂量算换,成人临床有效剂量为280 μg·mL-1,换算成大鼠等效剂量为25 μg·mL-1。黄岑苷低剂量组以等效量1.0倍灌胃,即25 μg·mL-1;黄岑苷高剂量组以等效量4.0倍灌胃,即100 μg·mL-1;对照组以0.3 mL蒸馏水灌胃。各组均每隔12 h灌胃1次,2次/d,共3 d。第4天时,灌胃1次给全天量,给药后静待1 h,以2%戊巴比妥钠50 mg·kg-1腹腔注射麻醉,腹主动脉取血3 mL,静置1 h后3 000 r/min离心10 min,离心半径10 cm,分离血清。选取同一批传代、密度相同、培养皿大小相同的原代滋养细胞,分为A组、B组和C组,分别以对照组、黄岑苷低剂量组、黄岑苷高剂量组大鼠血清培养48 h,收集各组细胞。
1.2.6 胎盘滋养细胞侵袭能力检测 采用Transwell法检测。细胞分组和处理同1.2.5,在聚碳酸酯微孔滤膜上平铺人工基底膜Matrigel,37℃下静置3 h,转至室温环境过夜。下室加入100 μL不含胎牛血清的DMEM/F12培养基,37 ℃孵育1 h。 调整细胞浓度1.0×105个·mL-1,将细胞悬液逐滴加入置于24孔板的Transwell小室,各组设5个复孔,沿空隙中将含10%血清培养基加入各孔,清除气泡后培养24 h。取出滤膜,甲醛固定,苏木精-伊红(hematoxylin-eosin,HE)染色,200倍光镜下计数10个视野内的侵袭细胞数,评估滋养细胞侵袭能力。
1.2.7 miR-30d、GCM-1 mRNA表达检测 采用Real-time qPCR法检测。细胞分组和处理同1.2.5,收集各组培养24 h后滋养细胞,Trizol试剂盒提取总RNA,进一步逆转录成cDNA,进行Real-time qPCR扩增。引物序列:miR-30d:F:5'-GGGGAATATGTTAAATTAA-3',R:5'-AAACGGGGTCTACCGAGA-3';GCM-1:F:5'-GAG CAGAGGTGTGCGGCAAC-3',R:5'-GTGGTTTGATGTTGCAAGAGAGGC-3';U6:F:5'-ACTCACGGCCGTGATGAG-3',R:5'-TGATAGTCTCATCTCGGAA-3';βactin:F:5'-GACATCGTGGTAAGATGAAGGA-3',R:5'-TG TTGCTATATTCGTACCCAGCC-3'。反应条件:94℃,5 min,预变性;94 ℃,35 s,变性;58 ℃,35 s,退火;72 ℃,35 s,延伸,35个循环。 以2-△△CT法计算miR-30d、GCM-1 mRNA表达水平。
1.2.8 GCM-1蛋白相对表达量检测 采用免疫印迹法检测。细胞分组和处理同1.2.5,收集各组培养24 h后滋养细胞,PBS洗涤2次。冰上裂解、匀浆30 min。4℃下13 500 r/min离心10 min,离心半径8 cm。采用考马斯亮蓝法进行蛋白定量,加入等体积的2×上样缓冲液,沸水浴变性10 min。10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,分离蛋白,转膜后封闭1 h。加入兔抗大鼠GCM-1(稀释比例:1∶1 000)一抗,4 ℃孵育过夜。以含有吐温的Tris缓冲盐溶液(Tris buffered saline Tween,TBST)洗膜后加入二抗(稀释比例:1∶2 500),室温孵育2 h。洗膜后以Image Quant LAS4000生物分子成像仪显影曝光,观察蛋白条带灰度值。采用目的蛋白条带灰度值/β-actin条带灰度值计算目的蛋白表达水平。
1.3 统计学分析 采用SPSS 19.0统计软件进行统计学分析,计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用最小显著差异(least significant difference,LSD)-t检验。 以P<0.05为差异有统计学意义。
2 结果
2.1 滋养细胞分离、培养及鉴定结果 滋养细胞培养3 h后开始贴壁,培养20 h时基本完全贴壁,培养24 h时发生聚集、融合,多为单个核细胞,也可见多核细胞,体积逐渐增大。培养72 h左右传代,培养3~7 d时细胞融合增多,7 d后细胞退变,出现核固缩。免疫荧光鉴定显示滋养层细胞表达CK-7,细胞纯度(90.65±5.64)%。 见图1。

图1 原代滋养细胞形态观察(20×)Fig.1 Morphology observation of primary trophoblast(20×)
2.2 滋养细胞形态学特征 原代滋养细胞经消化、传代后,倒置显微镜下检查显示外观呈上皮样细胞形态,多为长多边形,体积大,核大呈卵圆形,呈片状延展生长,贴壁后呈铺路石样。见图2。

图2 倒置显微镜观察滋养细胞形态(100×)Fig.2 Observation of trophoblast under inverted microscope(100×)
2.3 各组滋养细胞增殖活性比较 各组间总体比较,OD值差异有统计学意义 (P<0.01)。 与空白组比较,20、40、60、80、100 μg·mL-1黄岑苷组OD值提升(P<0.05); 与20 μg·mL-1黄岑苷组比较,40、60、80、100 μg·mL-1黄岑苷组OD值提升(P<0.05);与40 μg·mL-1黄岑苷组比较,60、80、100 μg·mL-1黄岑苷组OD值提升 (P<0.05); 与60 μg·mL-1黄 岑 苷 组 比 较 ,80、100 μg·mL-1黄岑苷组OD值提升(P<0.05); 与80 μg·mL-1黄岑苷组比较,100 μg·mL-1黄岑苷组OD值提升 (P<0.05)。 见图3。

图3 各组滋养细胞增殖活性比较Fig.3 Comparison of proliferative activity of trophoblast in each group
2.4 各组滋养细胞侵袭能力比较 各组间总体比较,胎盘滋养细胞侵袭细胞数差异有统计学意义(P<0.01)。与A组比较,B、C组侵袭细胞数增多(P<0.05);与B组比较,C组侵袭细胞数增多 (P<0.05)。 见表1、图4。

图4 各组滋养细胞侵袭能力比较(HE染色,100×)Fig.4 Comparison of invasion ability of trophoblast in each group(HE staining, 100×)
表1 各组滋养细胞侵袭细胞数比较(±s,个/视野)Tab.1 Comparison of invasive cells of trophoblast in each group(±s, number/field)

表1 各组滋养细胞侵袭细胞数比较(±s,个/视野)Tab.1 Comparison of invasive cells of trophoblast in each group(±s, number/field)
注:与A组比较,◇P<0.05;与B组比较,◆P<0.05。Note:Compared with group A,◇P<0.05;compared with group B,◆P<0.05.
组别侵袭细胞数A 组 5 81.00±7.50 B 组 5 102.50±6.50◇C 组 5 126.50±7.50◇◆F值 50.218 P值 <0.01 n
2.5 各组滋养细胞miR-30d、GCM-1 mRNA表达水平比较 各组间总体比较,miR-30d、GCM-1 mRNA表达水平差异有统计学意义(P<0.01)。与A组比较,B、C组miR-30d表达水平降低,GCM-1 mRNA表达水平升高(P<0.05);与B组比较,C组miR-30d表达水平降低,GCM-1 mRNA表达水平升高(P<0.05)。见表2。
表2 各组miR-30d、GCM-1 mRNA表达比较(±s)Tab.2 Comparison of expression of miR-30d and GCM-1 mRNA in each group(±s)

表2 各组miR-30d、GCM-1 mRNA表达比较(±s)Tab.2 Comparison of expression of miR-30d and GCM-1 mRNA in each group(±s)
注:与A组比较,◇P<0.05;与B组比较,◆P<0.05。Note:Compared with group A,◇P<0.05;compared with group B,◆P<0.05.
组别 n miR-30d GCM-1 A 组 5 0.98±0.07 0.31±0.03 B 组 5 0.71±0.05◇ 0.54±0.05◇C 组 5 0.34±0.04◇◆ 0.81±0.07◇◆F值 172.056 113.193 P值 <0.01 <0.01
2.6 各组滋养细胞GCM-1蛋白表达水平比较 各组间总体比较,GCM-1蛋白表达水平差异有统计学意义(P<0.01)。与A组比较,B、C组GCM-1蛋白表达水平升高(P<0.05);与B组比较,C组GCM-1蛋白表达水平升高(P<0.05)。见表3、图5。

图5 免疫印迹法检测各组GCM-1蛋白表达Fig.5 Protein expression of GCM-1 in each group detected by Western blot
表3 各组滋养细胞GCM-1蛋白表达比较(±s)Tab.3 Comparison of expression of GCM-1 in each group(±s)
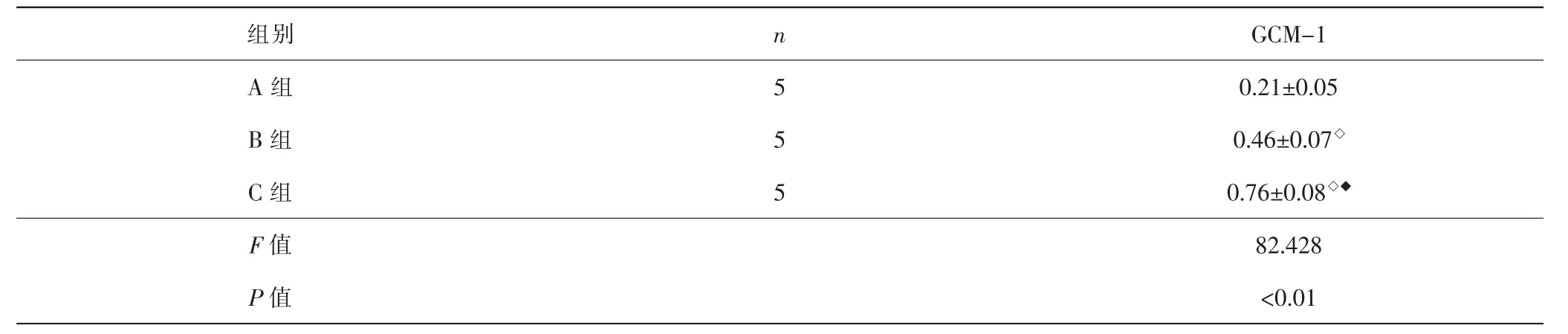
表3 各组滋养细胞GCM-1蛋白表达比较(±s)Tab.3 Comparison of expression of GCM-1 in each group(±s)
注:与A组比较,◇P<0.05;与B组比较,◆P<0.05。Note:Compared with group A,◇P<0.05;compared with group B,◆P<0.05.
组别GCM-1 A 组 5 0.21±0.05 B 组 5 0.46±0.07◇C 组 5 0.76±0.08◇◆F值 82.428 P值 <0.01 n
3 讨论
现阶段,子痫前期已逐渐成为引发孕、产妇死亡的一个重要原因,全球发病率高达2%~8%,受到临床医师和研究者的高度关注[9]。现代医学认为,子痫前期发病主要因为胎盘缺氧缺血、免疫功能下降、血管内皮损伤等,引发胎盘滋养细胞功能障碍,从而造成胎盘功能异常,但其分子机制尚不明确,故目前仍无特效治疗方法[10]。子痫前期在中医理论中属“子晕”“子眩”等范畴,中医多从脾虚、肾虚、气滞、血瘀等论治,认为其主要病机为气血同病,气血运行受阻,水停湿聚,湿邪重浊下滞,充任胞宫,郁久化热,湿热瘀结,因此多以滋阴潜阳、行气活血、散瘀利湿清热等药物调理[11]。黄岑为中医临床常用的保胎药材之一,可调节孕酮含量,有助于胚胎着床和维持妊娠,研究证实其成分黄岑苷具有抗炎、抗氧化、免疫调节等作用,且可减轻肿瘤坏死因子-α导致的主动脉内皮细胞损伤,维持内皮细胞完整性[12],但目前尚不明确黄岑苷对子痫前期胎盘滋养细胞增殖、侵袭能力的影响。
研究发现,胎盘滋养细胞增殖、侵袭能力的减弱在子痫前期发病中具有重要意义,且增殖、侵袭减弱程度与疾病严重程度相关[13]。黄岑苷属于黄酮类化合物,近年来有报道提出,多数黄酮类化合物具有抗炎、抗肿瘤、抗心肌缺血、保护神经组织、降压以及减轻生殖系统损伤等药理作用[14]。本研究评估了不同浓度黄岑苷对子痫前期大鼠胎盘滋养细胞增殖活性的影响,结果显示20、40、60、80、100 μg·mL-1黄岑苷组细胞OD值较空白组明显提升,增殖活性增高,且细胞增殖活性与黄岑苷浓度之间存在量效关系,说明黄岑苷可促进胎盘滋养细胞的增殖活性,其作用呈剂量依赖性。另外,Transwell法检测提示,黄岑苷还可增强滋养细胞侵袭能力,而且作用也呈剂量依赖性。
miRNA是长度为20~24个核苷酸的非编码RNA家族[15]。近年来有学者发现,miRNA与子痫前期发生、发展有一定相关性,因此靶向调控miRNA逐渐成为子痫前期诊断及治疗的新方向[16]。其中,miR-30d在肿瘤细胞增殖、分化、凋亡等生物学过程中发挥重要作用[17]。王焕萍等[18]研究发现,子痫前期孕妇胎盘组织中存在miR-30d高表达,认为其表达上调可能参与了子痫前期的发生、发展。GCM-1为胎盘发育关键转录因子之一,参与滋养细胞浸润过程,还可通过调节胎盘生长因子表达,促进胎盘血管生成[19]。本研究发现,黄岑苷给药后滋养细胞miR-30d表达水平降低,GCM-1 mRNA及蛋白表达水平升高,且效果呈剂量依赖性,提示黄岑苷可抑制miR-30d表达、上调GCM-1蛋白表达,这可能是黄岑苷提升子痫前期大鼠胎盘滋养细胞增殖和侵袭能力的作用机制之一。
综上所述,黄岑苷可提升子痫前期大鼠的胎盘滋养细胞增殖和侵袭能力,其作用机制可能与抑制miR-30d表达、上调GCM-1蛋白表达有关,这一结论可为临床子痫前期防治工作提供一定的参考依据。另外,本研究也存在不足之处,如大鼠样本量少,可能影响结果准确性;而且对机制的探讨尚处于初级阶段,仍不够深入等。黄岑苷对子痫前期大鼠胎盘滋养细胞增殖、侵袭影响的其他机制仍未明确,今后仍需进一步深入研究。
